





第17讲 化学工艺流程-2022高考化学二轮复习高分冲刺课件
展开真 题 感 悟——悟真题、明方向
核电荷数P
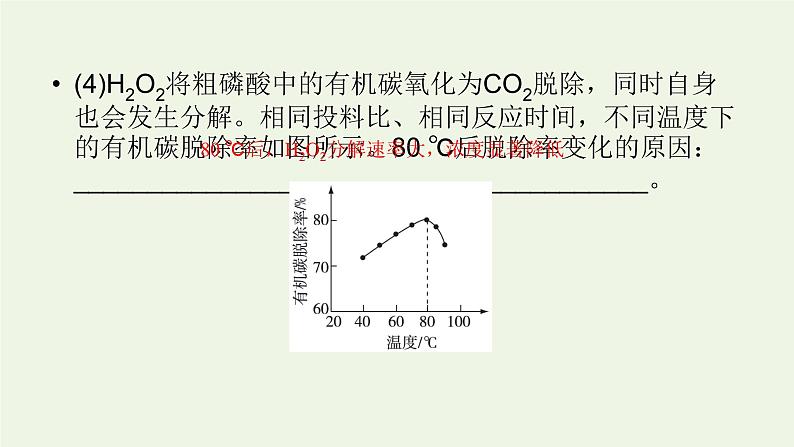
80 ℃后,H2O2分解速率大,浓度显著降低
2.(2018·浙江,31)某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
②ZnSO4的溶解度(物质在100 g水中溶解的质量)随温度变化曲线。
请回答:(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是_____________________________________________。②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是_________________________。(2)步骤Ⅱ,需加入过量H2O2,理由是____________________________________________________________。(3)步骤Ⅲ,合适的pH的范围是___________。
Na2CO3水解,溶液呈碱性,促使油脂水解
产生气泡的速度显著变慢
使Fe2+尽可能转化为Fe3+,且H2O2易分解(Fe3+催化加速分解)
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60 ℃蒸发溶剂;c.冷却至室温;d.在100 ℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序_______________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_____(填字母)方式进行冷却结晶。A.快速降温 B.缓慢降温 C.变速降温
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。①下列关于滴定分析,正确的是_________(填字母)。A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端B.滴定前,锥形瓶和滴定管均须用标准溶液润洗C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小②图3中显示滴定终点时的读数是__________mL。
[解析] (1)①Na2CO3水解呈碱性,可以促进油脂的水解;由于镀锌铁皮能形成原电池,且Zn作负极,所以一开始产生H2速率快,当Zn完全反应后,Fe与H2SO4反应产生H2的速率明显减慢。(2)加入H2O2,主要目的是使Fe2+转化成Fe3+,由于Fe3+能使H2O2分解,所以H2O2应过量。(3)调节pH应使Fe3+完全沉淀,而Zn2+不沉淀,所以pH范围应为2.8≤pH<5.4。(5)根据图示,变速降温得到的晶粒较大。(6)①B项,滴定时,锥形瓶不能用标准溶液润洗;C项,将标准液装入滴定管时,应将标准液直接注入滴定管,若借助烧杯或漏斗转移,会造成标准液不标准;E项,若滴定前滴定管尖嘴内无气泡,滴定后有气泡,会造成读出的标准溶液的体积偏小;②滴定管读数时,精确到小数点后2位。
3.(2019·全国Ⅱ,26)立德粉ZnS·BaSO4(也称锌钡白),是一种常用白色颜料。回答下列问题:(1)利用焰色反应的原理既可制作五彩缤纷的节日烟花,亦可定性鉴别某些金属盐。灼烧立德粉样品时,钡的焰色为_____(填标号)。A.黄色B.红色C.紫色D.绿色(2)以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
①在回转炉中重晶石被过量焦炭还原为可溶性硫化钡,该过程的化学方程式为______________________________________。回转炉尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,该反应的化学方程式为__________________________________。②在潮湿空气中长期放置的“还原料”,会逸出臭鸡蛋气味的气体,且水溶性变差,其原因是“还原料”表面生成了难溶于水的_____________(填化学式)。③沉淀器中反应的离子方程式为_____________________________________。
CO+H2O===CO2+H2
►知能补漏一、工业流程的十个常用关键词1.漫出:固体加入水或酸(碱)溶解得到离子。2.酸浸:指在酸溶液中反应使可溶金属离子进入溶液,不溶物通过过滤除去溶解的过程。3.水洗:水洗通常是为了除去水溶性的杂质。冷水洗涤:减少洗涤过程中晶体的溶解损失。有机物洗涤:减少晶体损失,且有利于晶体干燥。
核 心 突 破——补知能、学方法
4.灼烧(煅烧):原料的预处理,不易转化的物质转为容易提取的物质,如海带中提取碘等。5.酸的作用:溶解、去氧化物(膜)、调节pH促进水解(沉淀)。6.碱的作用:去油污,去铝片氧化膜,溶解铝、二氧化硅,调节pH促进水解(沉淀)。7.氧化剂:氧化某物质,转化为易于被除去(沉淀)的离子。8.控制pH:促进某离子水解,使其沉淀,利于过滤分离。9.煮沸:促进水解,聚沉后利于过滤分离;除去溶解在溶液中的气体,如氧气。10.趁热过滤:减少结晶损失;提高纯度。
二、获得产品阶段的常见考查点1.洗涤(冰水、热水):洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗;乙醇洗涤既可洗去晶体表面的杂质,又可减少晶体溶解的损耗。2.蒸发时的气体氛围抑制水解:如从溶液中析出FeCl3、AlCl3、MgCl2等溶质时,应在HCl的气流中加热,以防其水解。3.蒸发浓缩,冷却结晶:如NaCl和K2Cr2O7混合溶液,若将混合溶液加热蒸发后再降温,则析出的固体主要是K2Cr2O7,这样就可分离出大部分K2Cr2O7;同样原理可除去KNO3中的少量NaCl。4.蒸发结晶、趁热过滤:如NaCl和K2Cr2O7混合溶液,若将混合溶液蒸发一段时间,析出的固体主要是NaCl,同样原理可除去NaCl中的少量KNO3。
►方法指导1.化工流程解题方法:(1)解题策略
(2)物质判断:主线主产品,副线副产品,回头为循环。
1.(2018·江苏高考)以Cl2、NaOH、CO(NH2)2(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水 Na2SO3,其主要实验流程如下:已知:①Cl2+ 2OH-===ClO- + Cl- + H2O是放热反应。②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
备 考 验 证——练典题、重应用
(1)步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为______________________________________;实验中控制温度除用冰水浴外,还需采取的措施是_________________。
(2)步骤Ⅱ合成N2H4·H2O的装置如图1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是_____________________;使用冷凝管的目的是___________________。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为_____________________________________________。②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案:______________________________________________________________________________________________________________________________________________,用少量无水乙醇洗涤,干燥,密封包装。
测量溶液的pH,若pH约为4,停止通SO2
边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34 ℃条件下趁热过滤
②微电池处理过程中部分硝基苯被新生成的活性Fe2+还原成苯胺,该反应的离子反应方程式为______________________________________________。(4)①一次沉降池中通入空气的目的是_______________________________。②一次沉降池中适当的升温有利于沉渣的迅速沉降,分析原因:_________________________________________________________。(用适当的文字描述和离子方程式解释)
(5)上图中微生物在空气存在的条件下降解苯胺的化学反应方程式为____________________________________________________。(6)利用惰性吸附电极电解含硝基苯的废水,同样可以将剧毒的硝基苯转化成苯胺,在电解的过程中,含硝基苯的废水应从_____(填“阳”或“阴”)极室流入。
1.(2019·全国Ⅰ,27)硫酸铁铵[NH4Fe(SO4)2·xH2O]是一种重要铁盐。为充分利用资源,变废为宝,在实验室中探究采用废铁屑来制备硫酸铁铵,具体流程如下:
考点二 物质分离提纯型
回答下列问题:(1)步骤①的目的是去除废铁屑表面的油污,方法是___________。(2)步骤②需要加热的目的是___________,温度保持80-95 ℃,采用的合适加热方式是_________。铁屑中含有少量硫化物,反应产生的气体需要净化处理,合适的装置为_____(填标号)。
(3)步骤③中选用足量的H2O2,理由是___________________________________________。分批加入H2O2,同时为了___________________,溶液要保持pH小于0.5。(4)步骤⑤的具体实验操作有___________________________________,经干燥得到硫酸铁铵晶体样品。(5)采用热重分析法测定硫酸铁铵晶体样品所含结晶水数,将样品加热到150 ℃时失掉1.5个结晶水,失重5.6%。硫酸铁铵晶体的化学式为________________________。
将Fe2+全部氧化为Fe3+;不引入杂质
加热浓缩、冷却结晶、过滤(洗涤)
NH4Fe(SO4)2·12H2O
[解析] (1)除去铁屑表面油污的方法是,用热纯碱溶液清洗铁屑,再用水洗。(2)铁与稀硫酸反应时加热,可提高反应速率。温度低于水的沸点,可以用热水浴加热,受热均匀且便于控制。含少量硫化物的铁屑与稀硫酸反应有H2S生成。氢气不与碱溶液反应,而硫化氢能与碱溶液反应,而H2S在水中溶解度小,故氢气中混有的硫化氢用烧碱溶液除去,又因为硫化氢与碱反应较快,容易引起倒吸,C装置倒置漏斗能防倒吸。故宜选择C装置吸收硫化氢。(3)铁与稀硫酸反应生成硫酸亚铁和氢气,加入足量双氧水的目的是将Fe2+全部氧化为Fe3+,发生反应为2Fe2++H2O2+2H+===2Fe3++2H2O,从生成物看,又不引入杂质。
2.(2019·全国Ⅲ,26)高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:相关金属离子[c0(Mn+)=0.1 ml·L-1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和_____________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_____________________________________________。(2)“氧化”中添加适量的MnO2的作用是___________________________。(3)“调pH”除铁和铝,溶液的pH范围应调节为_________~6之间。(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是_________________。
SiO2(不溶性硅酸盐)
MnO2+MnS+2H2SO4===2MnSO4+S+2H2O
将Fe2+氧化为Fe3+
[解析] (1)硫化锰矿中硅元素主要以SiO2或不溶性硅酸盐形式存在,则“滤渣1”的主要成分为S和SiO2(或不溶性硅酸盐)。结合“滤渣1”中含S,可知“溶浸”时MnO2与MnS在酸性条件下发生氧化还原反应生成MnSO4和S,根据化合价升价法可配平该反应。(2)“溶浸”后溶液中含Fe2+,“氧化”中加入的适量MnO2能将Fe2+氧化为Fe3+。(3)“调pH”除去Fe3+和Al3+时,结合表格中数据信息可知需控制溶液的pH在4.7~6之间。(4)“除杂l”中加入Na2S能将Zn2+和Ni2+分别转化为沉淀除去,故“滤渣3”的主要成分为NiS和ZnS。
►知能补漏1.物质提纯流程题的解题思路:(1)阅读题干信息,找出要提纯的物质。(2)解读操作流程,找出与题干相关的操作步骤,辨别出预处理、反应、提纯、分离等阶段。(3)分析流程中的每一步骤,反应物是什么、发生了什么反应、该反应造成了什么后果,对制造产品有什么作用。
2.无机化工流程中的常见分离方法:(1)洗涤(冰水、热水):洗去晶体表面的杂质离子。(2)过滤(热滤或抽滤):分离难溶物和易溶物。(3)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质。(4)蒸发结晶:提取溶解度随温度的变化变化不大的溶质。(5)冷却结晶:提取溶解度随温度的变化变化较大的溶质、易水解的溶质或结晶水合物。(6)蒸馏或分馏:分离沸点不同且互溶的液体混合物。(7)冷却水:利用气体易液化的特点分离气体。
1.(新题预测)碲(Te)凭借优良的性能成为制作合金添加剂、半导体、光电元件的主体材料,并被广泛应用于冶金、航空航天、电子等领域。可从精炼铜的阳极泥中(主要成分为Cu2Te)回收碲,工艺流程如下:
回答下列问题:(1)“焙烧”后,碲主要以TeO2形式存在,写出相应反应的化学方程式:____________________________________________________。(2)为了选择最佳的焙烧工艺,进行了温度和硫酸加入量的条件试验,结果如表所示:
则实验中应选择的条件为__________________________________________,原因为_______________________________________。(3)工艺(Ⅰ)中,“还原”时发生的总的化学方程式为__________________________________________________。(4)由于工艺(Ⅰ)中“氧化”对溶液和物料条件要求高,有研究者采用工艺(Ⅱ)获得碲。则“电积”过程中,阴极的电极反应式为_______________________________________。
460 ℃、硫酸用量为理论量的1.25倍
该条件下,铜的浸出率高且碲的损失较低
Na2TeO4+3Na2SO3+H2SO4===4Na2SO4+Te+H2O
(5)工业生产中,滤渣2经硫酸酸浸后得滤液3和滤渣3。①滤液3与滤液1合并,进入铜电积系统。该处理措施的优点为_______________________________________。②滤渣3中富含Au和Ag,可用_____将其进行分离。A.王水B.稀硝酸C.浓氢氧化钠溶液D.浓盐酸
CuSO4溶液循环利用,提高经济效益
2.(2019·沈阳一模)工业上用铬铁矿(主要成分可表示为FeO·Cr2O3,还含有Al2O3、MgCO3、SiO2等杂质)为原料制备重铬酸钾晶体和绿矾的流程如下:
已知:Ⅰ.常见离子沉淀的pH范围Ⅱ.熔融Na2CO3条件下主要发生反应:2FeO·Cr2O3+4Na2CO3+7NaNO3===4Na2CrO4+Fe2O3+4CO2↑+7NaNO2。
回答下列问题:(1)绿矾的化学式为_______________________。(2)滤液1中除含有Na2CrO4、NaNO2和过量的Na2CO3、NaNO3外,还含有NaAlO2和Na2SiO3,则熔融Na2CO3条件下发生的副反应有_____________________________________________________________________ (用化学方程式表示)。(3)滤渣2的主要成分为____________________(填写化学式)。
FeSO4·7H2O
H2SiO3和Al(OH)3
在该条件下K2Cr2O7的溶解度最低,更易分离
蒸发浓缩、冷却结晶、过滤
3.(2019·河南开封二模)亚氯酸钠(NaClO2)主要用于棉纺、亚麻、腈纶、涤纶等纤维漂白(不适于羊毛、绢丝、粘胶丝、尼龙等),也可用于食品、饮用水消毒、纸张漂白和鱼药制造。工业上常用电解法生产亚氯酸钠( NaClO2),请根据下面的工艺流程图回答下列问题:已知:纯的ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下才能安全。
加入过量的Na2CO3溶液时,BaSO4(s)会部分转化为BaCO3(s),从而释放出SO
第7讲 化学能与热能-2022高考化学二轮复习高分冲刺课件: 这是一份第7讲 化学能与热能-2022高考化学二轮复习高分冲刺课件,共43页。PPT课件主要包含了高考点击,分层突破,考点一反应热与焓变,+531,-93等内容,欢迎下载使用。
第4讲 离子反应-2022高考化学二轮复习高分冲刺课件: 这是一份第4讲 离子反应-2022高考化学二轮复习高分冲刺课件,共60页。PPT课件主要包含了高考点击,分层突破,考点二离子共存,防止Fe2+被氧化,Fe2+,Fe3+,可逆反应,Cl-等内容,欢迎下载使用。
第3讲 化学用语及常用计量-2022高考化学二轮复习高分冲刺课件: 这是一份第3讲 化学用语及常用计量-2022高考化学二轮复习高分冲刺课件,共60页。PPT课件主要包含了高考点击,分层突破,考点一化学用语,八种表达式,无影响,量取95mL水①,仰视刻度②,滴定管液面③,借题发挥,避免b中压强过大等内容,欢迎下载使用。












