






高中化学人教版 (2019)选择性必修2第二节 分子晶体与共价晶体图片课件ppt
展开一、分子晶体及其结构特点1.概念及微粒间的作用力:(1)概念:只含_____的晶体称为分子晶体。(2)粒子间的相互作用力:分子晶体内相邻分子间以_____________相互吸引,分子内原子之间以_______结合。
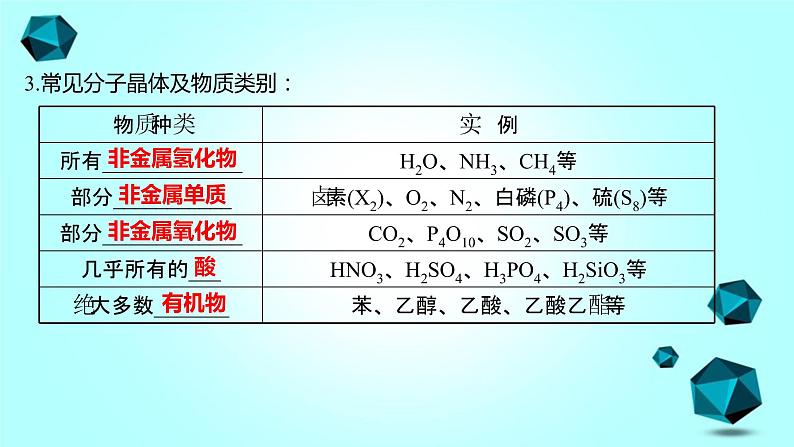
3.常见分子晶体及物质类别:
4.分子晶体的物理性质(1)一般熔、沸点_____,硬度_____,易挥发,易升华。原因:__________________。(2)分子晶体固态和熔融态一般不导电。原因:_______________________。但有的在水溶液中能导电,有的不能导电。(3)溶解性:分子晶体的溶解性一般遵循“相似相溶”原理,即非极性溶质易溶于_______溶剂,极性溶质易溶于_____溶剂。
没有自由移动的带电粒子
【自主探索】(1)分子晶体中只存在分子间作用力吗?提示:不一定。分子晶体中一定存在分子间作用力,分子内原子间则可能存在共价键,而单原子分子形成的分子晶体则只存在分子间作用力。(2)分子晶体中,分子间作用力越大,对应的物质越稳定吗?提示:决定分子稳定性大小的因素是化学键的强弱,而分子间作用力大小决定分子晶体熔沸点的高低。
(3)判断下列说法是否正确。①分子晶体中一定含有分子间作用力,不一定含有化学键。( )提示:稀有气体单质是单原子分子,固态时属于分子晶体,分子间只含分子间作用力,不含化学键。②分子晶体熔化时,既破坏分子间作用力,也有共价键断裂。( )提示:分子晶体受热熔化时,只破坏分子间作用力,不破坏共价键。③冰融化和干冰升华破坏的作用力完全相同。( )提示:干冰升华只破坏范德华力,而冰融化除破坏范德华力外,还破坏氢键。
二、两种典型分子晶体的组成和结构1.冰(1)水分子之间的主要作用力是_________,也存在_____。(2)_____有方向性,它的存在迫使在___________的每个水分子与___________方向的__个相邻水分子互相吸引。
2.干冰(1)干冰中的CO2分子间只存在_________,不存在_____。(2)①每个晶胞有__个CO2分子,___个原子。②每个CO2分子周围等距离紧邻的CO2分子数为___个。
【自主探索】(情境思考)常温下,液态水中水分子在不停地做无规则的运动。0 ℃以下,水凝结为冰,其中的水分子排列由杂乱无序变得十分有序。
(1)冰晶体中存在着哪几种微粒间的相互作用?提示:共价键、氢键、范德华力。(2)电解水生成氢气和氧气时破坏的作用力是什么?提示:共价键。(3)为什么液态水的密度大于冰的密度?提示:由于在冰的晶体中,水分子之间形成氢键,水分子之间以缔合分子形式存在,占据的空间增大,密度减小。
【合作探究】(1)影响分子晶体的熔、沸点有哪些因素?提示:氢键、范德华力、极性。(2)影响分子晶体的溶解度有哪些因素?提示:相似相溶原理、氢键、化学反应。
【母题追问】(1)分子晶体在熔化时,破坏的作用力是什么?提示:破坏分子间作用力(氢键、范德华力)。(2)分子晶体溶于水时,化学键如何变化?提示:有的溶于水破坏化学键,例如HCl;有的不破坏化学键,例如蔗糖、乙醇。
【解析】选B。从各图中可以看出②⑤都不能再以化学键与其他原子结合,所以最有可能是分子晶体。
【解析】选A。根据提供信息,可以判断BeCl2为分子晶体。BeCl2在熔融态不导电,A项正确;BeCl2溶液由于Be2+水解呈酸性,B项错误;BeCl2、BeBr2均为分子晶体,组成和结构相似的分子晶体,相对分子质量越大,熔点越高,则熔点BeCl2<BeBr2,C项错误;BeCl2与AlCl3性质相似,由AlCl3也能与NaOH溶液反应可以类推BeCl2能与NaOH溶液反应,D项错误。
选择性必修2第二节 分子晶体与共价晶体教课内容课件ppt: 这是一份选择性必修2第二节 分子晶体与共价晶体教课内容课件ppt,共38页。PPT课件主要包含了第1课时分子晶体,分子间作用力,非金属氢化物,非金属单质,非金属氧化物,有机物,反常高,正误判断,深度思考,应用体验等内容,欢迎下载使用。
高中化学第二节 分子晶体与共价晶体集体备课ppt课件: 这是一份高中化学第二节 分子晶体与共价晶体集体备课ppt课件,共60页。PPT课件主要包含了NO1,NO2,NO3,点击右图进入等内容,欢迎下载使用。
2021学年第三章 晶体结构与性质第二节 分子晶体与共价晶体图文课件ppt: 这是一份2021学年第三章 晶体结构与性质第二节 分子晶体与共价晶体图文课件ppt,共24页。PPT课件主要包含了共价晶体的概念,共价晶体,常见的共价晶体,构成微粒,微粒间相互作用,共价键,典型共价晶体,金刚石,金刚石的结构特征,sp3等内容,欢迎下载使用。













