




2022版高考化学选考山东专用一轮总复习课件:专题十二化学反应速率和化学平衡 —应用篇
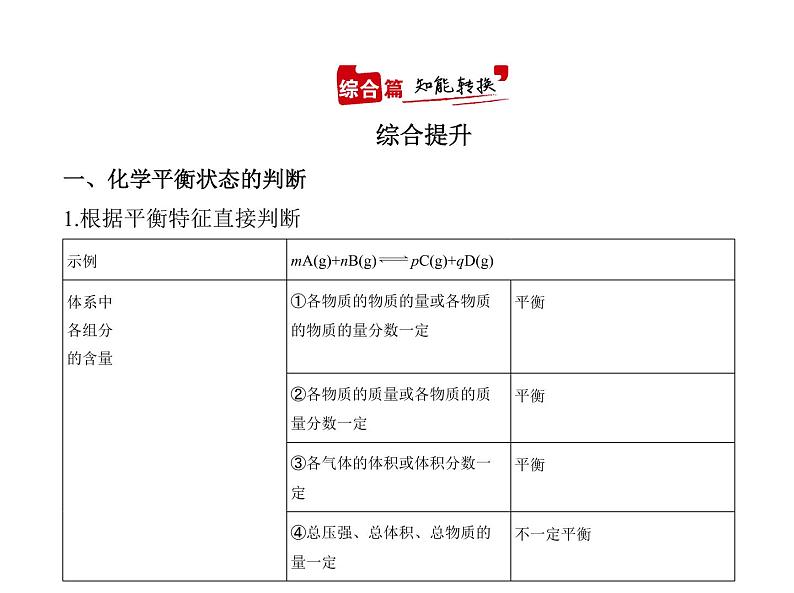
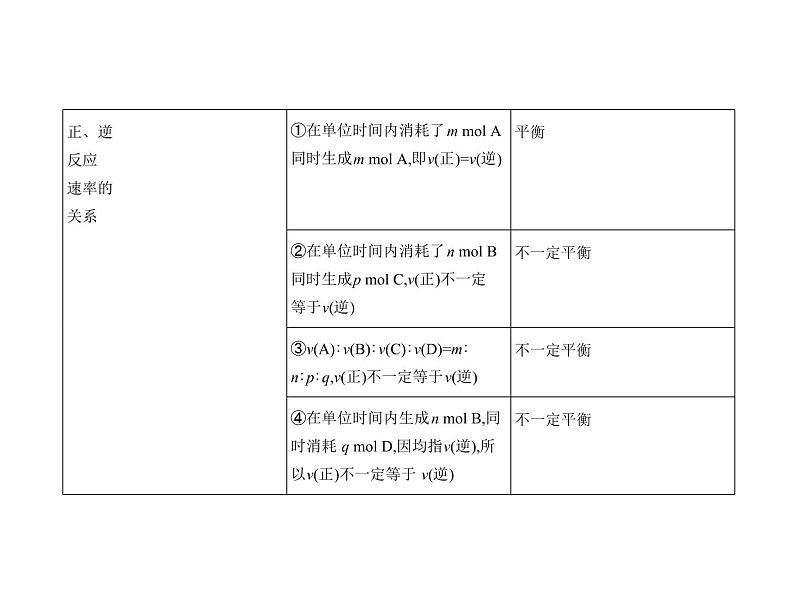
展开一、化学平衡状态的判断1.根据平衡特征直接判断
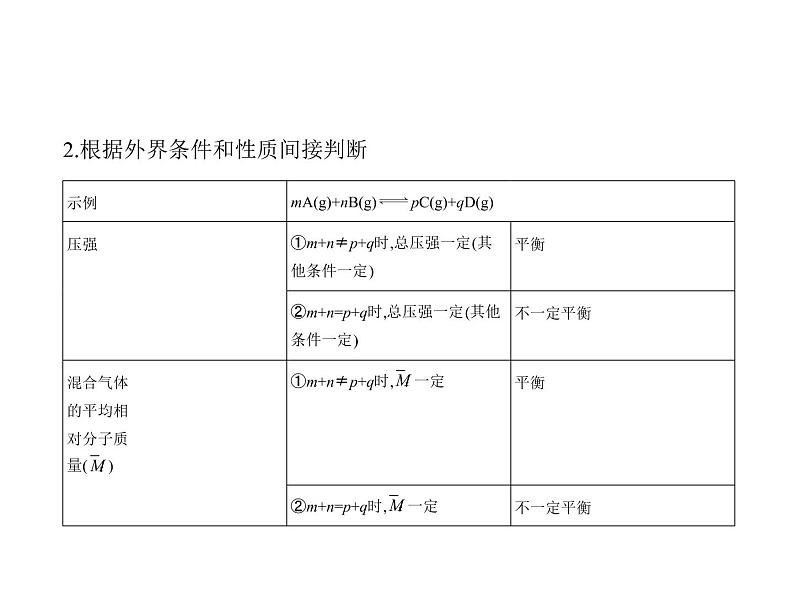
2.根据外界条件和性质间接判断
例1 一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g) 2C(g),下列说法说明达到平衡状态的是 ( )①C的生成速率和C的分解速率相等;②单位时间内生成a ml A,同时生成3a ml B;③气体密度不再变化;④混合气体的总压强不再变化;⑤A、B、C的物质的量之比为1∶3∶2;⑥混合气体的平均相对分子质量不变。A.②④⑤ B.①③④⑥C.①②④⑥ D.①②③④⑤
解题导引 判断反应是否达到平衡状态:如果是一个变化的量不再变化, 说明反应达到了平衡状态;如果是一个一直不变的量,不可以作为判断反 应是否达到平衡状态的标志。
解析 C的生成速率与C的分解速率相等,v正=v逆,说明反应已达到平衡状 态,①正确;单位时间内生成a ml A是逆反应,同时生成3a ml B也是逆反 应,无法确定是否平衡,②错误;ρ=m/V,有固体参加反应,气体的总质量会 变,体积不变,密度是一个随反应变化的量,当不再变化时说明达到平衡状 态,③正确;反应前后气体分子数发生改变,体积恒定,气体总压强是一个 随反应变化的量,当不再变化时说明达到平衡状态,④正确;⑤平衡时各物 质的物质的量之比取决于物质的起始物质的量和转化率,故A、B、C的 物质的量之比为1∶3∶2不能作为判断是否达到平衡状态的依据,⑤错 误;题给反应中混合气体的平均相对分子质量是一个随反应变化的量,当 不再变化时说明达到平衡状态,⑥正确;故选B。
二、化学平衡图像(一)化学平衡相关图像类型1.速率—温度(压强)图像例如:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·ml-1 图中交点是平衡状态,温度升高后逆反应速率增大得快,平衡逆向移动;压
强增大后正反应速率增大得快,平衡正向移动。2.转化率(或百分含量)—温度(压强)—时间图像已知不同温度或压强下,反应物的转化率α(或百分含量)与时间的关系曲 线,推断温度的高低、反应的热效应、压强的大小及气体物质间的化学 计量数的关系。[以mA(g)+nB(g) qC(g)中反应物的转化率αA为例说明]
解答这类图像题时应注意以下两点:(1)“先拐先平,数值大”原则分析反应由开始(起始物质相同)达到平衡所用时间的长短可推知反应条 件的变化。①若为温度差别所引起的,温度较高时,反应达平衡所需时间短。如图甲 中T2>T1。②若为压强差别所引起的,压强较大时,反应达平衡所需时间短。如图乙 中p1>p2。③若使用了适宜催化剂,反应达平衡所需时间短。如图丙中曲线a对应反 应使用了催化剂。(2)正确掌握图像中反应规律的判断方法
①图甲中,T2>T1,升高温度,αA降低,平衡逆向移动,正反应为放热反应。②图乙中,p1>p2,增大压强,αA升高,平衡正向移动,则正反应为气体体积缩 小的反应。③若纵坐标表示A的百分含量,则图甲中正反应为吸热反应,图乙中正反 应为气体体积增大的反应。3.恒温线(恒压线)图像已知不同温度下的转化率—压强图像或不同压强下的转化率—温度图 像,推断反应的热效应或反应前后气体物质间化学计量数的关系。[以反 应mA(g)+nB(g) qC(g)中反应物的转化率αA为例说明]
解答这类图像题时应从两方面入手:(1)“定一议二”原则:可通过分析相同温度下不同压强时反应物A的转 化率大小来判断平衡移动的方向,从而确定反应方程式中反应物与产物 气体物质间的化学计量数的大小关系。如图甲中任取一条温度曲线研 究,压强增大,αA增大,平衡正向移动,正反应为气体体积减小的反应;图乙
中任取横轴上的一点作垂线,也能得出结论。(2)通过分析相同压强下不同温度时反应物A的转化率的大小来判断平衡 移动的方向,从而确定反应的热效应。如利用上述分析方法,在图甲中对 横轴上的一点作垂线,或在图乙中任取一曲线,即能分析出正反应为放热 反应。4.几种特殊图像(1)对于化学反应mA(g)+nB(g) pC(g)+qD(g),M点前,表示化学反应从反应物开始,则v正>v逆;M点为刚达到的平衡点。M点后为平衡受温度的影 响情况,即升温,A%增大(C%减小),平衡左移,ΔH<0。
(2)对于化学反应mA(g)+nB(g) pC(g)+qD(g),L线上所有的点都是平衡点。左上方E点对应的A%大于此压强时平衡体系中的A%,E点必须朝正 反应方向移动才能达到平衡状态,所以E点处v正>v逆;同理,右下方F点处v正< v逆。
(二)化学平衡相关图像题的解题步骤
例2 (2020济南二中高三线上检测,12)向某容积为2 L的恒容密闭容器中 充入2 ml X(g)和1 ml Y(g),发生反应2X(g)+Y(g) 3Z(g)。反应过程中,持续升高温度,测得混合体系中X的体积分数与温度的关系如图所 示。下列推断正确的是 ( ) A.M点时,Y的转化率最大B.平衡后充入X,达到新平衡时X的体积分数减小
C.升高温度,平衡常数减小D.W、M两点Y的正反应速率相同
解题导引 分析图像时要注意横坐标、纵坐标的意义以及曲线的变化 情况,对图像上的点进行定性与定量相结合的分析。
解析 起始时向容器中充入2 ml X(g)和1 ml Y(g),反应从左到右进行, 结合图像,由起点至Q点,X的体积分数减小;Q点之后,随着温度升高,X的 体积分数增大,意味着Q点时反应达到平衡状态,温度升高,平衡逆向移动, 反应从右向左进行。Q点之前,反应向右进行,Y的转化率不断增大,Q点→ M点的过程中,平衡逆向移动,Y的转化率下降,因此Q点时Y的转化率最 大,A错误;平衡后充入X,X的体积分数增大,平衡正向移动,根据勒夏特列 原理,平衡移动只能减弱而不能抵消这种改变,达到新的平衡时,X的体积 分数仍比原平衡大,B错误;根据以上分析,升高温度,平衡逆向移动,平衡常 数减小,C正确;容器体积不变,W、M两点X的体积分数相同,Y的体积分数 及浓度也相同,但M点温度更高,Y的正反应速率更快,D错误;故选C。
一、应用“三段式”法解化学平衡的有关计算1.化学平衡的计算一般涉及化学平衡常数、各组分的物质的量、浓度、 转化率、百分含量等,通过写出化学方程式,先列出相关量(起始量、转化 量、平衡量),然后根据已知条件建立关系式进行解题。2.可按下列步骤建立模型,确定关系式进行计算。如可逆反应mA(g)+nB (g) pC(g)+qD(g),在体积为V L的恒容密闭容器中,反应物A、B的初始加入量分别为a ml、b ml,达到化学平衡时,设A物质转化的物质的量 为mx ml。(1)模型mA(g)+ nB(g) pC(g)+ qD(g)起始量/ml a b 0 0
转化量/ml mx nx px qx平衡量/ml a-mx b-nx px qx则有:①平衡常数:K= 。②平衡时A的物质的量浓度:c(A)= ml·L-1。③平衡时A的转化率:α(A)= ×100%,A、B的转化率之比为α(A)∶α(B)= ∶ 。④平衡时A的体积分数:φ(A)= ×100%。
⑤平衡时和开始时的压强比: = 。⑥平衡时混合气体的平均摩尔质量 = 。(2)基本步骤①写出可逆反应化学方程式;②确定反应物和生成物的初始加入量;③确定反应过程的转化量;④确定平衡量。
例1 (2020临沂一模,13)甲、乙均为1 L的恒容密闭容器,向甲中充入1 ml CH4和1 ml CO2,乙中充入1 ml CH4和n ml CO2,在催化剂存在下发 生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是 ( )
A.该反应的正反应是吸热反应B.773 K时,该反应的平衡常数小于的体积分数:φ(b)=φ(c)D.873 K时,向甲的平衡体系中再充入CO2、CH4各0.4 ml,CO、H2各1.2 ml,平衡不发生移动
解析 温度升高,CH4的平衡转化率增大,说明温度升高有利于反应正向 进行,则正反应为吸热反应,A正确;873 K时,c点CH4的平衡转化率为60%, 列“三段式”: 则K= =12.96,温度升高,CH4的平衡转化率增大,平衡正向移动,平衡常数增大,则773 K时该反应的平衡常数小于12.96,B正确;根据图像,相 同温度下乙中甲烷的平衡转化率大于甲中,则n>1,b、c点甲烷的平衡转 化率相等,则两点平衡时体系中CH4、CO、H2物质的量分别相等,但b中
CO2物质的量大于c中,则H2的体积分数:φ(b)<φ(c),C错误;873 K时,甲容器 中甲烷的平衡转化率为60%,列三段式: 平衡常数K=12.96,向甲的平衡体系中再充入CO2、CH4各0.4 ml,CO、H2 各1.2 ml,Qc= =51.84>K=12.96,平衡逆向移动,D错误。
题目价值 在化学平衡的计算中,常常要计算反应物的转化率、各组分 的转化浓度、转化的物质的量、平衡浓度、平衡时物质的量等,如果用 “三段式”法进行计算,能够快速得到结果。
二、突破压强平衡常数Kp计算近几年高考试题,压强化学平衡常数几乎成了必考内容。1.概念:在化学平衡体系中,用各气体物质的平衡分压替代浓度来计算平 衡常数,称为压强平衡常数。2.计算步骤(1)根据“三段式”法计算平衡体系中各气体物质的物质的量或物质的 量浓度;(2)计算各气体组分的物质的量分数(或体积分数);(3)根据分压计算公式求出各气体物质的平衡分压,某气体的平衡分压=气 体总压强×该气体的物质的量分数(或体积分数);(4)根据平衡常数计算公式代入计算。
例2 (2020山东等级考模拟二,15)氨基甲酸铵发生分解的化学方程式为 NH2COONH4(s) 2NH3(g)+CO2(g)。利用如下装置测定不同温度下该反应以分压表示的化学平衡常数Kp,实验步骤如下:(Ⅰ)关闭K3,打开K1和K2,开启真空泵抽气至测压仪数值稳定后关闭K1;(Ⅱ)关闭K2,缓慢开启K3至U形管两边液面相平并保持不变,读取压强数 值。记录25 ℃、30 ℃下压强分别为12.0 kPa、17.1 kPa。下列说法错误 的是 ( )
A.氨基甲酸铵分解反应的ΔH>0B.该反应25 ℃时的化学平衡常数 =2.56×1011 Pa3C.步骤Ⅰ中测压仪数值未稳定即关闭K1,Kp测量值偏小
D.步骤Ⅱ中读数时U形管左侧液面偏高,Kp测量值偏小
解析 温度升高气压增大,由反应可知,平衡正移,则正反应为吸热反应,A 正确;设CO2的压强为x Pa,则NH3的压强为2x Pa,总压强为12.0 kPa,则p(CO 2)= =4 000 Pa,p(NH3)=2p(CO2)=8 000 Pa,则 Kp=p(CO2)×p2(NH3)=2.56×1011 Pa3,B正确;步骤Ⅰ中测压仪数值未稳定即关闭K1,U形管左侧会有 残留空气,导致Kp测量值偏大,C错误;步骤Ⅱ中读数时U形管左侧液面偏 高,则证明左侧气压小于右侧,Kp测量值偏大,D错误。
题目价值 有关Kp的计算是近几年高考中的常考内容,该题很好地体现 了定量探究化学平衡的学科素养,考查了学生综合运用知识分析问题、 探究问题的关键能力。
速率常数的应用速率常数是近几年高考的热点之一,考查时稳中有变,变中有新意,旨在考 查考生的迁移运用能力,体现了证据推理与模型认知、变化观念与平衡 思想两大学科素养;考生需理解化学反应速率常数,学会灵活变通,举一反 三。1.速率常数含义大多数化学反应都是分几步完成的,其中的每一步反应称为基元反应。 假设基元反应为aA(g)+bB(g) cC(g)+dD(g),其速率可表示为v=kca(A)·cb(B),式中的k称为反应速率常数或速率常数。反应速率常数k表示单位 浓度下的化学反应速率,在恒温下,不因反应物浓度的改变而变化,但受温 度、催化剂、固体表面性质等因素的影响。通常反应速率常数越大,反
应进行得越快。2.基元反应的速率方程基元反应aA+bB cC+dD的速率方程可写为:v正=k正 ca (A)· cb(B)(k正为正反应的速率常数)v逆=k逆 cc(C)·cd(D)(k逆为逆反应的速率常数)基元反应的化学反应速率与反应物浓度以其化学计量数为指数的幂的 乘积成正比。3.复杂反应的速率方程许多化学反应不是基元反应,而是由两个或多个基元步骤完成的复杂反 应。假设反应A2+B A2B是分两个基元步骤完成的:第一步 A2 2A· 慢反应
第二步 2A·+B A2B 快反应对于总反应来说,决定反应速率的是第一个基元步骤,即这种前一步的产 物作为后一步的反应物的连串反应,决定速率的步骤是最慢的一个基元 步骤。故速率方程是v=kc(A2),而不是v=kc(A2)·c(B)。4.反应级数某化学反应aA+bB cC+dD,若其速率方程的形式为:v正=k正 ca(A)·cb(B);则该反应的反应级数为a+b,即速率方程中幂指数之和;或该反应为a+b级 反应。5.速率常数与化学平衡常数的关系一定温度下,对于基元反应aA(g)+bB(g) gG(g)+hH(g),达到平衡状态时,v正=k正·ca(A)·cb(B),v逆=k逆·cg(G)·ch(H),因平衡时v正=v逆,则k正·ca(A)·cb(B)=k逆·
cg(G)·ch(H), = =K。
例1 (2020滨州二模,14)乙酸甲酯的催化醇解反应可用于制备甲醇和乙 酸己酯,该反应的化学方程式为CH3COOCH3(l)+C6H13OH(l) CH3COOC6H13(l)+CH3OH(l)。 已知v正=k正×x(CH3COOCH3)×x(C6H13OH),v逆=k逆×x(CH3COOC6H13)×x (CH3OH),其中k正、k逆为速率常数(受温度影响),x为各组分的物质的量分 数。反应开始时,CH3COOCH3和C6H13OH按物质的量之比1∶1投料,测得3 38 K、343 K、348 K三个温度下CH3COOCH3转化率(α)随时间(t)的变化 关系如图所示。下列说法正确的是 ( )
A.该反应的ΔH>0B.348 K时,该反应的平衡常数为1.8C.A、B、C、D四点中,v正最大的是D
D.在曲线①、②、③中,k正与k逆的差值最大的曲线是①
解析 温度升高,反应速率加快,先达到平衡,根据图示可知①对应的温度 是348 K,温度升高,CH3COOCH3转化率增大,说明平衡正向移动,因此正反 应为吸热反应,该反应的ΔH>0,A正确;反应开始时,CH3COOCH3和C6H13 OH按物质的量之比1∶1投料,348 K时CH3COOCH3的转化率为64%,假设 反应物的物质的量都是1 ml ,反应前后物质的总物质的量不变,则平衡 时,n(CH3COOC6H13)=n(CH3OH)=0.64 ml ,n(CH3COOCH3)=n(C6H13OH)=0.36 ml ,n(总)=2 ml ,则该反应的平衡常数K= ≈3.2,B错误;温度越高,反应速率越快,v正=k正×x(CH3COOCH3)×x(C6H13OH),曲
线①的温度最高,A点的x(CH3COOCH3)×x(C6H13OH)大,且温度高,因此A点 v正最大,C错误;k正、k逆为速率常数,受温度影响,该反应为吸热反应,k正受温 度影响更大,因此温度升高,k正增大的程度大于k逆,因此k正与k逆的差值最大 的曲线是①,D正确。
例2 某温度时,两个恒容密闭容器中仅发生反应:2NO2(g) 2NO(g)+O2(g) ΔH>0。实验测得:v正(NO2)=k正c2(NO2),v逆(NO)=k逆c2(NO)·c(O2),k正、k 逆为化学反应速率常数,只受温度影响。
下列说法不正确的是 ( ) A.Ⅰ中NO2的平衡转化率约为66.7%B.Ⅱ中达到平衡状态时,c(O2)<0.2 ml·L-1C.该反应的化学平衡常数可表示为K= D.升高温度,该反应的化学平衡常数减小
山东专用高考化学一轮复习专题十二化学反应速率和化学平衡_应用篇课件: 这是一份山东专用高考化学一轮复习专题十二化学反应速率和化学平衡_应用篇课件,共42页。
2022版高考化学选考山东专用一轮总复习课件:专题四氧化还原反应 —应用篇: 这是一份2022版高考化学选考山东专用一轮总复习课件:专题四氧化还原反应 —应用篇,共11页。PPT课件主要包含了实践探究,答案D,答案C等内容,欢迎下载使用。
2022版高考化学选考山东专用一轮总复习课件:专题十九物质的检验、分离与提纯 —应用篇: 这是一份2022版高考化学选考山东专用一轮总复习课件:专题十九物质的检验、分离与提纯 —应用篇,共6页。












