






初中人教版 (五四制)课题4 化学式与化合价课文内容课件ppt
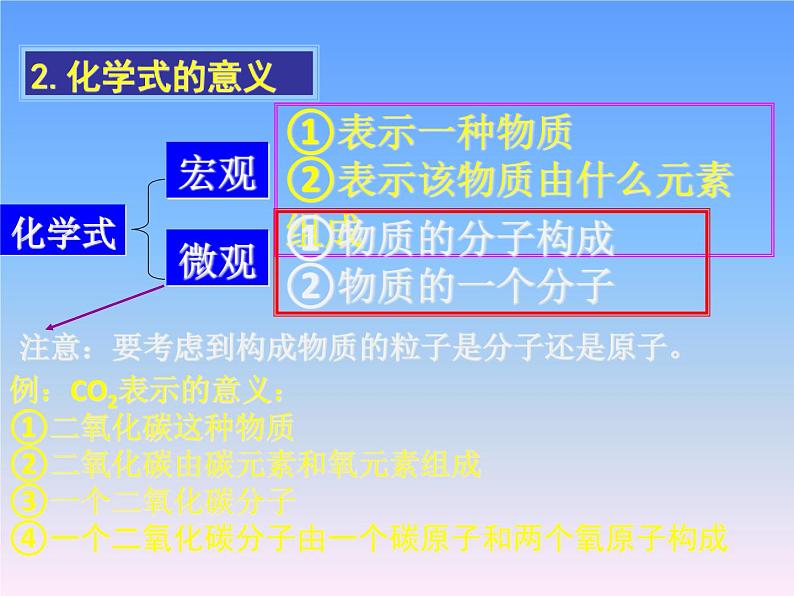
展开①表示一种物质 ②表示该物质由什么元素组成
①物质的分子构成②物质的一个分子
注意:要考虑到构成物质的粒子是分子还是原子。
①二氧化碳这种物质②二氧化碳由碳元素和氧元素组成③一个二氧化碳分子④一个二氧化碳分子由一个碳原子和两个氧原子构成
例:CO2表示的意义:
①表示氢元素;②一个氢原子。表示两个氢原子。①表示氢气这种物质②氢气由氢元素组成③一个氢气分子④一个氢气分子由两个氢原子构成。表示两个氢气分子。
说出下列符号所表示的含义:
化学符号中各数字和含义
1.元素符号前的数字--------原子个数2.化学式前的数字------------分子个数3.化学式中元素符号右下角的数字-----原子个数元素符号(原子团)右上角的数字----- 所带电荷数
3.化学式的书写和读法
(1)金属和某些固态非金属单质(直接用元素符号表示) 如:Fe、Cu、Al,C、S、P等
(3)双原子或多原子分子构成的单质如:O2、N2、H2、Cl2、O3等
(2)稀有气体由原子构成,用元素符号表示如:He、Ne、Ar等
3,化学式的书写和读法
(1)氧化物中氧元素写后面 如:CO2、Fe3O4、P2O5、 MnO2等 读作:“几氧化几某”或“氧化某”
(2)金属元素写前面,非金属元素写后面“金左非右”如:NaCl、CaCl2等; 读法:从右往左读作“某化某”
(3)正价写前面,负价写后面 如:H2O、SO2、KCl等
强记下列物质名称和化学式
氧气___、氮气____、氢气____、
氦气___、氖气____、氩气____、
碳___、硫磺____、红磷____、
铁___、汞____、铝___、镁___、钠__
水___、二氧化碳____、五氧化二磷__、
四氧化三铁__、氧化镁___、氧化铝___
氧化铜___、氧化汞____、二氧化锰___
氯酸钾___、氯化钾____、高锰酸钾____、锰酸钾____、双氧水___
1:2 2:1 1:1
结论:化合物中各元素的原子间有一定的比值
注意:元素只有在形成化合物时,才讲化合价, 即单质的化合价为零。
化合价概念:化学上用“化合价”来表示原子之间相互化合的数目。
化合物都有固定的组成,元素的原子之间有固定的个数比,如:
化合物中元素化合价的代数和为零
①在任何化合物里,正负化合价的代数和为零。②在化合物里氢通常显+1价,氧通常显-2价。③金属元素通常显正价,非金属元素通常显负价。④单质里元素的化合价为零。⑤许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价,如: FeO,Fe2O3
钾钠氢银正一价,钙镁锌钡正二价; 氟氯溴碘负一价,通常氧是负二价; 铜汞正一和正二,铁有正二和正三; 碳有正二和正四,硫有负二、正四和正六; 正三铝,正四硅,正五还有氮和磷
一价氯氢钾钠银 二价氧钡钙镁锌三铝四硅五价磷 二三铁二四碳二四六硫锰记心间
常见原子团的化合价
负一硝酸氢氧根,负二硫酸碳酸根, 负三记住磷酸根,正一价的是铵根。
1.化合价的标法和含义
在氧化镁中镁元素的化合价为+2价
说出下列符号中3的含义
3Al Al Al2O3 Al Al2O3
离子符号和化合价的表示方法不同:离子:数字在前,“+”号在后;写在右上角。化合价:数字在后,“+”号在前;写头顶上。
化合价与离子所带电荷有关:数字相同
离子符号和化合价的比较:
化合价的标法与离子符号的区别与联系
例1 试确定氯酸钾(KClO3)中氯元素的化合价
1+ X +(-2)×3=0
答:在氯酸钾里,氯元素的化合价为+5。
2.根据化学式求化合价
KMnO4、K2MnO4、KClO3、H2SO4
推求的依据:化合物中元素的化合价代数和为零。(注意:如果求离子中某元素的化合价,则代数和不为零。如:SO42-、NO3-)
求HnRO2n-2 中R的化合价
例2 已知磷有两种氧化物,其中磷的化合价分别为 +3 和 +5 ,写出这两种磷的氧化物的化学式。
两种元素化合价的最小公倍数: 10
P: 10 /5 = 2 O: 10/2 = 5
验证: +5×2 + (-2)×5=0
书写化学式的步骤1.写出有关元素符号2.标出有关元素的化合 价。3.根据化合物中元素化 合价代数和为零的原 则,用最小公倍数法 求出化学式中各元素 的原子个数。4.验证所写化学式是否 正确。
2.根据化合价写出化学式
3.根据化合价写化学式
方法:最小公倍数法。(看教材)
已知R元素的化合价为+n,则其形成的氧化物的化学式为_____________
根据元素的化合价写出下列物质的化学式 1、氧化铁 2、硫酸铝 3、氧化铜
书写方法 正左负右, 标价交叉, 约简复查。
+3 -2
验证:(+3)×2 +(-2)×3 = 0
+3 - 2
验证:(+3)×2 + (-2)×3 = 0
验证:(+2) +(-2)= 0
原子团:作为一个整体参加反应的原子集团(就好象一个原子一样),原子团也叫做根。
硫酸根:SO4 -2价碳酸根:CO3 -2价氢氧根:OH -1价硝酸根:NO3 -1价铵 根:NH4 +1价
推求下列原子团(根)的化合价:
NaNO3、NH4NO3、NaOH、H2SO4、Na2CO3、H3PO4
推求的依据:化合物中元素的化合价代数和为零。
3.根据化合价判断化学式正误
下列化学式有无错误,有错误的请改正 氧化铝 氧化镁 氧化钠 氯化亚铁 氯化铜 Al O MgO 2 Na 2O FeCl3 CaCl2 硫酸铝 硫酸 硫酸钠 碳酸钠 Al2 SO4 SO4 Na SO4 Na CO3 氢氧化钠 氢氧化铜 氢氧化铁 NaOH Cu OH 2 Fe(OH) 2
说明下列符号中数字“2”的含义
指出下列符号中“2”的意义
1、 2N ,2、H2 ,3、O2 ,4、2O2 , 5、2Na+ , 6、Mg2+ ,
7、Fe2+8、2Fe3+9、2NH4+10、H2O11、SO42-12、Mg13 SO2
1、两个氢原子 8、三个氢氧根离子 2、一个氮分子 9、两个氧离子3、两个氧分子 10、三个水分子4、氖气 11、两个硝酸根离子5、铁的化学式 12、铜元素6、三个亚铁离子 13、硫元素的化合价是-27、一个硫离子 14、两个铵根离子 15、二氧化碳中氧元素的化合价是-2
写出下列物质的化学式:
1、硫粉 8铁 15锰酸钾2、水 9氖气 16二氧化锰3、碳酸钠 10五氧化二磷 17、氧化铝4、氧气 11四氧化三铁 18 氧化铁5、氯化亚铁 12双氧水 19 硫酸钾6、二氧化硫 13氯酸钾 20硝酸镁7、氯化钾 14高锰酸钾 21氢氧化钙
1,写出空气中含量最多物质的化学式____
2,写出地壳中含量最多的元素名称______
3,写出最轻气体的物质名称______
4,写出人体中含量最多的金属元素的符号______
5,最易自燃物质的化学式_____
6,3个铁离子的化学符号______
写出下列反应的文字表达式,并在相应的物质下方写出物质的化学式,是分解反应、化合反应的,注明反应类型.
1、用高锰酸钾制氧气2、用氯酸钾和二氧化锰制氧气3、用双氧水制氧气4、电解水5、氢气在空气中燃烧发生爆炸
6、红磷在空气中燃烧7、硫在空气中燃烧8、铁丝在氧气中燃烧9、镁条在空气中燃烧10、加热铜绿
三、有关相对分子质量的计算
∴H2O的相对分子质量 =(1+0)×2+(8+8)=18
H2O的意义:一个H2O分子是由两个H原子和一个O原子构成的。
真实质量:一个H2O分子的质量=两个H原子+一个O原子的质量
相对质量:一个H2O分子的相对分子质量=两个H原子相对原子质量+一个O原子的相对原子质量
定义:化学式中各原子的相对原子质量的总和,就是相对分子质量。
计算 H2SO4和H3PO4的相对分子质量
【解】(NH4)2SO4的相对分子质量 =(14+1×4)×2+32+16×4=132
【说明】每种纯净物的组成是固定不变的,所以,每种纯净物的相对分子质量也是固定不变的。如:H2:2 O2:32 H2O:18 CO2:44
计算 (NH4)2SO4的相对分子质量
例2:求2O2 、nH2O的总相对分子质量
2.计算物质组成元素的质量比
例1:求Fe2O3中铁元素和氧元素的质量比。
Fe2O3中铁元素和氧元素的质量比Fe:O=(56×2):(16×3)=112:48=7:3
例2:计算锰酸钾(K2MnO4)中各元素的质量比。
【解】 K2MnO4中各元素的质量比K:Mn:O=(39×2):55:(16×4)=78:55:64
题型二:计算物质组成元素的质量比
例:求二氧化碳中碳元素和氧元素的质量比
元素的质量之比=一种元素的相对原子质量X原子个数: 另一种元素的相对原子质量X原子个数
3.计算物质中某元素的质量分数
例:⑴计算二氧化硫中硫元素的质量分数 ⑵计算64t二氧化硫中含硫元素的质量。
⑴ SO2的相对分子质量=32+16×2=64 SO2中硫元素的质量分数=
⑵ 64t二氧化硫中含硫元素的质量 =64t×50%=32t
题型三:计算物质中某元素的质量分数
例:计算化肥硝酸铵(NH4NO3)中氮元素的质量分数。
NH4NO3的相对分子质量=
14+1×4+14+16×3
硝酸铵中氮元素的质量分数为:
计算化肥尿素〔CO(NH2)2〕中氮元素的质量分数。
=12+16+(14+2) ×2
尿素中氮元素的质量分数为
相对原子质量 ×分子内该原子个数
例:血红蛋白的相对分子质量为68000,已知其中铁元素的质量分数为0.33%,则每个血红蛋白分子中含铁原子的个数为 。
=元素质量:化合物的质量
例:100g 碳酸钙中含钙多少克?
∴100g×40%=40g
化合物质量X化合物中某元素的质量分数=该元素的质量
2、 (2002·江西省)下列物质中铁元素的质量分数最高的是( )A FeO B Fe2O3C Fe3O4 D Fe2(SO4)3
题型四:利用化合物中元素的质量分数或各元素的质量比求化学式
例:笑气是由氮、氧两种元素组成的化合物,其相对分子质量为44,氮、氧元素的质量比为7︰4,则它的化学式为 。
(14×2+16) ×n=44
题型五:有关混合物中元素质量分数的计算
例:某市场销售的化肥硝铵,经检测知道其含氮量为34.3%,则该化肥含硝酸铵的质量分数为______。(设其它成分不含氮元素)
想一想;含铁元素为70 0/0的氧化铁粉末是纯净物还是混合物?
方法一:设硝酸铵样品的质量为m,硝酸铵样品中硝酸铵的质量分数为x。 根据题意得出等式:样品中纯硝酸铵的质量=mx
样品中N元素的质量=mx. X100%
样品中N元素的质量分数: mx. X100%=34.3%
方法二:NH4NO3——2N
混合物中硝酸铵的质量分数
纯硝酸铵中氮元素的质量分数
【例6】已知某Fe2O3样品中铁元素的质量分数为63%(杂质不含铁元素),求此氧化铁样品中的质量分数。
方法一:设样品的质量为m,氧化铁的质量分数为x。 根据题意得出等式:样品中纯氧化铁的质量=mx
样品中铁元素的质量= mx. X100%
样品中铁元素的质量分数: mx. X100%=63%
有一不纯的硫酸铵样品(所含杂质不含氮),经分析知道它含有20%的氮,求样品里含(NH4)2SO4的质量分数。
【剖析】 此类题的解题思路一般为:先设出此化合物的化学式,然后利用物质中两元素的质量比和相对原子质量之比的计算关系式,求出原子个数比,写出化学式。(注意:由于A、B的位置不固定,可有两种形式)
【例1】已知由A、B两元素组成的化合物中,A、B两元素的质量比为7﹕3,A、B两元素的相对原子质量之比为7﹕2,求该化合物的化学式。
解:设此化合物的化学式为AxBy,A的相对原子质量为A,B的相对原子质量为B。 由题意可知: 可求得:x﹕y=2﹕3 ∴该化合物化学式为A2B3或B2A3。
类型2、根据相对分子质量和各元素的质量分数,求化学式。 【例2】已知某有机物的相对分子质量为46,其中C、H、O的质量分数分别为52.2%、13.0%、34.8%,求此有机物的化学式。
【剖析】此类习题首先观察C、H、O三者的含量加在一起为100%,确定物质中只含有C、H、O三种元素,再根据分子质量和各元素的含量,求出化学式中各元素的原子个数,写出化学式。
解:C原子个数=46X52.2%/12=2 H原子个数=46X13.0%/1=6 O原子个数=46X34.8%/16=1 ∴此有机物的化学式为C2H6O 。
【例2】已知某有机物的相对分子质量为46,其中C、H、O的质量分数分别为52.2%、13.0%、34.8%,求此有机物的化学式。
【例3】已知FeSO4和Fe2(SO4)3两种物质的混合物中,硫元素 的质量分数为a%,求混合物中铁元素的质量分数。
【剖析】解决此类习题要求学生有敏锐的观察力,因为直接求难以求出。仔细观察两种物质的化学式,不难看出两种物质化学式中硫原子和氧原子的个数比都为1﹕4,所以混合物中两种元素的质量比为 32﹕16×4=1﹕2 ,即氧元素的质量为硫元素的2倍,由硫元素的质量分数,可求出氧元素的质量分数,剩余的则是铁元素的质量分数。
解:由两种物质的化学式可知:物质中氧元素的质量是硫元素的2倍,所以氧元素的质量分数为2a% 。 则铁元素的质量分数为1-a%-2a%=1-3a% 。
【例3】已知FeSO4和Fe2(SO4)3两种物质的混合物中,硫元素的质量分数为a%,求混合物中铁元素的质量分数。
【注意:此类题还有可能再延伸。例如:(NH4)2S、(NH4)2SO4、(NH4)2HPO4三种物质的混合物中,已知氮元素的质量分数为28%,求混合物中氧元素的质量分数。此题根据H、P、S三元素的相对原子质量关系: 1+31=32,可把(NH4)2HPO4看成(NH4)2SO4,再根据上题方法来求,最终答案为32%。】
例1:原计划用90kg尿素[CO(NH2)2],现因缺货改用硝酸铵(NH4NO3).计算需要用多少千克的硝酸铵才能与90kg尿素的含氮量相等?
解法1:90kg尿素[CO(NH2)2]含氮元素的质量:90kgX28/80X100%=31.5kg多少千克的NH4NO3中含31.5kg的氮元素:31.5kg/28/79X100%=120kg
解法2:设需要硝酸铵质量为x. 据关系式NH4NO3 ~ CO(NH2)2 80 60 x 90kg 80:60=x:90kg x=120kg 答:需用NH4NO3120kg.
例4:某硝酸铵样品中混有另一种氮肥,经测定该样品中含氮38%,则该样品中可能混有的氮肥是( )A.NH4HCO3 B.(NH4)2SO4 C.NH4Cl D.CO(NH2)2
解析:先求出纯净的硝酸铵的含氮量为35%,已知样品中含氮量为38%,所以样品中一定混有含氮量比38%更高的氮肥.计算已知各种氮肥的含氮量分别为:NH4HCO3 17.7% (NH4)2SO4 21.2% NH4Cl 26.2% CO(NH2)2 46.7% 所以答案为D.
初中化学人教版 (五四制)八年级全册课题4 化学式与化合价教学演示课件ppt: 这是一份初中化学人教版 (五四制)八年级全册课题4 化学式与化合价教学演示课件ppt,共29页。PPT课件主要包含了NO3-,S2-,化学式,二氧化碳,H2O,NaCl,学以致用,拓展新知等内容,欢迎下载使用。
化学八年级全册第四单元 自然界的水课题4 化学式与化合价课文ppt课件: 这是一份化学八年级全册第四单元 自然界的水课题4 化学式与化合价课文ppt课件,共30页。PPT课件主要包含了CaCO3,你来试试,巩固练习,归纳小结,说一说等内容,欢迎下载使用。
人教版 (五四制)八年级全册第四单元 自然界的水课题4 化学式与化合价教学课件ppt: 这是一份人教版 (五四制)八年级全册第四单元 自然界的水课题4 化学式与化合价教学课件ppt,共26页。PPT课件主要包含了H2O,467%,快乐学习天天进步等内容,欢迎下载使用。













