




人教版 (五四制)九年级全册课题1 常见的酸和碱课堂教学ppt课件
展开1.通过实验探究,了解酸碱指示剂的概念;2.掌握常见的酸碱指示剂及其在溶液中的变色情况;3.自制酸碱指示剂检验溶液的酸碱性;4.了解常见的酸和碱的性质和用途。
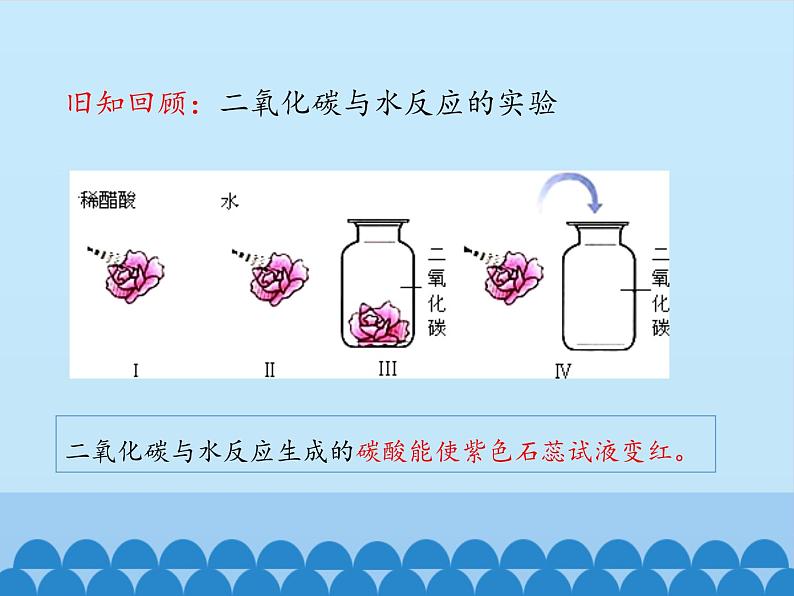
旧知回顾:二氧化碳与水反应的实验
二氧化碳与水反应生成的碳酸能使紫色石蕊试液变红。
英国科学家波义耳偶然发现盐酸能使紫罗兰花由紫变红。
由此,他提出这样的问题:1.其它酸性物质也能使紫罗兰花变红吗?2.碱性物质能使它变色吗?
一、酸、碱与指示剂作用
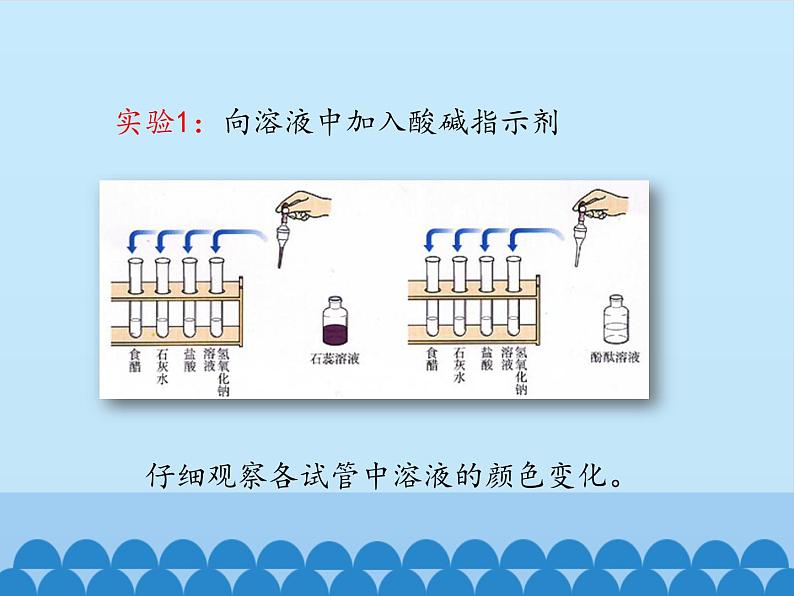
常用酸碱指示剂有紫色石蕊试液和无色酚酞试液。
实验1:向溶液中加入酸碱指示剂
仔细观察各试管中溶液的颜色变化。
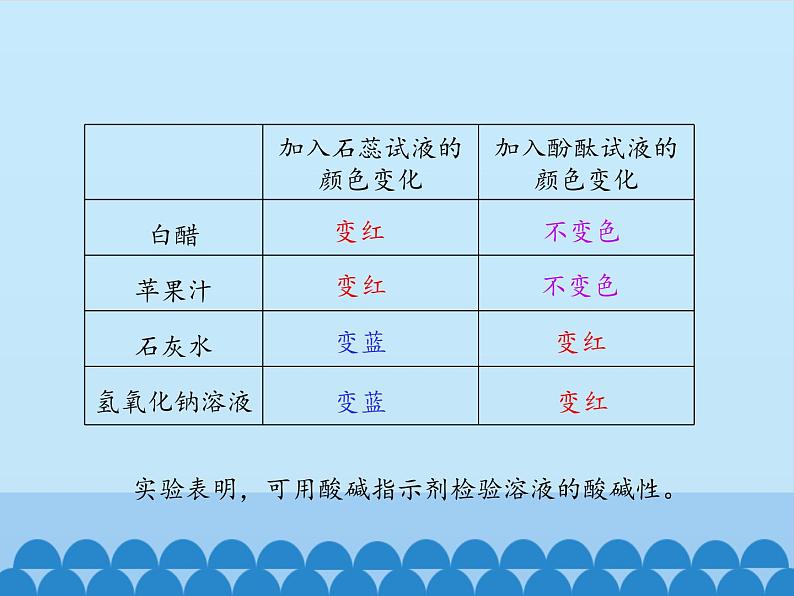
实验表明,可用酸碱指示剂检验溶液的酸碱性。
像石蕊试液一样,遇到酸或碱时能发生特定的颜色变化的一类物质,叫做酸碱指示剂。
注:紫色石蕊试液和无色酚酞试液遇中性溶液都不变色。
下列物质的溶液,能使紫色石蕊试液变红色的是( )A.氯化钠溶液B.氢氧化钠溶液C.稀硫酸D.酒精溶液
比较所得指示剂中,哪些在酸、碱溶液中的颜色变化明显?
盐酸、硫酸、硝酸、醋酸都是常见的重要的酸。
交流讨论:生活中含有酸的物质有哪些?分别含有哪种酸?
实验2:认识浓盐酸和浓硫酸
1.重要的化工产品:制药、金属除锈等;2.胃液里含有的盐酸,可帮助消化。
1.重要化工原料:生产化肥、农药、火药、染料以及冶金、石油化工等领域;2.浓硫酸有吸水性,可用作干燥剂。
如图所示已平衡的天平两端放着两个分别盛有浓盐酸和浓硫酸的敞口烧杯,过一段时间后,天平会( )A.左端下沉B.右端下沉C.仍平衡D.无法判断
浓盐酸和浓硫酸都具有强烈的腐蚀性。
浓硫酸使纸张、木条等脱水炭化。
脱水作用:浓硫酸将物质中的氢、氧元素按水的组成比脱去的作用。
注意:若不慎将浓硫酸溅到皮肤或衣物上,应立即用大量水冲洗,然后涂上3%~5%的碳酸氢钠溶液,以防灼伤皮肤。
浓硫酸是危险品,保管和使用都要格外小心。
把浓硫酸缓缓注入盛有水的烧杯中,沿着烧杯壁缓缓倾倒并用玻璃棒不断搅拌。
切记:不可将水倒进浓硫酸里。
Mg + 2HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Mg+H2SO4 = MgSO4+H2↑
Zn+H2SO4 = ZnSO4+ H2↑
Fe+H2SO4 = FeSO4+H2↑
金属 + 酸 → 盐 + 氢气
3.酸与金属氧化物的反应
Fe2O3+3H2SO4 =Fe2(SO4)3 +3H2O
Fe2O3+6HCl == 2FeCl3 +3H2O
金属氧化物 + 酸 → 盐+ 水
1.酸能使紫色石蕊试液变红;2.酸与较活泼的金属反应生成盐和氢气;3.酸与金属氧化物反应生成盐和水。
酸溶液中都含有大量的氢离子(H+)
氢氧化钙、氢氧化钠、氢氧化钾、氨水都是常见的碱。
(1)俗称:苛性钠、火碱、烧碱;(2)化学式:NaOH;(3)颜色状态:白色块状固体;(4)用途:是重要的化工原料,广泛用于制肥皂、洗涤剂、造纸、纺织、石油和印染等工业。
(1)俗称:熟石灰、消石灰;(2)化学式:Ca(OH)2;(3)颜色状态:白色粉末状固体;(4)用途:生产农药、建筑材料、漂白剂、处理污水、改良酸性土壤等。
实验3:认识氢氧化钠和氢氧化钙
极易溶于水,放出大量的热。
注意:1.固体氢氧化钠在空气中不但易吸收水蒸气而潮解,还能吸收二氧化碳气体而变质。因此,氢氧化钠固体必须密封保存。2.氢氧化钙的制取:CaO + H2O == Ca(OH)23.CaO俗称生石灰,具有吸水性,生石灰固体常用作干燥剂。
查阅资料,了解古诗《石灰吟》中涉及的化学反应。
下列有关氢氧化钠性质的说法错误的是( )A.氢氧化钠有腐蚀性B.固体氢氧化钠有挥发性C.氢氧化钠能吸收二氧化碳而变质D.固体氢氧化钠能吸收水蒸气而潮解
氢氧化钙、氢氧化钠的俗称及用途
熟石灰或消石灰。
烧碱、火碱或苛性钠。
生产农药、建筑材料、漂白剂、处理污水、改良酸性土壤。
制肥皂、洗涤剂、造纸、纺织工业、炼制石油。
查阅资料了解波尔多液及其配制方法。
总结:氢氧化钠和氢氧化钙都可使紫色石蕊试液变蓝,使无色酚酞试液变红。
1.碱与酸碱指示剂的作用
2.碱与非金属氧化物的反应
2NaOH + CO2 == Na2CO3 + H2O
Ca(OH)2+CO2 == CaCO3↓ + H2O
碱 + 非金属氧化物 → 盐 + 水
氢氧化钠、氢氧化钙、氢氧化钾在水溶液中都能产生氢氧根离子(OH-),这使碱溶液具有相似的化学性质。
溶液导电的原因:溶液中存在能够自由移动的离子。
概念;紫色石蕊试液遇酸变红,遇碱变蓝;无色酚酞试液遇酸不变,遇碱变红;
盐酸和硫酸的物理性质和用途;浓硫酸的稀释;
氢氧化钠的性质和用途;氢氧化钙的性质、用途和制取。
化学人教版 (五四制)课题2 酸和碱的中和反应评课ppt课件: 这是一份化学人教版 (五四制)课题2 酸和碱的中和反应评课ppt课件,共17页。PPT课件主要包含了提出问题,作出假设,会反应,实验验证,观察现象,得出结论,①无明显现象,微观世界,HCl+NaOH,金属离子等内容,欢迎下载使用。
2021学年课题2 酸和碱的中和反应课堂教学ppt课件: 这是一份2021学年课题2 酸和碱的中和反应课堂教学ppt课件,共24页。PPT课件主要包含了学习目标,中和反应,熟石灰改良酸性土壤,熟石灰处理酸性废水,氢氧化铝中和胃酸,不变色,用pH试纸,中性溶液pH=7,酸性溶液pH<7,碱性溶液pH>7等内容,欢迎下载使用。
初中化学人教版 (五四制)九年级全册课题2 酸和碱的中和反应背景图ppt课件: 这是一份初中化学人教版 (五四制)九年级全册课题2 酸和碱的中和反应背景图ppt课件,共22页。PPT课件主要包含了想一想,金属离子,酸根离子,链接中考1,链接中考2,处理工厂的酸性废水,污水处理,链接中考3等内容,欢迎下载使用。













