2021学年4 酸碱中和反应教案
展开一、教学目标
(一)知识和技能:
1.认识中和反应的实质,学会利用中和反应来改变溶液的酸碱性。
2.初步学会借助酸碱指示剂判断物质是否发生化学反应。
(二)过程和方法:
通过对酸和碱反应的探究,提高发现和提出问题的能力。培养学生通过实验、观察、分析的方法获取信息的能力。培养学生概括、归纳的能力。[来源:Z
(三)情感态度和价值观:
让学生体验到实验探究过程中的乐趣。
增强学生的学习兴趣。
二、重点、难点
中和反应的实质,物质是否发生化学反应的判断。
三.教学过程
教学
过程
教师活动
学生活动
创设意图
激
情
导
入
操作: 课件展示。
蚊虫叮咬时,在蚊子的口器中分泌出一种有机酸--蚁酸,在家庭中可用浓肥皂水涂抹可迅速止痒。为什么呢?
揭题:为了弄清这个问题,这节课我们一起来学习第二单元第四节——酸碱中和反应。
酸和碱之间是否会发生化学反应?如果发生化学反应,又会有什么特点?我们通过实验来探究。
①运用多媒体创设情境,让学生感受生活中处处有化学。
②为课题的引入作铺垫。
1、
设
计
探
究
方
案
1、引:“从老师提供的药品中选择适当的物质,设计探究实验方案”
提供药品是:NaOH溶液、稀盐酸、酚酞试液、石蕊试液等。
注意思路提示:中和反应很多是没有明显现象的,我们要把这些现象表现出来,有什么办法,需要什么药品入仪器来实现?
2、实验探究:盐酸和氢氧化钠能否发生化学反应
问题:你的猜想是什么?能否设计一个实验来证明你的猜想?
提示活动顺序:猜想→各自设计实验方案→
交流实验方案→选择最佳方案→进行实验→得出结论
1、小组讨论,形成初步设计思路。
2、自主选择两组或两组以上药品,设计探究方案。
3、交流。
、学会问题的解决方法。
2、培养学生交流与合作的能力。
3、培养学生的发散思维能力,解决同一问题可能会有多种方法。
2.实
验
探
究
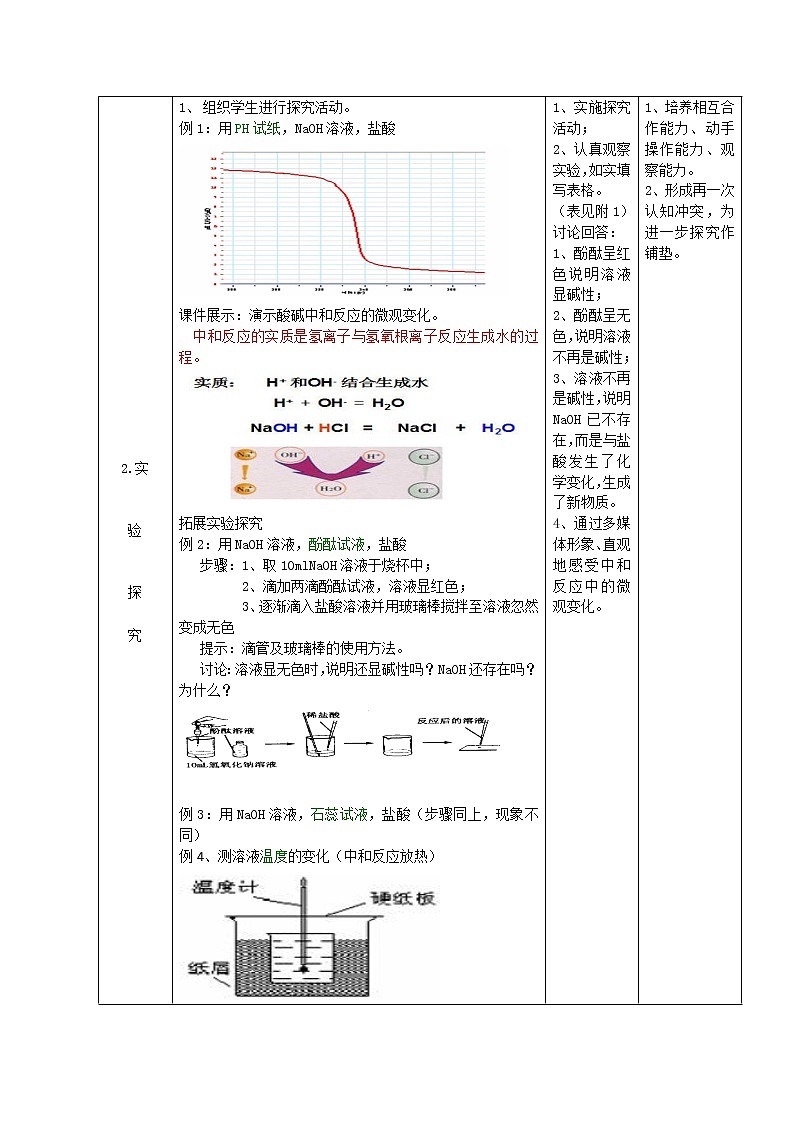
组织学生进行探究活动。
例1:用PH试纸,NaOH溶液,盐酸
课件展示:演示酸碱中和反应的微观变化。
中和反应的实质是氢离子与氢氧根离子反应生成水的过程。
拓展实验探究
例2:用NaOH溶液,酚酞试液,盐酸
步骤:1、取10mlNaOH溶液于烧杯中;
2、滴加两滴酚酞试液,溶液显红色;
3、逐渐滴入盐酸溶液并用玻璃棒搅拌至溶液忽然变成无色
提示:滴管及玻璃棒的使用方法。
讨论:溶液显无色时,说明还显碱性吗?NaOH还存在吗?为什么?
例3:用NaOH溶液,石蕊试液,盐酸(步骤同上,现象不同)
例4、测溶液温度的变化(中和反应放热)
1、实施探究活动;
2、认真观察实验,如实填写表格。
(表见附1)
讨论回答:
1、酚酞呈红色说明溶液显碱性;
2、酚酞呈无色,说明溶液不再是碱性;
3、溶液不再是碱性,说明NaOH已不存在,而是与盐酸发生了化学变化,生成了新物质。
4、通过多媒体形象、直观地感受中和反应中的微观变化。
1、培养相互合作能力、动手操作能力、观察能力。
2、形成再一次认知冲突,为进一步探究作铺垫。
3、
交
流
与
发
现
1:组织小组代表交流各自在探究过程中观察到的现象及对应结论;有明显现象。
教师总结,肯定学生的探究成果并演示有明显现象的组别。
3.思考:氢氧化钠和盐酸的反应有 什么特点?
1、交流各自体验,形成初步认知。
2、感受成功。
培养学生学习交流的能力;激发新一轮思维碰撞;增强学生的成就感、愉悦感.
4.
归
纳
总
结
1:写出下列反应的化学方程式,有何共同特点?
边分析边书写化学方程式。
= 1 \* GB3 ①胃酸(HCl)过多,口服碱性药物(例:Mg(OH)2)
胃酸(HCl)过多,口服碱性药物(例:Al(OH)3
= 2 \* GB3 ②向酸性土壤(H2SO4)中撒熟石灰(Ca(OH)2)
= 3 \* GB3 ③向酸性废水(HCl)中加熟石灰(Ca(OH)2)
2、揭示中和反应:酸和碱能进行反应,生成盐和水。
3、盐:金属离子和酸根离子构成的化合物。
说明:NH4+是原子团,它不是金属离子,但可把它看作金属离子。
讨论:判断一个反应是不是中和反应的关键是什么?
1.反应物必须是酸与碱,
2.生成物必须是盐和水
1、书写化学方程式。进而了解中和反应在生活中的应用。
2、理解中和反应;
3、感受生活中处处有化学,生活离不开化学。
1、提高运用基本化学用语的能力。
2、明确基本概念;
3、应用所学知识解决现实生活中的问题。
5.
达
标
检
测
1.在滴有石蕊的稀盐酸中,加入足量NaOH溶液,加酸前后溶液颜色依次为 ( )
A.红色、紫色 、蓝色 B.紫色、红色、蓝色
C.红色、蓝色、紫色 D.蓝色、紫色、红色
2.在实验室里,欲使碱性溶液变成中性,下列试剂中最好选用哪一种组合 ( )
① NaOH溶液②稀盐酸 ③石灰水 ④酚酞试液
A. ①或③ B. 只有② C. 只有① D. ②和④
3、下列各组物质间的反应,由于现象不明显需要借助酸碱指示剂才能判断出反应发生的是( )
A、 镁和稀盐酸 B 、烧碱溶液和稀硫酸
C、氧化铁和稀硫酸 D、澄清石灰水中通入二氧化碳
做练习题。
达成教学目标
反馈学生达成度
6.
拓
展
训
练
. 小松同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,小松同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是他得出“两种物质已恰好完全中和”的结论。
(1)写出该反应的化学方程式: 。
(2)你认为他得出的结论是否正确 ,
理由是 。
(3)为了验证小松同学的结论,你可以选择的试剂是( )
A、紫色石蕊试液 B、稀硫酸 C、铁粉 D、铜片 E、碳酸钠
作业:课后探究——清除茶瓶水垢。
1、介绍茶瓶的水垢。
2、提出要求:利用厨房内物质清除水垢。
在家做实验
课后延伸
初中化学鲁教版 (五四制)九年级全册4 酸碱中和反应教案及反思: 这是一份初中化学鲁教版 (五四制)九年级全册4 酸碱中和反应教案及反思,共2页。教案主要包含了教学目标,教学重难点,教学过程等内容,欢迎下载使用。
2020-2021学年第二单元 常见的酸和碱4 酸碱中和反应教案: 这是一份2020-2021学年第二单元 常见的酸和碱4 酸碱中和反应教案,共5页。
鲁教版 (五四制)九年级全册4 酸碱中和反应教案设计: 这是一份鲁教版 (五四制)九年级全册4 酸碱中和反应教案设计,共3页。教案主要包含了组织教学,学生回答,教师点拨,猜想交流,实验探索,提出问题,实验现象,归纳总结等内容,欢迎下载使用。













