
2022届高考化学二轮专题复习学案练习专题十二 考点二 分子结构与性质
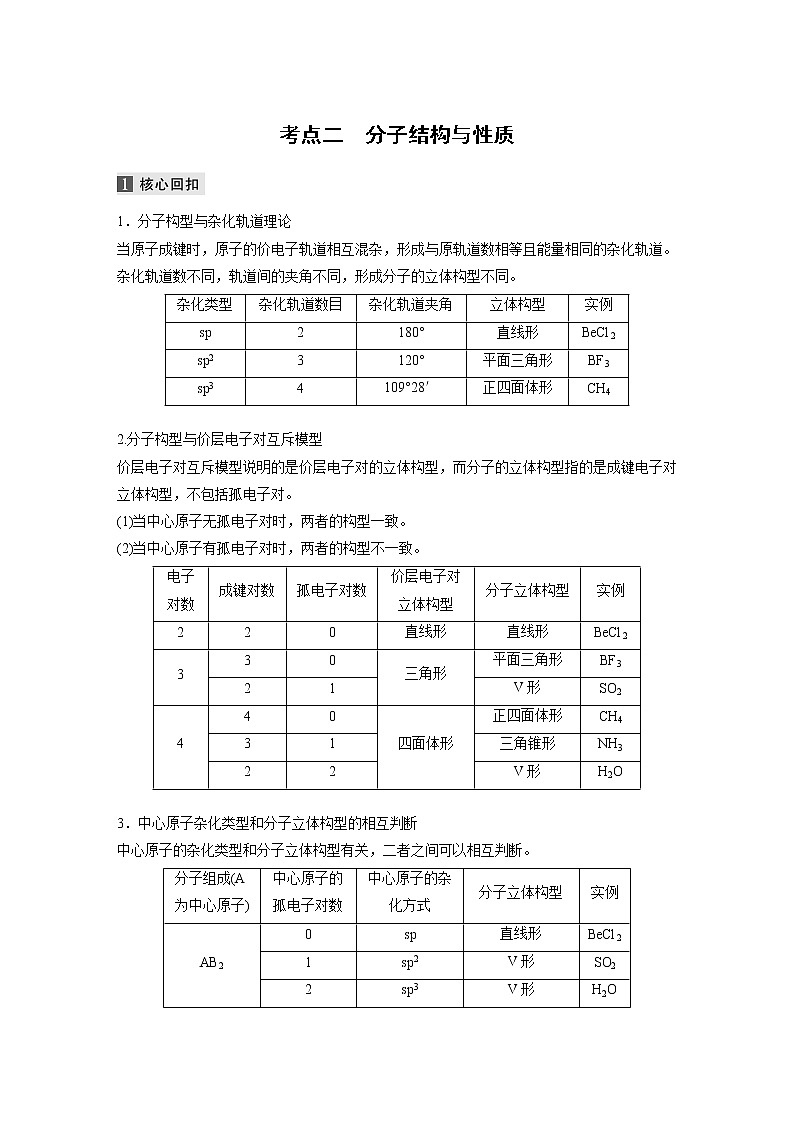
展开1.分子构型与杂化轨道理论
当原子成键时,原子的价电子轨道相互混杂,形成与原轨道数相等且能量相同的杂化轨道。杂化轨道数不同,轨道间的夹角不同,形成分子的立体构型不同。
2.分子构型与价层电子对互斥模型
价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对立体构型,不包括孤电子对。
(1)当中心原子无孤电子对时,两者的构型一致。
(2)当中心原子有孤电子对时,两者的构型不一致。
3.中心原子杂化类型和分子立体构型的相互判断
中心原子的杂化类型和分子立体构型有关,二者之间可以相互判断。
特别提醒 (1)用价层电子对互斥理论判断分子的立体构型时,不仅要考虑中心原子的孤电子对所占据的空间,还要考虑孤电子对对成键电子对的排斥力大小。排斥力大小顺序为LP—LP≫LP—BP>BP—BP(LP代表孤电子对,BP代表成键电子对)。
(2)三键、双键、单键之间的排斥力大小顺序:
三键—三键>三键—双键>双键—双键>双键—单键>单键—单键。
(3)键角大小的判断方法
①不同杂化类型
如键角:CH4
三键—三键之间的排斥力>双键—双键之间的排斥力>单键—单键之间的排斥力,如乙烯分子中H—C==C的键角是121.3°;H—C—H的键角是117.4°,均接近120°。
③杂化类型相同,中心原子孤电子对数越多,键角越小
如键角:CH4>NH3>H2O;NHeq \\al(+,4)>NH3;H3O+>H2O。
④杂化类型和孤电子对数均相同,中心原子的电负性越大,键角越大
键角:NH3>PH3>AsH3。
解释:N、P、As电负性逐渐减小。中心原子的电负性越大,成键电子对越靠近中心原子,成键电子对排斥力增大,键角增大。
⑤杂化类型和孤电子对数相同,配位原子电负性越大,键角越小
键角:NF3
对于第④、⑤种类型,可以归纳为判断中心原子的电子云密度,若中心原子的电子云密度越大,则该分子的成键电子对排斥力越大,则键角越大。
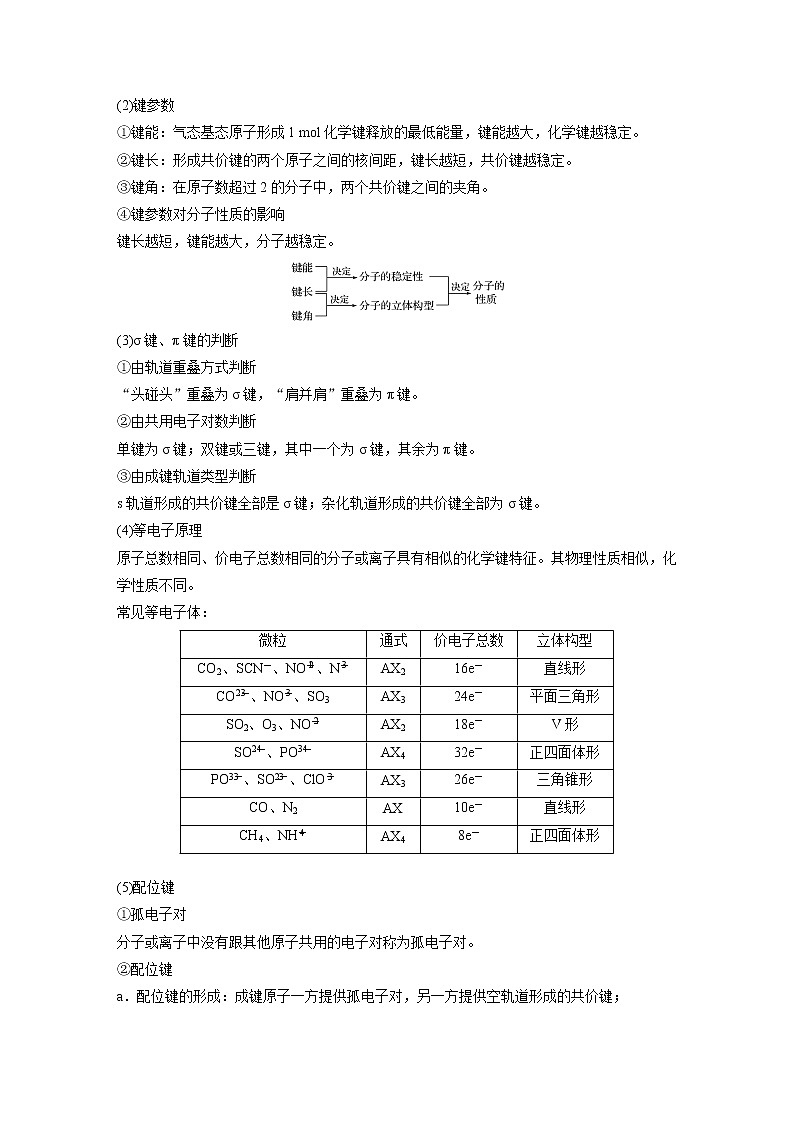
4.共价键
(1)共价键的类型
①按成键原子间共用电子对的数目分为单键、双键和三键。
②按共用电子对是否偏移分为极性键、非极性键。
③按原子轨道的重叠方式分为σ键和π键,前者的电子云具有轴对称性,后者的电子云具有镜像对称性。
(2)键参数
①键能:气态基态原子形成1 ml化学键释放的最低能量,键能越大,化学键越稳定。
②键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳定。
③键角:在原子数超过2的分子中,两个共价键之间的夹角。
④键参数对分子性质的影响
键长越短,键能越大,分子越稳定。
(3)σ键、π键的判断
①由轨道重叠方式判断
“头碰头”重叠为σ键,“肩并肩”重叠为π键。
②由共用电子对数判断
单键为σ键;双键或三键,其中一个为σ键,其余为π键。
③由成键轨道类型判断
s轨道形成的共价键全部是σ键;杂化轨道形成的共价键全部为σ键。
(4)等电子原理
原子总数相同、价电子总数相同的分子或离子具有相似的化学键特征。其物理性质相似,化学性质不同。
常见等电子体:
(5)配位键
①孤电子对
分子或离子中没有跟其他原子共用的电子对称为孤电子对。
②配位键
a.配位键的形成:成键原子一方提供孤电子对,另一方提供空轨道形成的共价键;
b.配位键的表示:常用“―→”来表示配位键,箭头指向接受孤电子对的原子,如NHeq \\al(+,4)可表示为,在NHeq \\al(+,4)中,虽然有一个N—H键形成的过程与其他3个N—H键形成的过程不同,但是一旦形成之后,4个共价键就完全相同。
③配合物
如[Cu(NH3)4]SO4
配位体有孤电子对,如H2O、NH3、CO、F-、Cl-、CN-等。中心原子或离子有空轨道,如Fe、Fe3+、Cu2+、Zn2+、Ag+等。
5.分子性质
(1)分子构型与分子极性的关系
(2)溶解性
①“相似相溶”规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂,若存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
②“相似相溶”还适用于分子结构的相似性,如乙醇和水互溶,而戊醇在水中的溶解度明显减小。
(3)无机含氧酸分子的酸性
无机含氧酸可写成(HO)mROn,如果成酸元素R相同,则n值越大,R的正电性越高,使R—O—H中O的电子向R偏移,在水分子的作用下越易电离出H+,酸性越强,如酸性:HClO
(1)作用粒子:氢、氟、氧、氮原子(分子内、分子间)。
(2)特征:有方向性和饱和性。
(3)强度:共价键>氢键>范德华力。
(4)影响强度的因素:对于A—H…B—,A、B的电负性越大,B原子的半径越小,氢键键能越大。
(5)对物质性质的影响:分子间氢键的存在,使物质的熔、沸点升高,在水中的溶解度增大,如熔、沸点:H2O>H2S,HF>HCl,NH3>PH3。
角度一 微粒作用与分子性质
1.(2020·浙江7月选考,26)(1)气态氢化物热稳定性HF大于HCl的主要原因是
________________________________________________________________________
________________________________________________________________________。
(2)CaCN2是离子化合物,各原子均满足8电子稳定结构,CaCN2的电子式是________。
(3)常温下,在水中的溶解度乙醇大于氯乙烷,原因是________________________
________________________________________________________________________。
答案 (1)原子半径:F<Cl,键能:F—H>Cl—H
(2)
(3)乙醇与水之间形成氢键而氯乙烷不能与水形成氢键
解析 (1)同一主族元素,从上到下,原子半径逐渐增大,即原子半径:F<Cl,原子半径越小,化学键的键长越短,键能越大,气态氢化物的热稳定性越大。(2)CaCN2是离子化合物,各原子均满足8电子稳定结构,故电子式为。(3)乙醇分子中有羟基,能与水形成分子间氢键,易溶于水,而氯乙烷中没有羟基等亲水基,在水中的溶解度小于乙醇。
2.[2020·新高考全国卷Ⅰ(山东),17(2)]NH3、PH3、AsH3的沸点由高到低的顺序为____________(填化学式,下同),还原性由强到弱的顺序为____________,键角由大到小的顺序为____________。
答案 NH3、AsH3、PH3 AsH3、PH3、NH3 NH3、PH3、AsH3
解析 NH3、PH3、AsH3均为分子晶体,NH3分子间形成氢键,因此沸点高于PH3、AsH3;AsH3的相对分子质量大于PH3,因此AsH3的沸点高于PH3,即三者沸点由高到低的顺序为NH3、AsH3、PH3。非金属性:N>P>As,因此氢化物的还原性由强到弱的顺序为AsH3、PH3、NH3。NH3、PH3、AsH3分子中,N、P、As均形成3对共用电子对和一对孤电子对,原子半径:As>P>N,键长:As—H>P—H>N—H,因此σ键电子对之间的排斥力由强到弱的顺序为N>P>As,即键角由大到小的顺序为NH3、PH3、AsH3。
3.[2020·全国卷Ⅱ,35(2)]Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是_______________________________________
________________________________________________________________________。
答案 TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大,分子间作用力增大,熔点逐渐升高
解析 TiF4的熔点明显高于TiCl4,而TiCl4、TiBr4、TiI4的熔点依次升高,由此说明TiF4为离子化合物,而TiCl4、TiBr4、TiI4为共价化合物,共价化合物随相对分子质量的增大,分子间作用力增大,因此熔点逐渐升高。
4.[2018·全国卷Ⅱ,35(3)]图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________________________________________________________
________________________________________________________________________。
答案 S8相对分子质量大,分子间范德华力强
5.[2018·全国卷Ⅲ,35(3)]ZnF2具有较高的熔点(872 ℃),其化学键类型是________;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是
________________________________________________________________________
________________________________________________________________________。
答案 离子键 ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,极性较小
角度二 “两大理论”与微粒构型
6.[2020·新高考全国卷Ⅰ(山东),17(1)(3)](1)常温常压下SnCl4为无色液体,SnCl4立体构型为____________,其固体的晶体类型为____________。
(3)含有多个配位原子的配体与同一中心离子(或原子)通过螯合配位成环而形成的配合物为螯合物。一种Cd2+配合物的结构如图所示,1 ml该配合物中通过螯合作用形成的配位键有________ ml,该螯合物中N的杂化方式有__________种。
答案 (1)正四面体形 分子晶体 (3)6 1
解析 (1)Sn最外层有4个电子,与4个Cl形成4个σ键,因此SnCl4的立体构型为正四面体形;由题给信息知SnCl4常温常压下为液体,说明SnCl4的熔点较低,所以其固体的晶体类型为分子晶体。(3)由题给图示可知,通过螯合作用形成了3个环,每个环中Cd2+均可与2个N原子或2个氧原子形成配位键,即1个Cd2+与4个N原子分别形成4个配位键,与2个O原子分别形成2个配位键,因此1 ml该配合物中通过螯合作用形成的配位键有6 ml;由题给图示可知,该配合物中有2种不同的N原子,每个N原子均形成3个σ键,因此所有N原子的杂化方式均为sp2杂化,即杂化方式只有1种。
7.[2020·全国卷Ⅰ,35(3)]磷酸根离子的立体构型为________,其中P的价层电子对数为________、杂化轨道类型为________。
答案 正四面体形 4 sp3
解析 根据价电子对互斥理论,POeq \\al(3-,4)中P的价层电子对数为4+eq \f(5-2×4+3,2)=4,无孤电子对,故杂化轨道类型为sp3,立体构型为正四面体形。
8.[2020·全国卷Ⅲ,35(2)(3)](2)NH3BH3分子中,N—B化学键称为________键,其电子对由________提供。氨硼烷在催化剂作用下水解释放氢气:
3NH3BH3+6H2O3NHeq \\al(+,4)+B3Oeq \\al(3-,6)+9H2↑
B3Oeq \\al(3-,6)的结构为。在该反应中,B原子的杂化轨道类型由________变为________。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是_____________。与NH3BH3原子总数相等的等电子体是____________(写分子式),其熔点比NH3BH3________(填“高”或“低”),原因是在NH3BH3分子之间,存在________________作用,也称“双氢键”。
答案 (2)配位 N sp3 sp2
(3)N>H>B C2H6 低 Hδ+与Hδ-的静电引力
解析 (2)NH3分子中N原子有1对孤电子对,BH3分子中B原子有空的2p轨道,则NH3BH3分子中N—B化学键是配位键,N原子提供孤电子对,B原子提供空轨道。NH3BH3中B原子形成3个B—H键和1个B—N键,B原子周围有4对成键电子对,则B原子采取sp3杂化;中每个B原子均形成3个B—O键,且B原子最外层不含孤电子对,则B原子采取sp2杂化,故在该反应中,B原子的杂化轨道类型由sp3变为sp2。
(3)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),说明N的电负性强于H,B的电负性弱于H,故电负性:N>H>B。NH3BH3分子含8个原子,其价电子总数为14,与其互为等电子体的是C2H6。NH3BH3分子间存在“双氢键”,类比“氢键”的形成原理,则CH3CH3熔点比NH3BH3低的原因是在NH3BH3分子之间存在Hδ+与Hδ-的静电引力。
9.[2019·全国卷Ⅰ,35(2)节选]乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是________、________。
答案 sp3 sp3
解析 乙二胺分子中,1个N原子形成3个单键,还有一对孤电子对,故N原子价层电子对数为4,N原子采取sp3杂化;1个C原子形成4个单键,没有孤电子对,价层电子对数为4,采取sp3杂化。
10.[2019·全国卷Ⅱ,35(1)节选]元素As与N同族。预测As的氢化物分子的立体结构为________。
答案 三角锥形
解析 AsH3的中心原子As的价层电子对数为eq \f(5+3,2)=4,包括3对成键电子和1对孤电子对,故其立体结构为三角锥形。
11.[2019·全国卷Ⅲ,35(2)(4)(5)](2)FeCl3中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的FeCl3的结构式为_____________________________________________________,其中Fe的配位数为________。
(4)NH4H2PO4中,电负性最高的元素是________;P的________杂化轨道与O的2p轨道形成________键。
(5)NH4H2PO4和LiFePO4属于简单磷酸盐,而直链的多磷酸盐则是一种复杂磷酸盐,如焦磷酸钠、三磷酸钠等。焦磷酸根离子、三磷酸根离子如图所示:
这类磷酸根离子的化学式可用通式表示为________________________________________
(用n代表P原子数)。
答案 (2) 4 (4)O sp3 σ (5)(PnO3n+1)(n+2)-
解析 (2)Fe能够提供空轨道,而Cl能够提供孤电子对,故FeCl3分子双聚时可形成配位键。由常见AlCl3的双聚分子的结构可知FeCl3的双聚分子的结构式为,其中Fe的配位数为4。(4)同周期从左到右,主族元素的电负性逐渐增强,故O的电负性大于N,同主族从上到下,元素的电负性逐渐减小,故电负性N大于P,又因H的电负性小于O,因此NH4H2PO4中电负性最高的元素是O。POeq \\al(3-,4)中中心原子P的价层电子对数为4,故P为sp3杂化,P的sp3杂化轨道与O的2p轨道形成σ键。(5)由三磷酸根离子的结构可知,中间P原子连接的4个O原子中,2个O原子完全属于该P原子,另外2个O原子分别属于2个P原子,故属于该P原子的O原子数为2+2×eq \f(1,2)=3,属于左、右两边的2个P原子的O原子数为3×2+eq \f(1,2)×2=7,故若这类磷酸根离子中含n个P原子,则O原子个数为3n+1,又因O元素的化合价为-2价,P元素的化合价为+5价,故该离子所带电荷为-2×(3n+1)+5n=-n-2,这类磷酸根离子的化学式可用通式表示为(PnO3n+1)(n+2)-。
12.[2018·全国卷Ⅰ,35(3)节选]LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子立体构型是________,中心原子的杂化形式为________。
答案 正四面体 sp3
13.[2018·全国卷Ⅱ,35(2)(4)](2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是__________________。
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为________形,其中共价键的类型有________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
答案 (2)H2S (4)平面三角 2 sp3
解析 (2)根据价层电子对互斥理论可知,H2S、SO2、SO3三种分子中S原子的价层电子对数分别为4、3、3,因此H2S中S原子价层电子对数不同于其他两种分子。
(4)SO3的中心原子为S,中心原子的孤电子对数=(6-2×3)/2=0,价层电子对数为0+3=3,S为sp2杂化,根据sp2杂化轨道构型可知,SO3的立体构型为平面三角形,符合形成大π键的条件,可形成4中心6电子大π键,因此有两种共价键类型。如图(b)所示的三聚分子中每个S原子与4个O原子结合,形成正四面体结构,S原子的杂化轨道类型为sp3。杂化类型
杂化轨道数目
杂化轨道夹角
立体构型
实例
sp
2
180°
直线形
BeCl2
sp2
3
120°
平面三角形
BF3
sp3
4
109°28′
正四面体形
CH4
电子对数
成键对数
孤电子对数
价层电子对立体构型
分子立体构型
实例
2
2
0
直线形
直线形
BeCl2
3
3
0
三角形
平面三角形
BF3
2
1
V形
SO2
4
4
0
四面体形
正四面体形
CH4
3
1
三角锥形
NH3
2
2
V形
H2O
分子组成(A为中心原子)
中心原子的孤电子对数
中心原子的杂化方式
分子立体构型
实例
AB2
0
sp
直线形
BeCl2
1
sp2
V形
SO2
2
sp3
V形
H2O
AB3
0
sp2
平面三角形
BF3
1
sp3
三角锥形
NH3
AB4
0
sp3
正四面体形
CH4
微粒
通式
价电子总数
立体构型
CO2、SCN-、NOeq \\al(+,2)、Neq \\al(-,3)
AX2
16e-
直线形
COeq \\al(2-,3)、NOeq \\al(-,3)、SO3
AX3
24e-
平面三角形
SO2、O3、NOeq \\al(-,2)
AX2
18e-
V形
SOeq \\al(2-,4)、POeq \\al(3-,4)
AX4
32e-
正四面体形
POeq \\al(3-,3)、SOeq \\al(2-,3)、ClOeq \\al(-,3)
AX3
26e-
三角锥形
CO、N2
AX
10e-
直线形
CH4、NHeq \\al(+,4)
AX4
8e-
正四面体形
化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
2022届高考化学二轮专题复习学案练习专题六 考点二 化学能与电能: 这是一份2022届高考化学二轮专题复习学案练习专题六 考点二 化学能与电能,共12页。
2022届高考化学二轮专题复习学案练习专题七 考点二 化学平衡及其影响因素: 这是一份2022届高考化学二轮专题复习学案练习专题七 考点二 化学平衡及其影响因素,共6页。
2022届高考化学二轮专题复习学案练习专题六 考点一 化学能与热能: 这是一份2022届高考化学二轮专题复习学案练习专题六 考点一 化学能与热能,共11页。