






2020-2021学年第二节 金属的化学性质课前预习课件ppt
展开据报道:第十五届亚运会上中国体育代表团共获得一百六十五枚金牌,八十八枚银牌,六十三枚铜牌 ,第七次蝉联奖牌榜第一。
课题二 金属的化学性质 (第1课时)
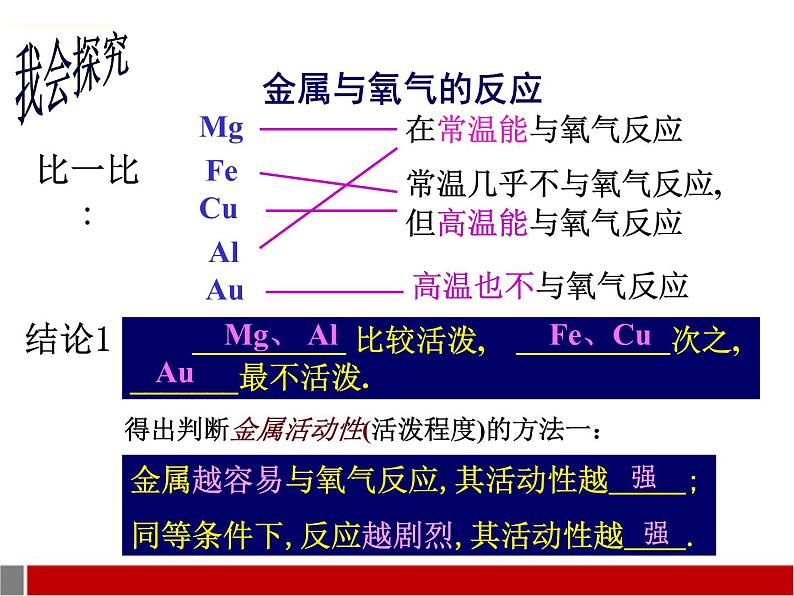
一.金属难过“氧气”关 -----金属与氧气的反应
1. 探究目的: 镁、铝、铁、铜、金分别与氧气反应的情况
2. 探究方法: 实物对比;回忆已学知识;联系生活实际等
常温几乎不与氧气反应,但高温能与氧气反应
比较活泼, 次之, _______最不活泼.
得出判断金属活动性(活泼程度)的方法一:
金属越容易与氧气反应,其活动性越;同等条件下,反应越剧烈,其活动性越.
铝在常温下与氧气反应,为什么铝会具有很好的抗腐蚀性呢?
铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步被氧化。
资料: 16世纪中叶,瑞士化学家帕拉塞斯和17世纪的一些化学家,都发现了有些金属和酸可以反应产生很多气泡,生成一种可燃性气体.
(实验证明,这种可燃性气体是氢气)
二 . 金属“泡泡堂” ------金属与稀盐酸.稀硫酸的反应
1 . 探究目的: 镁. 锌. 铁. 铜分别与稀盐酸.稀硫酸反应的情况.
2 . 探究方法: 用4支试管分别放入两小块镁、锌、铁、铜。 分别向4支试管加入约5ml稀盐酸 ; 分别向4支试管加入约5ml稀硫酸; 观察发生的现象 , 比较反应的剧烈程度。
课题二 金属的化学性质
1.哪些金属能与稀盐酸.稀硫酸发生反应?哪些不能反应?
2.能与稀盐酸.稀硫酸反应的金属中,哪种金属反应最剧烈?哪种最缓慢?
3.铁.镁.铜.锌四种金属的活动性由强到弱的顺序是.
反应剧烈,放出大量的无色气泡
反应较剧烈,放出大量的无色气泡
反应较慢,有无色气泡放出
Mg+2HCl=MgCl2+H2↑
Zn+2HCl =ZnCl2 +H2↑
Fe +2HCl =FeCl2 + H2↑
Mg+H2SO4=MgSO4+H2↑
Zn +H2SO4 =ZnSO4 +H2↑
Fe +H2SO4 =FeSO4 +H2↑
得出判断金属活动性的方法二:
一般情况下,能与稀盐酸或稀硫酸反应的金属,其活动性较 ,不反应的较 ; 反应越剧烈的越 ,越缓慢的越 .
讨论交流:除反应剧烈程度外,你还观察到有哪些现象?
小结: 这种由一种单质与一种化合物反应,生成了另一种单质和另一种化合物的反应叫做置换反应。
Fe + H2SO4 = FeSO4 + H2↑ Fe + 2HCl = FeCl2 + H2 ↑ Zn + H2SO4 = ZnSO4 + H2 ↑ Mg + 2HCl = MgCl2 + H2 ↑
讨论:对于以上的反应,从反应物和生成物物质分类的角度分析,这些反应有何共同特点?
1、黄铜(铜、锌合金)单纯从颜色、外观上看,与黄金极为相似,所以社会上有些不法分子时常以黄铜冒充黄金进行诈骗活动.现请你设计实验方案用化学方法鉴别真假黄金。 2、请根据锌粒与稀硫酸反应产生氢气的反应原理,设计出制备氢气的反应装置,要求该装置能方便地控制反应的进行或停止,画出装置图,并说明操作注意事项。(参考上册习题5.2题8)
趣味化学小组的张同学,从实验室借来一台天平,在天平两端秤盘里各放两只大小和重量都相等的烧杯,再在两只烧杯中分别倒入等质量的硫酸铜溶液和硫酸铝溶液,使天平保持平衡。接着他又拿两个质量相等的铁球,并同时将这两个铁球分别放入两个烧杯之中,这时天平两端继续保持平衡。过一会儿,将铁球取出,天平慢慢地倾斜了。是天平出了毛病,还是其他什么原因? 问题:为什么把铁球放入两烧杯中天平不能平衡?导致天平不平衡的原因你能否猜一猜?
三 . 强不强,捉谜藏 ----金属与某些金属化合物溶液反应
1. 如何验证铁和铜之间的活动性?
2. 如何验证铜和银之间的活动性?
① 铁丝浸入硫酸铜溶液中
② 铁丝与硫酸铝溶液反应 …
①铜丝浸入硝酸银溶液中
根据刚才的实验填写表格
说明:铁能把铜从硫酸铜溶液中反应出来,这也是比较金属活动性的依据之一,另外上述反应是古代湿法炼铜的原理(曾青得铁则化为铜)
现象:_________________________________________________________________________________________________________
将铁钉投入到硫酸铜溶液中有何现象?
铁钉表面会有红色物质析出,若时间足够 长,则溶液会从蓝色变为浅绿色。
Fe + CuSO4 = Cu + FeSO4
铁、铜、银三种金属活动性由强到弱的顺序是 .
Fe . Cu .Ag
得到判断金属活动性的方法三:
如果金属A能把金属B从它化合物的溶液中置换出来,则证明金属A比金属B的活动性。
1、在金属活动性顺序里,金属的位置越靠前,它的活动性就越强。2、在金属活动性顺序里,位于氢前面的金属能置换出稀盐酸.稀硫酸中的氢。3、在金属活动顺序里,位于前面的金属 能把位于后面的金属从它们化合物的溶液中置换出来。
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1.大多数金属能与氧气反应,生成氧化物。
2.大多数金属能与稀HCl或稀H2SO4反应
3.部分金属能与金属化合物的溶液反应
反应越容易,越剧烈,金属越活泼
金属能否与金属化合物的溶液反应
为什么不能用铁制容器来盛装硫酸铜溶液?
1.判断下列物质能否发生反应?若能,写出相关化学方程式。 (1)银与稀盐酸 (2)锌与硫酸铜溶液 (3)铜与硫酸锌溶液 (4)铝与硝酸银溶液 (5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
(2)Zn + CuSO4 = Cu + ZnSO4
(4)Al +3AgNO3 = Al(NO3)3 + 3Ag
(6)Mg + FeSO4 = MgSO4 +Fe
2、写出镁、铜、氧气、盐酸两两之间能发生反应的化学方程 式,并注明反应类型。3、下列物质能否发生反应?写出能发生反应的化学方程式。(1)银与稀盐酸(2)锌与硫酸铜溶液(3)铜与硫酸锌溶液(4)铝与硝酸银溶液
有X Y Z三种金属,如果把X和Y分别放入稀硫酸中, X 溶解并产生氢气,Y不反应;如果把Y和Z分别放入硝酸银溶液中,过一会儿,在Y的表面有银析出,而Z无变化.根据以上事实,判断X Y Z的金属活动顺序.
答: 金属活动性顺序 X>Y>Z
初中化学人教版九年级下册课题 2 金属的化学性质课文配套ppt课件: 这是一份初中化学人教版九年级下册课题 2 金属的化学性质课文配套ppt课件,共1页。
初中化学人教版九年级下册课题 2 金属的化学性质完美版ppt课件: 这是一份初中化学人教版九年级下册课题 2 金属的化学性质完美版ppt课件,文件包含课题2金属的化学性质两课时pptx、夜幕下的战斗mp4、铁置换铜mp4等3份课件配套教学资源,其中PPT共35页, 欢迎下载使用。
化学人教版课题1 溶液的形成背景图ppt课件: 这是一份化学人教版课题1 溶液的形成背景图ppt课件,共39页。PPT课件主要包含了关于溶液的认识,练习4,课堂练习等内容,欢迎下载使用。













