






2022高考化学一轮复习(步步高) 第三章 第18讲 常见金属及其化合物的综合应用课件
展开1.掌握常见金属元素知识网络构建及重要方程式的书写。2.了解硼及其化合物的性质。
二、知识拓展专题 硼及其化合物的性质
一、知识网络构建及方程式再书写
专项提能特训3 热点金属及其化合物的制备大题
微专题7 热重分析判断物质成分
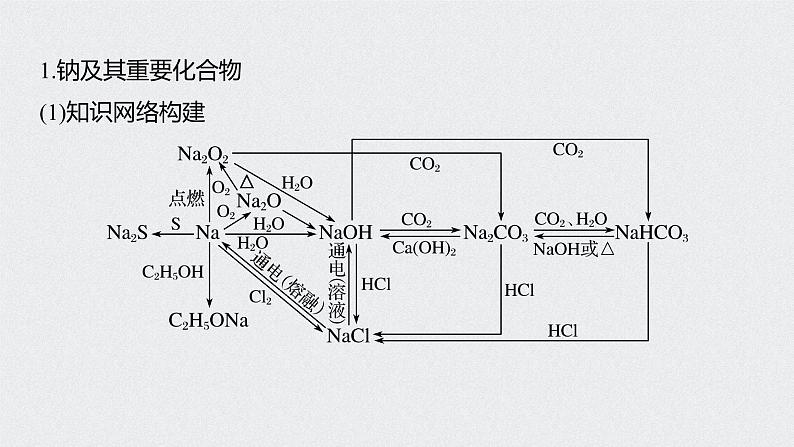
1.钠及其重要化合物(1)知识网络构建
(2)重要反应必练写出下列反应的化学方程式,是离子反应的写出离子方程式。①Na和H2O的反应_______________________________;②Na在空气中燃烧___________________;③Na2O2和H2O的反应__________________________________;
2Na+2H2O===2Na++2OH-+H2↑
2Na2O2+2H2O===4Na++4OH-+O2↑
④Na2O2和CO2的反应____________________________;⑤向NaOH溶液中通入过量CO2___________________;⑥将Na2CO3溶液与石灰乳混合______________________________;⑦向Na2CO3稀溶液中通入过量CO2__________________________;
2Na2O2+2CO2===2Na2CO3+O2
⑧将NaHCO3溶液和NaOH溶液等物质的量混合_________________________;⑨将NaHCO3溶液与澄清石灰水等物质的量混合__________________________________;⑩将NaHCO3溶液与少量澄清石灰水混合___________________________________________。
2.铝及其重要化合物(1)知识网络构建
(2)重要反应必练写出下列反应的离子方程式。①Al和NaOH溶液的反应________________________________;②Al(OH)3和NaOH溶液的反应____________________________;③Al(OH)3和盐酸的反应____________________________;④Al2O3和NaOH的反应__________________________;
Al(OH)3+3H+===Al3++3H2O
⑤Al2O3和盐酸的反应___________________________;⑥NaAlO2和过量盐酸的反应_________________________;⑦向NaAlO2溶液中通入过量CO2气体_____________________________________;⑧将NaAlO2溶液与NaHCO3溶液混合_____________________________________;
Al2O3+6H+===2Al3++3H2O
⑨将NaAlO2溶液与AlCl3溶液混合_______________________________;⑩将AlCl3溶液与NaHCO3溶液混合________________________________。
3.铁及其化合物(1)知识网络构建
(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。①Fe和过量稀HNO3的反应___________________________________;②Fe高温下和水蒸气的反应____________________________;③铝与氧化铁的铝热反应__________________________;
④用赤铁矿冶炼铁的原理__________________________;⑤Fe(OH)2长时间露置于空气中_______________________________;⑥FeO和稀HNO3的反应_______________________________________;⑦Fe(OH)3和HI的反应_______________________________________;
4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3+6H++2I-===2Fe2++I2+6H2O
⑧FeBr2溶液和少量Cl2的反应_________________________;⑨FeBr2溶液和等物质的量的Cl2反应_____________________________________;⑩FeBr2溶液和过量Cl2的反应_____________________________________。
2Fe2++Cl2===2Fe3++2Cl-
2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
4.铜及其化合物(1)知识网络构建
(2)重要反应必练写出下列反应的化学方程式,是离子反应的写离子方程式。①用两个化学方程式表示Cl2的氧化性大于Sa:__________________;b:__________________。②铜在潮湿的空气中生锈__________________________________。
2Cu+O2+CO2+H2O===Cu2(OH)2CO3
③将Cu和浓H2SO4混合加热_______________________________________。④Cu与浓HNO3的反应_______________________________________。⑤Cu与稀HNO3反应________________________________________。⑥FeCl3溶液腐蚀铜板_________________________。
Cu+2Fe3+===2Fe2++Cu2+
⑦将氨水逐滴滴入CuSO4溶液过程中所发生的反应___________________________________;_______________________________________________。⑧用惰性电极电解CuSO4溶液_________________________________。⑨用Cu作电极电解H2SO4溶液_______________________。⑩胆矾加热分解_____________________________。
Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O
1.硼硼单质有晶体硼和无定形硼两种,晶体硼相当稳定,无定形硼比较活泼,能发生如下反应:(1)高温下,与N2、S、X2等单质反应,如2B+N2 2BN。(2)高温下同金属反应生成金属硼化物。(3)赤热下,与水蒸气反应,2B+6H2O(g) 2B(OH)3+3H2。(4)与热的浓硫酸或浓硝酸反应,2B+3H2SO4(浓) 2H3BO3+3SO2↑,B+3HNO3(浓) H3BO3+3NO2↑。
2.硼酸(H3BO3)(1)一元弱酸,H3BO3+H2O H++[B(OH)4]-。(2)H3BO3受热时会逐渐脱水,首先生成偏硼酸(HBO2),继续升温可进一步脱水生成四硼酸(H2B4O7),更高温度时则转变为硼酸的酸酐(B2O3)。
3.硼氢化钠(NaBH4)硼氢化钠中的氢元素为-1价,具有还原性,故其可用作醛类、酮类和酰氯类的还原剂:
4.硼砂(Na2B4O7·10H2O)(1)制备:将偏硼酸钠溶于水形成较浓溶液,然后通入CO2调节pH,浓缩结晶分离出硼砂:4NaBO2+CO2+10H2O===Na2B4O7·10H2O+Na2CO3。(2)将硼砂溶于水,用硫酸溶液调节pH,可析出溶解度小的硼酸晶体:Na2B4O7+H2SO4+5H2O===4H3BO3↓+Na2SO4。
1.NaBH4与FeCl3反应可制取纳米铁:2FeCl3+6NaBH4+18H2O===2Fe+6NaCl+6H3BO3+21H2↑,下列说法正确的是A.该反应中氧化剂只有FeCl3
B.NaBH4的电子式为
C.NaBH4不能与水发生反应D.该反应中每生成1 ml Fe转移电子3 ml
NaBH4中H为-1价,水中H为+1价,两者发生归中反应可生成氢气,C项错误;题述氧化还原反应中,化合价升高的只有NaBH4中的H,由-1价升高到0价,可据此判断电子转移数目,每生成1 ml Fe,消耗3 ml NaBH4,转移电子12 ml,D项错误。
解析 反应2FeCl3+6NaBH4+18H2O===2Fe+6NaCl+6H3BO3+21H2↑中,FeCl3中的Fe由+3价降低到0价,水中部分H由+1价降低到0价,所以该反应中氧化剂为FeCl3和H2O,A项错误;
2.按要求回答问题(1)[2019·全国卷Ⅰ,26(3)]根据H3BO3的解离反应:H3BO3+H2O H++ ,Ka=5.81×10-10,可判断H3BO3是_______酸。
(2)[2015·全国卷Ⅰ, 27(1)(6)]写出Mg2B2O5·H2O与硫酸反应的化学方程式:____________________________________________。单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程:____________________________________________________。
(3)[2015·安徽理综,27(2)]请配平化学方程式:____NaBO2+____SiO2+____Na+____H2===____NaBH4+____Na2SiO3。(4)[2014·重庆理综,11(2)]NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_____________________________。
NaBH4+2H2O===NaBO2+4H2↑
3.硼、镁及其化合物在工农业生产中应用广泛。已知硼镁矿的主要成分为Mg2B2O5·H2O,硼砂的化学式为Na2B4O7·10H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示:
(1)写出硼元素在元素周期表中的位置:_______________。
(2)将硼砂溶于水后,用硫酸调节溶液的pH≈3.5以制取硼酸(H3BO3),该反应的离子方程式为________________________________。(3)由MgCl2·6H2O制备MgCl2时,一定条件是________________。
解析 因MgCl2在蒸干灼烧时会发生水解,其水解的化学方程式为MgCl2+2H2O Mg(OH)2+2HCl,所以为了防止氯化镁水解生成氢氧化镁,需要在HCl氛围中加热。
(4)制得的粗硼在一定条件下反应生成BI3,BI3在一定条件下受热分解可以得到纯净的单质硼。0.200 0 g粗硼制成的BI3完全分解,将生成的I2配制成100 mL碘水,量取10.00 mL碘水于锥形瓶中,向其中滴加几滴淀粉溶液,用0.300 0 ml·L-1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液18.00 mL。(提示: )滴定终点的现象为_____________________________________________________________________,该粗硼样品的纯度为____%。
最后一滴Na2S2O3溶液,锥形瓶中溶液蓝色褪去,且半分钟内不恢复原色
解析 消耗的Na2S2O3的物质的量为0.300 0 ml·L-1×0.018 L=0.005 4 ml,
则硼的质量为11 g·ml-1×0.018 ml=0.198 g,
(5)H3BO3[也可写成B(OH)3]可以通过电解NaB(OH)4溶液的方法制备。工作原理如图所示。
①b膜为________(填“阴离子”或“阳离子”)交换膜,写出产品室发生反应的离子方程式:__________________________,理论上每生成1 ml H3BO3,N室可生成_____L(标准状况)气体。
阴极的电解液为氢氧化钠溶液,所以N室的电极反应式为2H2O+2e-===H2↑+2OH-,
生成1 ml H3BO3时,需要M室和原料室分别转入1 ml H+、1 ml ,则需转移1 ml e-,所以N室可生成0.5 ml氢气,其体积在标准状况下为11.2 L。
②N室中,进口和出口的溶液浓度大小关系为a%______(填“>”或“<”)b%。
解析 N室溶液中氢氧根离子浓度增大,Na+从原料室通过阳离子交换膜进入N室,故N室进口溶液浓度比出口的小,即a%
回答下列问题:(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为____________________________。
NH4HCO3+NH3===(NH4)2CO3
解析 由流程图加入物质可知,“溶浸”时产生的气体只能是NH3,NH3与NH4HCO3反应生成用于“沉镁”的物质只能是(NH4)2CO3。
(2)“滤渣1”的主要成分有____________________。为检验“过滤1”后的滤液中是否含有Fe3+离子,可选用的化学试剂是___________。
SiO2、Fe2O3、Al2O3
解析 由流程图可知,在过滤获取H3BO3之前没有除Fe3+、Al3+的步骤,推知氧化铁、氧化铝在“溶浸”时没有溶解,而二氧化硅不溶于硫酸铵溶液,因而滤渣1的主要成分是二氧化硅、氧化铁、氧化铝。检验Fe3+的试剂可选用KSCN溶液。
(4)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为_________________________________________________________________________________________________________,母液经加热后可返回______工序循环使用。由碱式碳酸镁制备轻质氧化镁的方法是_________。
1.下列有关金属及其化合物的知识说法正确的是A.可用Na与MgCl2溶液反应制MgB.金属单质导电与电解质溶液导电原因相同C.常温下氧气与铝不反应,故常温下铝制品可以广泛应用D.观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+
解析 Na和水反应生成NaOH和H2,NaOH和MgCl2反应生成Mg(OH)2沉淀,所以Na不能置换Mg,故A错误;金属导电是自由电子定向移动,电解质溶液导电是溶液中阴、阳离子的定向移动,金属单质导电与电解质溶液导电原因不同,故B错误;常温下,铝和氧气反应生成一层致密的氧化铝薄膜,阻止了内部的铝与氧气的接触,所以铝制品可以广泛利用,故C错误;钠元素焰色为黄色,观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+,故D正确。
解析 室温下,Na在空气中反应生成Na2O,A项错误;2Al+2H2O+2OH-=== +3H2↑,B项正确;室温下,铜与浓硝酸反应生成NO2,C项错误;室温下,铁遇浓硫酸发生钝化,D项错误。
2.(2020·江苏,6)下列有关化学反应的叙述正确的是A.室温下,Na在空气中反应生成Na2O2B.室温下,Al与4.0 ml·L-1 NaOH溶液反应生成NaAlO2C.室温下,Cu与浓HNO3反应放出NO气体D.室温下,Fe与浓H2SO4反应生成FeSO4
3.(2020·浙江7月选考,8)下列说法不正确的是A.Cl-会破坏铝表面的氧化膜B.NaHCO3的热稳定性比Na2CO3强C.KMnO4具有氧化性,其稀溶液可用于消毒D.钢铁在潮湿空气中生锈主要是发生了电化学腐蚀
4.(2020·江苏,10)下列选项所示的物质间转化均能实现的是
解析 由Cl2制备漂白粉应通入石灰乳而不是石灰水中,A项错误;向氯化钠溶液中通入二氧化碳,无法制取碳酸氢钠固体,B项错误;向溴水中加入碘化钠溶液,可得到碘单质,C项正确;电解MgCl2溶液得不到Mg,D项错误。
5.a、b、c、d、e分别是Cu、Ag、Fe、Al、Mg五种金属中的一种。已知:①a、b均能与稀硫酸反应放出气体;②c与d的硝酸盐溶液反应,置换出单质d;③b与强碱反应放出气体;④b、e在冷的浓硫酸中钝化。由此可判断a、b、c、d、e依次是A.Mg、Al、Cu、Ag、Fe B.Fe、Cu、Al、Ag、MgC.Mg、Cu、Al、Ag、Fe D.Al、Mg、Ag、Cu、Fe
6.以色列理工学院的丹尼尔·谢德曼因发现“准晶体”而一人独享了2011年度诺贝尔化学奖。某组成为Al65Cu23Fe12的准晶体W具有低摩擦系数、高硬度、低表面能以及低传热性,正被开发为炒菜锅的镀层。下列有关说法中正确的是A.W的熔点比铝、铁、铜的都高B.将一定量W投入少量的盐酸中,充分反应后溶液中一定有Fe2+C.等质量W分别与足量NaOH溶液、盐酸反应,生成氢气的质量之比为 65∶73D.W在氯气中完全燃烧时可形成AlCl3、FeCl3两种离子化合物
解析 W属于合金,合金与组成它的各成分金属相比,其熔点较低,A错误;此合金中含有的金属中,铝的还原性最强,当酸量不足时,溶液中一定存在Al3+,可能存在Fe2+,B错误;
合金与氯气反应产生的AlCl3为共价化合物,不是离子化合物,D错误。
7.下列各组物质中,满足图示一步转化关系的是
A.①②③ B.①③④ C.②③ D.①④
8.Mg与Br2反应可生成具有强吸水性的MgBr2,该反应剧烈且放出大量的热。实验室采用如图装置制备无水MgBr2。下列说法错误的是
A.a为冷却水进口B.装置A的作用是吸收水蒸气和挥发出的溴蒸气C.实验时需缓慢通入N2,防止反应过于剧烈D.不能用干燥空气代替N2,因为副产物MgO会 阻碍反应的进行
解析 冷凝管起到冷凝回流的作用,冷凝管内冷凝水的方向为下进上出,则a为冷却水进口,故A正确;MgBr2具有较强的吸水性,制备无水MgBr2,需要防止空气中的水蒸气进入三颈烧瓶,则装置A的作用是吸收水蒸气,但无水CaCl2不能吸收溴蒸气,故B错误;制取MgBr2的反应剧烈且放出大量的热,实验时利用干燥的氮气将溴蒸气带入三颈烧瓶中,为防止反应过于剧烈,实验时需缓慢通入N2,故C正确;不能用干燥空气代替N2,空气中含有的氧气可将镁氧化为副产物MgO而阻碍反应的进行,故D正确。
下列叙述错误的是A.合理处理废旧电池有利于 保护环境和资源再利用B.从“正极片”中可回收的金属元素有Al、Fe、LiC.“沉淀”反应的金属离子为Fe3+D.上述流程中可用硫酸钠代替碳酸钠
9.(2018·全国卷Ⅰ,7)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如图:
解析 Li2SO4易溶于水,用硫酸钠代替碳酸钠,不能形成含Li沉淀,D项错误;合理处理废旧电池有利于保护环境和资源再利用,A项正确;LiFePO4中含有Li和Fe元素,正极片碱溶所得滤液中含有Al元素,B项正确;Fe2+能被HNO3氧化为Fe3+,Fe3+遇到碱液后沉淀,而另一种金属离子——锂离子遇到碳酸钠后沉淀,C项正确。
10.探究Na2O2与水的反应,实验如图:
已知: 。下列分析不正确的是A.①④实验中均发生了氧化还原反应和复分解反应B.①⑤实验中产生的气体能使带火星的木条复燃,说明存在H2O2C.③和④实验不能说明溶解性:BaO2>BaSO4D.⑤实验中说明H2O2具有还原性
解析 ①中的反应机理可以认为过氧化钠与水反应生成过氧化氢与氢氧化钠,过氧化氢分解生成水和氧气,发生复分解反应和氧化还原反应,④中过氧化钡与稀硫酸反应生成过氧化氢和硫酸钡沉淀,过氧化氢分解生成水和氧气,因此两个试管中均发生了氧化还原反应和复分解反应,A项正确;①中过氧化钠与水反应生成氢氧化钠和氧气,不能说明存在H2O2,B项错误;
④中过氧化钡与硫酸反应生成过氧化氢和硫酸钡沉淀,证明酸性:硫酸>过氧化氢,不能说明溶解性:BaO2>BaSO4,C项正确;⑤中产生的气体为氧气,氧元素化合价升高,H2O2作还原剂,说明H2O2具有还原性,D项正确。
11.草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。已知:①草酸亚铁不溶于水,可溶于酸;②回答下列问题:Ⅰ.甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为________(填“正确”或“不正确”),理由是______________________________________________。
Ⅱ.乙同学为测定草酸亚铁晶体FeC2O4·xH2O中的结晶水含量,利用如下装置:
(1)做实验前首先要:_______________。
(2)称取一定质量的晶体,装好药品,开始实验。接下来的实验步骤依次为__________,重复实验直至B中恒重。a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入氮气 e.冷却至室温 f.称量
解析 称取一定质量的晶体,装好药品,开始实验。接下来的实验步骤:由于草酸亚铁晶体中亚铁离子易被氧气氧化,所以要排净装置内的空气,打开K,缓缓通入氮气(d),然后点燃酒精灯,加热(a),反应发生,结束后,熄灭酒精灯(b),冷却至室温(e),关闭K (c),进行称量(f),重复实验直至B中恒重;正确的操作步骤:dabecf。
Ⅲ.丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取a g草酸亚铁晶体溶于稀硫酸,再把所得溶液稀释成500 mL,取出50 mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用c ml·L-1的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液V mL。(2Na2S2O3+I2===Na2S4O6+2NaI)(1)写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式:____________________________________________________________。
(2)上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有________________________。
500 mL容量瓶、胶头滴管
解析 把草酸亚铁溶液稀释成500 mL溶液时,除烧杯和玻璃棒外,还必需的玻璃仪器有500 mL容量瓶、胶头滴管。
(3)x=___________。
解析 根据反应 +5Fe2++5H2C2O4+14H+===3Mn2++5Fe3++12H2O+10CO2↑可知,反应产生的Fe3+把碘离子氧化为碘单质,反应为2Fe3++2I-===2Fe2++I2;生成的碘又被Na2S2O3还原为I-,反应为2Na2S2O3+I2===Na2S4O6+2NaI;根据上述反应关系可知:n(FeC2O4·xH2O)=n(FeC2O4)=n(Fe2+)=n(Fe3+)= n(I2)=n(Na2S2O3),n(Na2S2O3)=(V×10-3 ×c)ml,所以50 mL溶液中n(FeC2O4·xH2O)=(V×10-3×c)ml,又原溶液为500 mL,所以n(FeC2O4·xH2O)=(V×10-3×c)× ml=10(V×10-3×c)ml;
2024届高考化学一轮复习 第三章 金属及其化合物 第3讲 金属材料课件PPT: 这是一份2024届高考化学一轮复习 第三章 金属及其化合物 第3讲 金属材料课件PPT,共58页。PPT课件主要包含了2常见合金材料,答案B,答案C,2化学性质,答案D,答案A等内容,欢迎下载使用。
2022年高考化学一轮复习课件 第4章 第26讲 常见非金属及其化合物重难点再落实 (含解析): 这是一份2022年高考化学一轮复习课件 第4章 第26讲 常见非金属及其化合物重难点再落实 (含解析),共60页。PPT课件主要包含了课时精练巩固提高,内容索引,②X为CO2,③X为强酸如HCl,2交叉型转化,3三角型转化,Fe3++Fe,3Fe2+,氢氟酸HF,非极性键等内容,欢迎下载使用。
2022年高考化学一轮复习课件 第3章 第18讲 常见金属及其化合物的综合应用 (含解析): 这是一份2022年高考化学一轮复习课件 第3章 第18讲 常见金属及其化合物的综合应用 (含解析),共60页。PPT课件主要包含了复习目标,课时精练巩固提高,内容索引,一元弱,第二周期ⅢA族,在HCl氛围中加热,阴离子,KSCN溶液,Mg2++,高温焙烧等内容,欢迎下载使用。












