
2022高考化学一轮复习(步步高) 第四章 第19讲 碳、硅及无机非金属材料课件
展开1.了解C、Si元素单质及其重要化合物的制备方法,掌握其主要性质 及应用。2.了解C、Si元素单质及其重要化合物对环境的影响。3.了解无机非金属材料的性质和用途。
考点二 硅、无机非金属材料
考点一 碳及其重要化合物
微专题8 二氧化碳与盐或碱溶液反应产物的判断
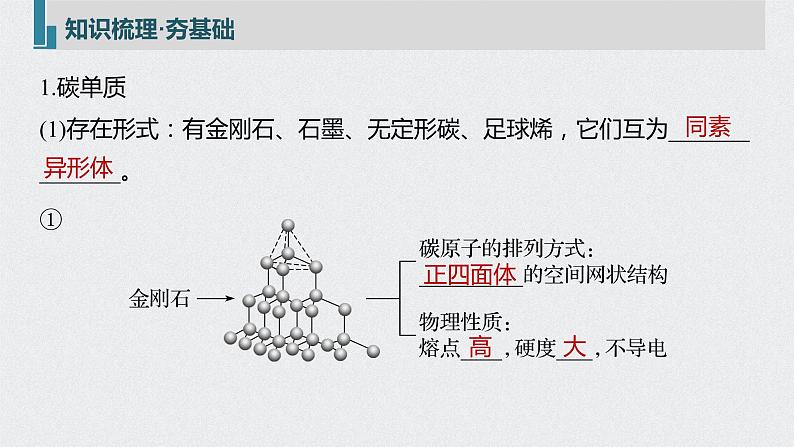
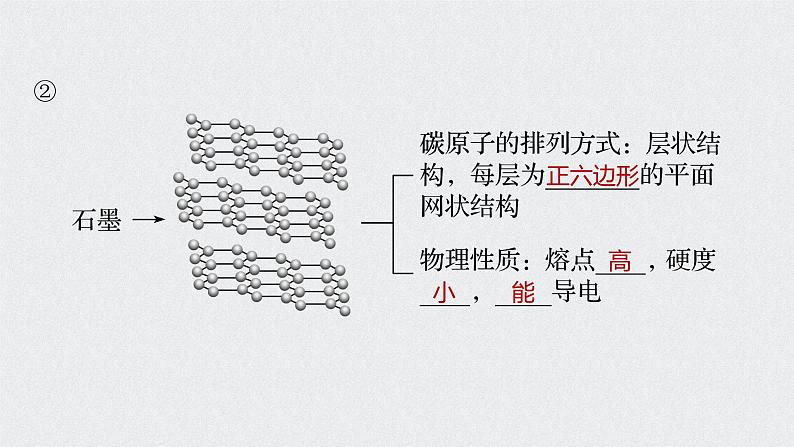
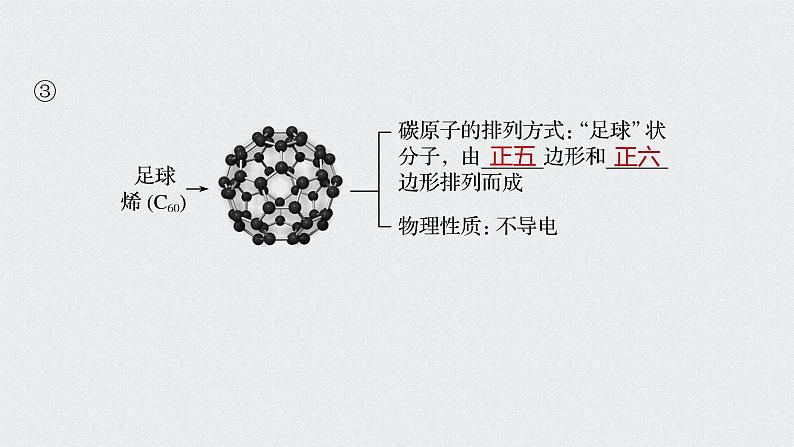
1.碳单质(1)存在形式:有金刚石、石墨、无定形碳、足球烯,它们互为______________。
(2)主要化学性质——还原性
2.CO、CO2的性质对比
Ca(OH)2+CO2===CaCO3↓+H2O
3.碳酸(H2CO3)性质:为弱酸、不稳定。碳酸(H2CO3)只能在水中存在。H2CO3在水中与CO2共存,因此常把CO2+H2O当碳酸用。
4.碳酸的正盐和酸式盐的比较
(1)金刚石和石墨由相同的元素组成,因此它们具有相同的性质( )错因:___________________________________。(2)石墨转变为金刚石的反应属于氧化还原反应( )错因:___________________________________________________。(3)向空气中排放二氧化碳会形成酸雨( )错因:_______________________________________。
它们的化学性质相似,但物理性质不同
同素异形体之间的转化,化合价不变,不是氧化还原反应
pH<5.6的雨水才是酸雨,CO2不能形成酸雨
(4)向CaCl2溶液中通入CO2气体,溶液变浑浊,继续通入CO2至过量,浑浊消失( )错因:_____________________________________________。(5)氨化的饱和食盐水中通入足量的CO2气体,会析出晶体( )错因:________________________________________________________。
由于盐酸的酸性比碳酸强,CO2与CaCl2溶液不反应
1.碳的重要化合物转化关系如图:
思考每步转化的试剂及条件,并用化学方程式表示标有序号的各步变化。①________________________________________________________________________;②_____________________________________________;③_________________;
④_________________________;⑤______________________________;⑥_____________________________________________________________________________。
CaCO3+CO2+H2O===Ca(HCO3)2
2.写出除去下列气体中混有的杂质(括号内为杂质)可采取的方法。(1)CO(CO2):_____________________________;(2)CO2(CO):_____________________________;(3)CO2(O2):______________________________;(4)CO2(SO2):________________________________________________;(5)CO2(HCl):________________________________。
通过盛有NaOH浓溶液的洗气瓶
通过盛放灼热CuO的硬质玻璃管
通过盛放灼热铜网的硬质玻璃管
通过盛有饱和NaHCO3溶液或酸性KMnO4溶液的洗气瓶
通过盛有饱和NaHCO3溶液的洗气瓶
1.新材料的新秀——石墨烯和氧化石墨烯已成为物理、化学、材料科学研究的国际热点课题。其结构模型如图所示。
下列有关说法正确的是A.石墨烯是一种新型化合物B.氧化石墨烯即石墨烯的氧化物C.二者和石墨都是碳的同素异形体D.氧化石墨烯具有一定的亲水性
解析 石墨烯是碳的单质,A错误;氧化石墨烯因为还含有氢元素,故不是石墨烯的氧化物,也不是碳的同素异形体,B、C错误;由于氧化石墨烯结构中含有羟基和羧基等亲水基团,所以它具有一定的亲水性,D正确。
2.溶洞和钟乳石是大自然的杰作。溶洞和钟乳石的形成与自然界中碳及其化合物间的转化有着密切联系。下列有关自然界中碳及其化合物间的转化的说法中不正确的是A.溶洞是通过CaCO3与H2O、CO2作用生成可溶性的Ca(HCO3)2形成的B.游客的参观不会对其造成影响C.溶洞和钟乳石的形成过程中没有涉及氧化还原反应D.钟乳石是在一定条件下由可溶性的Ca(HCO3)2转化成CaCO3的结果
3.(2020·成都调研)科技的进步为二氧化碳资源化利用提供了广阔的前景。下列说法错误的是
A.CO2是自然界碳循环中的重要物质B.CO2加氢转化为乙烯,CO2被还原C.CO2电催化时,在阳极转化为燃料D.CO2与环氧丙烷可合成可降解塑料
解析 含碳燃料燃烧以及动植物呼吸都会产生二氧化碳,植物光合作用消耗二氧化碳,所以CO2是自然界碳循环中的重要物质,故A正确;CO2加氢转化为乙烯,C的化合价降低,CO2得电子,被还原,故B正确;
CO2中C为+4价,只能发生得电子的还原反应,CO2在阴极得电子转化为燃料,阳极为失电子的氧化反应,故C错误;CO2与环氧丙烷发生加聚反应,可合成可降解塑料,故D正确。
4.碳和碳的氧化物是生活中的常见物质,回答下列问题:(1)下列有关说法正确的是_____(填字母)。a.利用二氧化碳制造全降解塑料,可以减缓二氧化碳对环境的影响b.金刚石、石墨、C60的化学性质相似,物理性质却有很大差异c.木炭、一氧化碳在一定条件下都能还原氧化铜d.大气中二氧化碳的消耗途径主要是绿色植物的光合作用
(2)吸烟对人体有害,燃着的香烟产生的烟气含有一种能与血液中的血红蛋白结合的有毒气体,它是____(填化学式)。(3)影视舞台上经常看到云雾缭绕,使人如入仙境的景象,产生这一景象可用的物质是_____(填物质俗称)。(4)为减少二氧化碳对环境的影响,可将二氧化碳与氢气在300 ℃、200 kPa和催化剂的条件下,反应生成一种清洁燃料甲醇(CH3OH)和水,其反应的化学方程式为____________________________________。
Na2SiO3+H2O
Na2SiO3+CO2↑
SiO2+4HF===SiF4↑+2H2O
H2SiO3↓+Na2CO3
Na2SiO3+2HCl===H2SiO3↓+2NaCl
4.硅酸盐(1)硅酸盐是由硅、氧与其他化学元素结合而成的化合物的总称,是构成地壳岩石的主要成分。
(2)硅酸钠①白色、可溶于水的粉末状固体,其水溶液俗称_______。有黏性,水溶液显碱性。②与酸性比硅酸强的酸反应a.与盐酸反应的化学方程式:________________________________。b.与CO2水溶液反应的化学方程式:______________________________________。③用途:黏合剂(矿物胶),耐火阻燃材料。
Na2SiO3+2HCl===2NaCl+H2SiO3↓
Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓
(3)硅酸盐组成的表示方法:通常用二氧化硅和金属氧化物的组合形式表示硅酸盐的组成。①氧化物的书写顺序:活泼金属氧化物→较活泼金属氧化物→二氧化硅→水,不同氧化物间以“·”隔开。②各元素的化合价保持不变,且满足化合价代数和为零,各元素原子个数比符合原来的组成。如硅酸钠(Na2SiO3)可表示为___________,长石(KAlSi3O8)可表示为_______________。
K2O·Al2O3·6SiO2
5.无机非金属材料(1)传统无机非金属材料,如水泥、玻璃、陶瓷等硅酸盐材料。①常见硅酸盐材料比较
②玻璃生产中的两个重要反应:Na2CO3+SiO2 ______________;CaCO3+SiO2 ______________。
CaSiO3+CO2↑
(2)新型无机非金属材料
(1)工业上用焦炭和石英制取粗硅的反应方程式为SiO2+C Si+CO2↑( )错因:_____________________________。(2)Si和SiO2都可用于制造光导纤维( )错因:____________________________________。(3)非金属性:C>Si,则热稳定性:CH4>SiH4( )错因:________________________________________________________。(4)SiO2是酸性氧化物,可溶于强碱(NaOH),不溶于任何酸( )错因:___________________。
在高温条件下生成CO而不是CO2
Si是半导体材料,SiO2用于制造光导纤维
SiO2能与氢氟酸反应
(1)工业上可用以下流程制取高纯硅,完成各步反应的化学方程式:
反应①:__________________________;反应②:__________________________;反应③:___________________________。
(2)能否依据反应Na2CO3+SiO2 Na2SiO3+CO2↑说明H2SiO3的酸性比H2CO3强?
答案 不能。强酸+弱酸盐===强酸盐+弱酸,该规律仅适用于常温下水溶液中进行的反应,而该反应是在高温且熔融态下进行的,只能从化学平衡移动角度去解释反应发生的原因——CO2为气体,能及时分离出反应体系,使化学反应向右进行。
题组一 硅 无机非金属材料的性质及应用1.(2019·康定教学质量检查)“九秋风露越窑开,夺得千峰翠色来”是赞誉越窑秘色青瓷的诗句,描绘我国古代精美的青瓷工艺品。玻璃、水泥和陶瓷均为硅酸盐制品,下列有关说法中正确的是A.玻璃是人类最早使用的硅酸盐制品B.制水泥的原料为纯碱、石灰石和石英C.硅酸盐制品的性质稳定、熔点较高D.沙子和黏土的主要成分均为硅酸盐
解析 陶瓷是人类最早使用的硅酸盐制品,A项错误;纯碱、石灰石和石英是制玻璃的原料,而制水泥的原料是黏土和石灰石,B项错误;硅酸盐制品性质稳定、熔点高,C项正确;沙子的主要成分是SiO2,黏土的主要成分是硅酸盐,D项错误。
2.(2020·河南期末)下列关于二氧化硅的说法正确的是A.二氧化硅是酸性氧化物,因此能与水反应生成硅酸B.二氧化硅制成的光导纤维,由于导电能力强而被用于制造光缆C.二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应D.用二氧化硅制取单质硅时,当生成2.24 L气体(标准状况)时,得到2.8 g硅
解析 二氧化硅是酸性氧化物,但是二氧化硅不溶于水,与水不反应,故A错误;二氧化硅制成的光导纤维,由于其良好的光学特性而被用于制造光缆,故B错误;碳酸的酸性强于硅酸,二氧化硅不能与碳酸钠溶液反应,但在高温时,二氧化硅能够与碳酸钠固体反应生成硅酸钠和二氧化碳,故C正确;由化学方程式SiO2+2C Si+2CO↑,可知当生成2.24 L(标准状况)即0.1 ml气体时,得到0.05 ml 即1.4 g硅,故D错误。
3.下列说法不正确的是A.SiO2能与HF反应,因此可用HF刻蚀玻璃B.向Na2SiO3溶液中逐滴加入稀盐酸制备硅酸凝胶C.氮化硅是一种重要的结构陶瓷材料,化学式为Si3N4D.石英是良好的半导体材料,可以制成光电池,将光能直接转化成电能
解析 氢氟酸与二氧化硅反应生成四氟化硅和水,故HF可用于刻蚀玻璃,故A正确;盐酸的酸性强于硅酸,所以向Na2SiO3溶液中逐滴加入稀盐酸可制备硅酸凝胶,故B正确;根据N的非金属性强于Si及化合物中正负化合价的代数和为0的原则,得氮化硅的化学式为Si3N4,故C正确;晶体硅是良好的半导体材料,可以制成光电池,将光能直接转化成电能,而不是二氧化硅,故D错误。
题组二 工业上制取高纯硅4.科学家最新研制的利用氯化氢和氢气生产高纯硅的工艺流程如图所示:
容器①中进行的反应为①Si(粗)+3HCl(g) SiHCl3(l)+H2(g);容器②中进行的反应为②SiHCl3+H2 Si(纯)+3HCl。下列说法不正确的是
A.该工艺流程的优点是部分反应物可循环使用B.①和②互为可逆反应C.该流程中需要隔绝空气
解析 A项,反应②中生成的HCl在反应①中循环利用,正确;B项,反应①与反应②对应的反应温度不一致,不是可逆反应,错误;C项,高温条件下,Si、SiHCl3、H2都与O2反应,故需隔绝空气,正确;D项,SiO2不与HCl反应,不能通过上述途径制硅,正确。
5.晶体硅是一种重要的非金属原料,由粗硅制备纯硅的主要步骤如下:①粗硅与干燥的HCl气体反应制得SiHCl3:Si(粗)+3HCl SiHCl3+H2;②经过纯化的SiHCl3与过量H2在1 000~1 100 ℃下反应制得纯硅。回答相关问题:(1)粗硅与HCl气体反应完全后,经冷凝得到SiHCl3(沸点为36.5 ℃),只含有少量SiCl4(沸点为57.6 ℃)和HCl(沸点为-84.7 ℃),提纯SiHCl3的方法为_____。
(2)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置已略去):
①在加热D装置前应先打开A装置中分液漏斗的活塞,目的是____________________________。②C装置中烧瓶需要加热,采用的方法是_________。
1.(2019·全国卷Ⅰ,7)陶瓷是火与土的结晶,是中华文明的象征之一,其形成、性质与化学有着密切的关系。下列说法错误的是A.“雨过天晴云破处”所描述的瓷器青色,来自氧化铁B.闻名世界的秦兵马俑是陶制品,由黏土经高温烧制而成C.陶瓷是应用较早的人造材料,主要化学成分是硅酸盐D.陶瓷化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点
解析 “雨过天晴云破处”所描述的瓷器青色与氧化亚铁有关,而氧化铁显红棕色,A项错误;秦兵马俑是陶制品,由黏土经高温烧制而成,B项正确;陶瓷以黏土为原料,经高温烧制而成,属于人造材料,主要成分是硅酸盐,C项正确;陶瓷主要成分是硅酸盐,硅酸盐中硅元素化合价处于最高价,化学性质稳定,具有耐酸碱侵蚀、抗氧化等优点,D项正确。
2.化学与生活密切相关。下列叙述错误的是A.高纯硅可用于制作光感电池(2019·全国卷Ⅲ,7A)B.活性炭具有除异味和杀菌作用(2019·全国卷Ⅲ,7C)C.无水CCl2呈蓝色,吸水会变为粉红色,可用于判断变色硅胶是否吸水(2019·天津,3D)D.天然石英和水晶的主要成分都是二氧化硅(2019·浙江4月选考,8C)
3.下列说法正确的是A.汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏土(2018·天津,1C)B.SiO2具有导电性,可用于制作光导纤维和光电池(2018·海南,5B)C.12 g金刚石中含有化学键的数目为4NA(2018·海南,9A)D.因为SiO2熔点高硬度大,所以可用于制光导纤维(2018·江苏,3B)
解析 工业上以黏土为原料烧制瓷器,A项正确;二氧化硅对光具有良好的全反射作用,故用于制作光导纤维,而Si为半导体材料,可作光电材料,B项错误;
SiO2用于制造光导纤维是由于SiO2具有光学性质,与熔点和硬度无关,D项错误。
4.下列有关硅及其化合物的叙述错误的是A.SO2通入Na2SiO3溶液产生胶状沉淀,证明酸性H2SO3>H2SiO3(2017·北京,10D)B.可用磨口玻璃瓶保存NaOH溶液(2015·海南,7B)C.HF能与SiO2反应,可用氢氟酸在玻璃器皿上刻蚀标记(2016·全国卷Ⅲ,7D)D.石英砂可用于生产单晶硅(2016·海南,4C)
解析 A项,依据强酸制弱酸原理判断;B项,NaOH与玻璃中的SiO2会发生反应2NaOH+SiO2===Na2SiO3+H2O,产生的Na2SiO3有黏合性,会将玻璃瓶与玻璃塞黏在一起,因此不能使用玻璃塞,要用橡胶塞,错误。
1.(2020·山东莱芜月考)下列关于碳及其氧化物的说法不正确的是A.过度排放CO2会导致“温室效应”,应提倡“低碳生活”B.一氧化碳易与血液中的血红蛋白结合C.金刚石和石墨都是碳单质,但原子排列方式不同,物理性质也不同D.CO、CO2、葡萄糖都属于有机物
解析 CO、CO2不属于有机物。
2.(2020·湖北百所重点学校联考)近年来美国研究人员合成了光伏电池新型硅材料——Si24。下列相关说法正确的是A.Si24是一种新型化合物B.Si24是硅的一种同素异形体C.Si24易与稀硫酸反应生成氢气D.硅太阳能电池供电原理与原电池相同
解析 该物质是一种单质而不是化合物,故A错误;Si24是单质,与硅单质属于同素异形体,故B正确;硅的性质稳定,不与稀硫酸反应,故C错误;硅太阳能电池供电原理是将太阳能转化为电能,而原电池供电原理是将化学能转化为电能,因此两者原理不同,故D错误。
3.常温下,下列各组物质不发生反应的是①硅与NaOH溶液 ②硅与盐酸 ③硅与氢氟酸 ④二氧化硅与碳酸钠 ⑤二氧化硅与NaOH溶液 ⑥二氧化硅与浓硝酸A.①②④ B.③④⑥ C.②⑤⑥ D.②④⑥
解析 常温下,能发生反应①Si+2NaOH+H2O===Na2SiO3+2H2↑, ③Si+4HF===SiF4↑+2H2↑,⑤SiO2+2NaOH===Na2SiO3+H2O。
4.下列有关硅及其化合物的说法中正确的是A.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中B.反应①Na2SiO3+H2O+CO2===Na2CO3+H2SiO3↓,反应②Na2CO3+ SiO2 Na2SiO3+CO2↑,两反应是相互矛盾的,不可能都发生C.普通玻璃、石英玻璃、水泥等均属于硅酸盐材料D.硅的导电性能介于金属和绝缘体之间,是良好的半导体材料
解析 反应②是在高温下进行的,CO2为气体,逸出可使平衡正向移动,促使反应继续进行,B项错误;石英玻璃不属于硅酸盐材料,C项错误。
5.(2020·江西师大附中模拟)由下列实验事实得出的结论正确的是A.由SiO2不能与水反应生成H2SiO3可知,SiO2不是H2SiO3的酸酐B.由SiO2+2C Si+2CO↑可知,碳的非金属性强于硅C.CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3D.SiO2可与NaOH溶液反应,也可与氢氟酸反应,可知SiO2为两性氧化物
解析 SiO2是H2SiO3的酸酐,A错误;SiO2+2C Si+2CO↑,说明还原性C>Si,但不能比较非金属性,B错误;CO2+Na2SiO3+H2O===H2SiO3↓+Na2CO3,说明酸性H2CO3>H2SiO3,C正确;两性氧化物是指和酸、碱反应生成盐和水的氧化物,二氧化硅和氢氟酸反应是其特殊性质,不能和其他酸发生反应,二氧化硅和碱溶液反应生成盐和水,是酸性氧化物,D项错误。
6.向某碳酸钠溶液中逐滴加1 ml·L-1的盐酸,测得溶液中Cl-、 的物质的量随加入盐酸体积的关系如图所示,其中n2∶n1=3∶2,则下列说法中正确的是A.Oa段反应的离子方程式与ab段反应的离子方程 式相同B.该碳酸钠溶液中含有1 ml Na2CO3C.b=0.6D.当V(盐酸)=b L时生成CO2的物质的量为0.3 ml
由加入a L盐酸时生成 为0.5 ml,可知n(HCl)=0.5 ml,n(Na2CO3)=0.5 ml,B项错误;由n2∶n1=3∶2,可推知n2=0.6 ml,n1=0.4 ml,C项正确;当盐酸为b L时产生n(CO2)=0.1 ml,D项错误。
7.(2020·黑龙江大庆铁人中学月考)青石棉是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀HNO3溶液处理时,还原产物只有NO,下列说法不正确的是A.青石棉是一种硅酸盐材料B.青石棉溶于足量的硝酸得到澄清溶液C.青石棉的化学组成可表示为Na2O·3FeO·Fe2O3·8SiO2·H2OD.1 ml青石棉能使1 ml HNO3被还原
解析 硅酸盐指的是硅、氧与其他元素(主要是铝、铁、钙、镁、钾、钠等)结合而成的化合物的总称,青石棉是一种硅酸盐材料,A正确;青石棉中硅元素以硅酸根离子的形式存在,与硝酸反应时生成硅酸,不溶于水,B错误;硅酸盐写成氧化物形式的先后顺序为:活泼金属氧化物,较活泼金属氧化物、二氧化硅、水,所以青石棉的化学组成用氧化物的形式可表示为Na2O·3FeO·Fe2O3·8SiO2·H2O,C正确;青石棉中含有二价铁,根据氧化还原反应中得失电子守恒,有关系式:Na2O·3FeO·Fe2O3·8SiO2·H2O~HNO3,所以1 ml青石棉能使1 ml硝酸被还原,故D正确。
8.水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:
回答下列问题:(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是___________________________________,还可以使用______代替硝酸。
将样品中可能存在的Fe2+氧化为Fe3+
解析 水泥样品中含有铁的氧化物。加入盐酸后的溶液中可能含有Fe3+、Fe2+,Fe2+在pH为4~5时不能形成沉淀除去,所以需要先加入氧化剂将Fe2+氧化为Fe3+,故加入硝酸的目的是将样品中可能存在的Fe2+氧化为Fe3+;双氧水是一种强氧化剂,可将Fe2+氧化为Fe3+,本身被还原为水,不会引入新的杂质离子,故可用双氧水代替硝酸。
解析 钙、铁、铝和镁等金属的氧化物都能溶于盐酸和硝酸的混合液,而二氧化硅不与盐酸、硝酸反应,故沉淀A的主要成分为SiO2;二氧化硅可与氢氟酸反应,生成四氟化硅和水,该反应的化学方程式为SiO2+4HF===SiF4↑+2H2O。
(2)沉淀A的主要成分是______,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为__________________________。
解析 Fe3+和Al3+在pH为4~5时可水解生成氢氧化铁、氢氧化铝,水解过程中会生成氢氧化铁胶体和氢氧化铝胶体,不利于分离出沉淀,加热可使胶体聚沉,有利于分离出沉淀,所以加热可防止胶体的生成,易于沉淀分离,故沉淀B的主要成分为Al(OH)3、Fe(OH)3。
(3)加氨水过程中加热的目的是____________________________。沉淀B的主要成分为_________、________(填化学式)。
防止胶体生成,易于沉淀分离
Al(OH)3 Fe(OH)3
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,滴定反应为: +H++H2C2O4―→Mn2++CO2+H2O。实验中称取0.400 g水泥样品,滴定时消耗了0.050 0 ml·L-1的KMnO4溶液36.00 mL,则该水泥样品中钙元素的质量分数为_______。
解析 根据化合价升降法、电荷守恒和质量守恒配平可得:2MnO+6H++5H2C2O4===2Mn2++10CO2↑+8H2O,设含钙的物质的量为x ml,由反应方程式和钙元素守恒可得关系式:5Ca2+ ~ 5H2C2O4 ~ 5 ml 2 mlx ml 0.050 0 ml·L-1×36.00×10-3 L解得x=4.5×10-3,则0.400 g水泥样品中钙元素的质量为4.5×10-3 ml×40 g·ml-1=0.180 g,
9.某实验小组设计了如图装置对焦炭还原二氧化硅的气体产物的成分进行探究。
已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO+PdCl2+H2O===CO2+2HCl+Pd↓(产生黑色金属钯粉末,使溶液变浑浊)。 (1)实验时要通入足够长时间的N2,其原因是___________________________________________________________________。
要用N2将装置中的空气排尽,
避免空气中的O2、CO2、水蒸气对实验产生干扰
解析 碳与二氧化硅反应需在高温下进行,高温下,碳与空气中的氧气也能反应,所以实验时要将装置中的空气排尽,则需要通入足够长时间的N2。
(2)装置B的作用是____________________。
解析 根据装置图可知,B装置可以作安全瓶,防止倒吸。
(3)装置C、D中所盛试剂分别为___________、__________,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为__________________________________。
解析 根据元素守恒,碳与二氧化硅反应可能生成一氧化碳,也可能生成二氧化碳,所以C装置用来检验是否有二氧化碳,D装置用来检验是否有一氧化碳,装置C、D中所盛试剂分别为澄清石灰水、PdCl2溶液;若装置C、D中溶液均变浑浊,说明既有二氧化碳又有一氧化碳,且经检测两气体产物的物质的量相等,根据原子守恒可知,化学方程式为3SiO2+4C 2CO2↑+2CO↑+3Si。
(4)该装置的缺点是__________________________。
没有尾气吸收装置来吸收CO
解析 一氧化碳有毒,不能排放到空气中,而该装置没有尾气吸收装置来吸收CO。
第15讲 碳、硅及无机非金属材料(课件)-2024年高考化学一轮复习(新教材新高考): 这是一份第15讲 碳、硅及无机非金属材料(课件)-2024年高考化学一轮复习(新教材新高考),共60页。PPT课件主要包含了复习目标,网络构建,知识梳理题型归纳,真题感悟,内容索引,考情分析,PARTONE等内容,欢迎下载使用。
第11讲 碳、硅及无机非金属材料-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第11讲 碳、硅及无机非金属材料-备战2024年高考化学一轮复习精品课件(全国通用),共24页。PPT课件主要包含了血红蛋白,Na2CO3+H2O,NaHCO3,CaSiO3,Na2CO3,光导纤维,制冷剂,xCO2,xH218O,氧和金属等内容,欢迎下载使用。
2024年高考化学一轮总复习 第4单元 第1讲 碳、硅及无机非金属材料 课件: 这是一份2024年高考化学一轮总复习 第4单元 第1讲 碳、硅及无机非金属材料 课件,共58页。PPT课件主要包含了有机物,石墨C60,同素异形体,氧化物,硅酸盐,晶体硅,无定形硅,空间立体网状,光导纤维,干燥剂等内容,欢迎下载使用。