



2022高考化学一轮复习(步步高) 第四章 第24讲 氮及其化合物的转化课件
展开1.了解氮及其化合物的转化关系。2.了解NOx与H2O、金属与HNO3的相关计算。3.了解其他含氮化合物的性质。
考点二 氮氧化物(NOx)、HNO3的相关计算
考点一 氮及其化合物的相互转化
微专题12 亚硝酸及亚硝酸钠的性质
专项提能特训5 非金属及其化合物对环境的影响
微专题13 绿色化学与环境保护
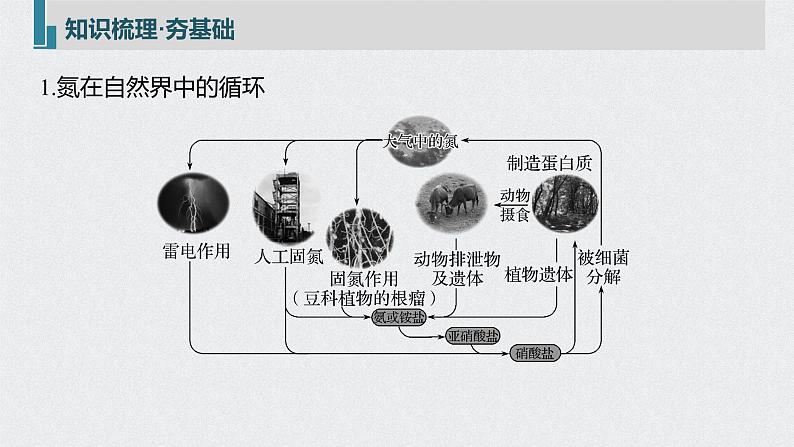
1.氮在自然界中的循环
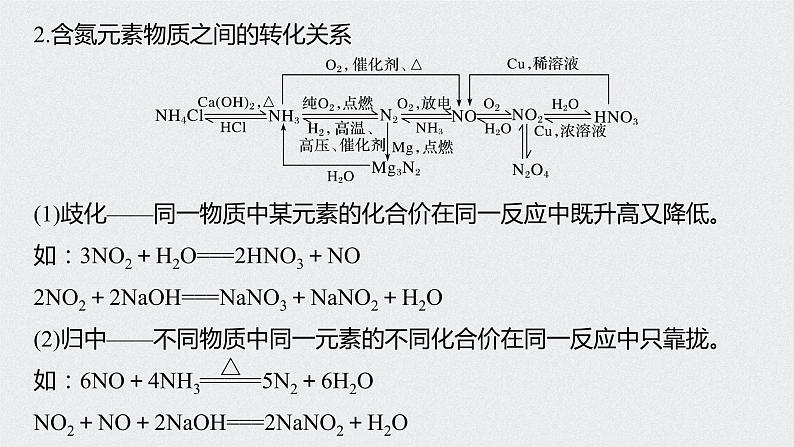
2.含氮元素物质之间的转化关系
(1)歧化——同一物质中某元素的化合价在同一反应中既升高又降低。如:3NO2+H2O===2HNO3+NO2NO2+2NaOH===NaNO3+NaNO2+H2O(2)归中——不同物质中同一元素的不同化合价在同一反应中只靠拢。如:6NO+4NH3 5N2+6H2ONO2+NO+2NaOH===2NaNO2+H2O
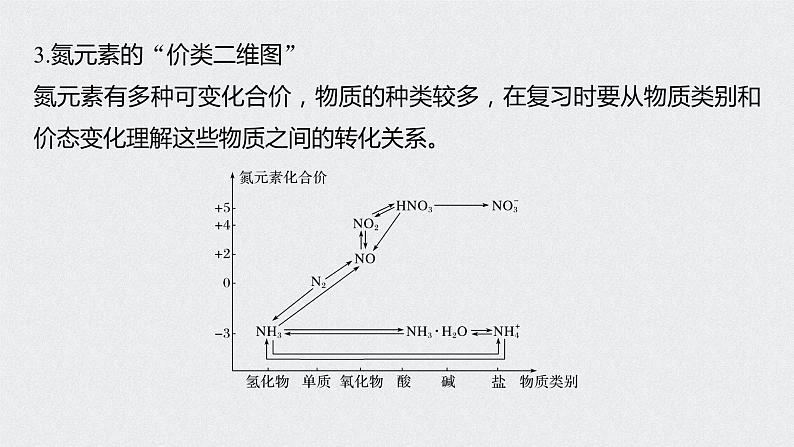
3.氮元素的“价类二维图”氮元素有多种可变化合价,物质的种类较多,在复习时要从物质类别和价态变化理解这些物质之间的转化关系。
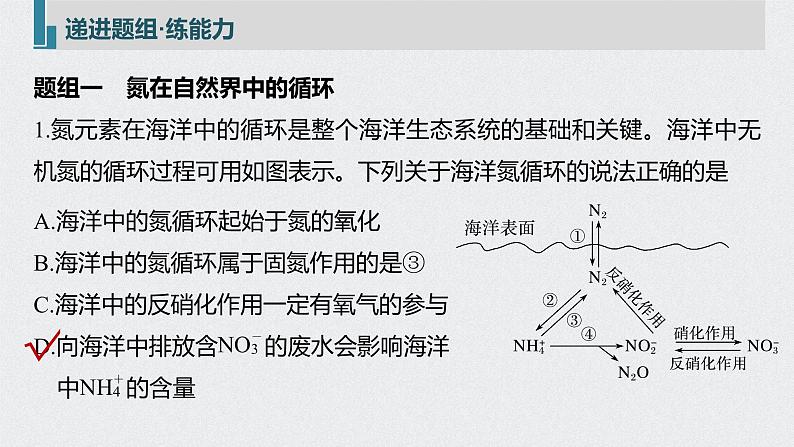
题组一 氮在自然界中的循环1.氮元素在海洋中的循环是整个海洋生态系统的基础和关键。海洋中无机氮的循环过程可用如图表示。下列关于海洋氮循环的说法正确的是
A.海洋中的氮循环起始于氮的氧化B.海洋中的氮循环属于固氮作用的是③C.海洋中的反硝化作用一定有氧气的参与D.向海洋中排放含 的废水会影响海洋 中 的含量
解析 A项,海洋中的氮循环起始于氮的还原,错误;B项,海洋中的氮循环属于固氮作用的是②,错误;
C项,反硝化作用是氮元素化合价降低的过程,反硝化细菌在氧气不足的条件下还原N,不一定有氧气参与,错误;D项,由氮的循环过程可知,硝酸根离子增多,反硝化作用增强,会进一步影响海洋中 的含量,正确。
2.(2020·河南联考)一定条件下,含氮元素的物质可发生如图所示的循环转化。
回答下列问题:(1)氮的原子结构示意图为_______。(2)图中属于“氮的固定”的是______(填字母,下同);转化过程中发生非氧化还原反应的是_____。
(3)若“反应h”是在NO2和H2O的作用下实现,则该反应中氧化产物与还原产物的物质的量之比为_____。
解析 反应h的化学方程式为3NO2+H2O===2HNO3+NO,HNO3是氧化产物,NO是还原产物,因此氧化产物和还原产物的物质的量之比为2∶1。
(4)若“反应i”是在酸性条件下由 与Zn的作用实现,则该反应的离子方程式为___________________________________________。
题组二 氮及其化合物转化关系的综合应用3.(2020·济宁模拟)依据右图中氮元素及其化合物的转化关系,判断下列说法不正确的是
A.X是N2O5B.可用排空气法收集NO气体C.工业上以NH3、空气、水为原料生产硝酸D.从原理上看,NH3可与NO2反应实现NH3→N2的转化
解析 NO遇空气中的氧气被氧化为NO2,不可用排空气法收集NO气体,故B错误。
4.(2020·哈尔滨三中高三开学考试)合成氨及其衍生工业是化工生产的重要门类,请结合图示判断下列说法正确的是
A.合成氨采用400~500 ℃是为了提高原料转化率和反应速率B.湿润的淀粉-KI试纸可以鉴别气体2和溴蒸气C.在饱和NaCl溶液中先通入过量CO2再通入过量NH3可得到固体1D.1 L气体1、2的混合气与1 L NH3在一定条件下转化为对环境无害的物 质,混合气中二者的体积比为1∶1
解析 由图可知:气体1为NO,气体2为NO2,NO2与水反应生成硝酸,固体1为NaHCO3,NaHCO3受热分解生成的固体2为Na2CO3;1 L NO、NO2的混合气体与1 L NH3在一定条件下转化为对环境无害的物质,反应方程式为2NH3+NO+NO2 2N2+3H2O,NO、NO2的体积之比等于化学计量数之比,为1∶1,故D正确。
5.如图是氮元素的几种价态与物质类别的对应关系,回答下列问题:
(1)写出N2的一种用途:________________________________________。(2)从N元素化合价分析,N2具有氧化性和还原性。各举一例说明(用化学方程式表示)氧化性:_________________________________________________。还原性:_______________________。
粮食(或合成氨、制硝酸等)
N2+3H2 2NH3(或
(3)HNO3与图中的物质C常用于检验Cl-的存在,则C的化学式为________。(4)实验室制取物质B的化学方程式为_________________________________________。(5)NO2与水反应生成物质A的化学方程式为_________________________。
Ca(OH)2+2NH4Cl CaCl2+2NH3↑
3NO2+H2O===2HNO3+NO
(6)浓硝酸与木炭在加热条件下反应的化学方程式为__________________________________________。
CO2↑+4NO2↑+2H2O
一、NOx与水、氧气反应的理解及有关计算1.关系式法(1)NO和O2的混合气体通入水中由2NO+O2===2NO2和3NO2+H2O===2HNO3+NO得总反应为4NO+3O2+2H2O=== 4HNO3。
(2)NO2和O2的混合气体通入水中由3NO2+H2O===2HNO3+NO和2NO+O2===2NO2得总反应为4NO2+O2+2H2O=== 4HNO3。
(3)NO、NO2和O2三种混合气体通入水中先按3NO2+H2O===2HNO3+NO计算出生成NO的体积,再加上原来混合气体中NO体积,再按(1)计算。
2.电子守恒法NOx转化为硝酸时失去电子,如果是NOx与O2的混合气体,则反应中O2得到的电子数与NOx失去的电子数相等。4NO2+O2和4NO+3O2从组成上均相当于2N2O5,都与N2O5+H2O===2HNO3等效;当NO、NO2、O2的混合气体溶于水时利用混合气体中N、O原子个数比进行分析判断。
二、金属与硝酸反应的计算1.金属与硝酸反应计算的思维流程
2.“四法”突破金属与硝酸的计算
题组一 NOx与H2O、O2反应的计算1.有一充有20 mL NO和NO2混合气体的试管,倒置于盛有水的水槽中,充分反应后,仍有12 mL 无色气体,则原混合气体中NO和NO2的体积之比为(气体体积均在相同状况下测得)A.2∶3 B.3∶2 C.1∶4 D.4∶1
解析 二氧化氮和水反应生成硝酸和一氧化氮,一氧化氮和水不反应,所以,剩余的气体为一氧化氮,设混合气体中二氧化氮的体积为V,则:3NO2+H2O===2HNO3+NO 气体体积减少3 1 2V 20 mL-12 mL=8 mL
所以V= =12 mL,即二氧化氮的体积为12 mL,则原混合气体中一氧化氮的体积为20 mL-12 mL=8 mL,则原混合气体中NO和NO2的体积之比为8 mL∶12 mL=2∶3。
2.(2020·贵阳模拟)同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是①NO和NO2,②NO2和O2,③NH3和N2。将3支试管均倒置于盛水的水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列的关系正确的是A.V1>V2>V3 B.V1>V3>V2C.V2>V3>V1 D.V3>V1>V2
解析 设各种气体的体积都为1。①根据3NO2+H2O===2HNO3+NO,即剩余NO的体积V1=1+ 。②根据4NO2+O2+2H2O===4HNO3,即剩余O2的体积V2=1- 。③剩余N2的体积V3=1,即B项符合题意。
3.将盛有12 mL NO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2 mL无色气体。(1)若剩余的气体是____,则NO2、O2的体积分别是____________。(2)若剩余的气体是____,则NO2、O2的体积分别是_______________。
10.8 mL、1.2 mL
解析 解题依据的化学方程式:4NO2+O2+2H2O===4HNO3;3NO2+H2O===2HNO3+NO。设O2的体积为x,剩余的气体有两种可能:(1)若剩余O2,则V剩=x- ×(12 mL-x)=2 mL,解得x=4 mL,则NO2体积是8 mL;(2)若剩余NO,则V剩= ×[(12 mL-x)-4x]=2 mL,解得x=1.2 mL,则NO2体积是10.8 mL。
题组二 金属与硝酸反应的计算4.(2020·湖北鄂东南市级示范高中学校联考)铜和镁的合金4.6 g完全溶于浓硝酸,若反应中硝酸被还原只产生4 480 mL的NO2气体和336 mL的N2O4气体(都已折算成标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为 g g g g
5.(2020·河南洛阳模拟)有稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的体积随铁粉质量增加的变化如图所示,且每一阶段只对应一个反应(已知硝酸只被还原为NO气体)。下列分析或结果错误的是
A.原混合酸中 的物质的量为0.1 mlB.OA段产生的是NO,AB段的反应为Fe +2Fe3+===3Fe2+,BC段产生H2C.第二份溶液中最终溶质为FeSO4D.H2SO4浓度为2.5 ml·L-1
解析 铁粉既能与硝酸反应也能与硫酸反应,题图中,OA段产生的是NO,反应为Fe++4H+===Fe3++NO↑+2H2O;AB段的反应为Fe+2Fe3+===3Fe2+;BC段产生的是H2,反应为Fe+2H+===Fe2++H2↑。根据OA段发生反应的离子方程式可知第二份溶液中 的物质的量为 =0.1 ml,则原混合酸中 的物质的量为0.2 ml。第二份溶液中最终溶质为FeSO4,此时参加反应的铁的质量是14.0 g,物质的量为0.25 ml,FeSO4中n(Fe2+)∶n( )=1∶1,故n(H2SO4)=n(Fe)=0.25 ml,原混合酸中H2SO4浓度为 =2.5 ml·L-1。综上所述,A项符合题意。
1.(2018·全国卷Ⅱ,8)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。下列叙述错误的是
A.雾和霾的分散剂相同B.雾霾中含有硝酸铵和硫酸铵C.NH3是形成无机颗粒物的催化剂D.雾霾的形成与过度施用氮肥有关
解析 NH3参与反应生成铵盐,是反应物,不是催化剂,C项错误;雾和霾的分散剂都是空气,A项正确;雾霾中的无机颗粒物含有硝酸铵和硫酸铵,B项正确;过度施用氮肥会增加大气中氨的含量,D项正确。
2.(2018·海南,2)某工业废气所含氮氧化物(NOx)的氮氧质量比约为7∶4,该NOx可表示为A.N2O B.NO C.N2O3 D.NO2
1.(2020·广州高三调研测试)下列关于自然界中氮循环的说法错误的是A.氮肥均含有B.雷电作用固氮中氮元素被氧化C.碳、氢、氧三种元素参与了自然界中氮循环D.合成氨工业的产品可用于侯氏制碱法制备纯碱
由硝酸盐制造蛋白质、动物摄食蛋白质、由动物排泄物及遗体得到氨或铵盐,这些过程中碳、氢、氧三种元素参与了自然界中氮循环,C项正确;
2.关于氮的变化关系图如图:
则下列说法不正确的是A.路线①②③是工业生产硝酸的主要途径B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径C.上述所有反应都是氧化还原反应D.上述反应中只有③属于氮的固定
解析 工业上生产硝酸的流程:氮气和氢气生成氨气,氨气与氧气反应:4NH3+5O2 4NO+6H2O(路线①),一氧化氮与氧气反应:2NO+O2===2NO2(路线②),二氧化氮被水吸收:3NO2+H2O===2HNO3+NO(路线③),路线①②③是工业生产硝酸的主要途径,故A正确;在放电条件下,氮气和氧气发生化合反应:N2+O2 2NO(路线Ⅰ);NO不稳定,易被氧气氧化为二氧化氮:2NO+O2===2NO2(路线Ⅱ),二氧化氮溶于水生成硝酸:3NO2+H2O===2HNO3+NO(路线Ⅲ),故B正确;
从氮的变化关系图可知:N从N2(0价)→NO(+2价)→NO2(+4价)→ HNO3(+5价),都是氧化还原反应,故C正确;上述反应中路线Ⅰ是空气中的氮气转变为含氮化合物,符合氮的固定的定义,属于氮的固定,路线②、③是含氮化合物转变为其他物质,是氮的化合物之间的转化,不是氮的固定,故D错误。
3.某无色透明的混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此混合气体通过品红溶液后,品红溶液褪色,向剩余气体中通入空气,很快变为红棕色。下列对于原混合气体成分的判断中正确的是A.肯定有SO2、O2和NOB.肯定没有Cl2、O2和NO2C.可能有Cl2和O2D.肯定只有NO
解析 无色气体,说明无Cl2、NO2;使品红褪色,说明有SO2;通入空气变红棕色,说明有NO,无O2。
4.(2020·福建三明高三期末)下图是某元素的价类二维图,其中X是一种强碱,A为正盐,通常条件下Z是无色液体,D的相对分子质量比E小16,各物质转化关系如图所示。下列说法正确的是
A.A是可与草木灰混合使用的肥料B.C可用排空气法收集C.F和B能发生复分解反应生成盐D.B在一定条件下可直接与Y反应生成D
解析 A为正盐,X是一种强碱,二者反应生成氢化物B,则A为铵盐、B为NH3,B连续与Y反应得到氧化物D与氧化物E,且E的相对分子质量比D大16,则Y为O2、C为N2、D为NO、E为NO2,
通常条件下Z是无色液体,E与Z反应得到含氧酸F,则Z为H2O、F为HNO3,F与强碱X发生酸碱中和反应得到G为硝酸盐。物质A为铵盐,草木灰的主要成分是K2CO3,水溶液呈碱性,二者混合会发生反应放出氨气,使肥效降低,A错误;
C是N2,氮气的密度与空气接近,不宜采取排空气法收集,B错误;B是NH3,F是HNO3,二者发生化合反应生成NH4NO3,C错误;B是NH3,Y为O2,NH3在催化剂存在并加热的条件下,与O2反应生成NO和H2O,D正确。
5.“封管试验”具有简易、方便、节约、绿色等优点。观察下列四个“封管试验”(夹持装置已略去),判断下列说法正确的是
A.加热时,a上部聚集了固体NH4Cl,说明NH4Cl的热稳定性比较好B.加热时,发现b中I2变为紫色蒸气,在上部又聚集为紫黑色的固体C.加热时,c中溶液红色变深,冷却后又变浅D.水浴时,d内气体颜色变浅,e内气体颜色加深
解析 A项,NH4Cl受热易分解,遇冷又生成NH4Cl;B项,I2易升华;C项,加热含NH3的酚酞溶液,NH3逸出,红色变浅;D项,NO2存在:2NO2(红棕色) N2O4(无色) ΔH<0,加热,上述平衡左移,d内颜色加深。
6.(2020·辽宁铁岭协作体联考)已知Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2 2CuO+4NO2↑+O2↑,将少量的Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,则下列说法正确的是A.NO2能支持燃烧B.NO2不能支持燃烧C.木条复燃是因为硝酸铜分解产生了氧气的缘故D.木条复燃是因为硝酸铜分解产生的CuO催化作用的结果
解析 氧气具有助燃性,纯氧气能使带火星的木条复燃,但空气中由于含有大量不能助燃的N2,而氧气量较少,所以空气不能使带火星的木条复燃,反应2Cu(NO3)2 2CuO+4NO2↑+O2↑中,产物中NO2、O2的体积比与空气中N2、O2体积比近似相同,即为4∶1,带火星的木条放入Cu(NO3)2受热分解得到的混合气体的试管中,木条复燃,说明NO2能支持燃烧,A项正确。
7.科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有 两种离子,当 遇到碱性溶液时,会生成N4分子。下列说法正确的是A.14N、N4与N2互为同位素B.N4H4(SO4)2的电离方程式为C.N4H4(SO4)2不能与草木灰、K3PO4等化肥混合施用D.N4H4(SO4)2中只含共价键,不含离子键
解析 同位素是指同种元素的不同原子的互称,N4与N2为两种单质,故A错误;N4H4(SO4)2的晶体中含有 ,可知该物质为离子化合物,完全电离,电离方程式为 ,故B错误;草木灰、K3PO4等化肥显碱性,根据题给信息 遇到碱性溶液时,会生成N4分子判断会使肥效降低,不能混用,故C正确;根据晶体中含有 两种离子可知该晶体中还含离子键,故D错误。
已知气体的沸点为NO2:21 ℃,NO:-152 ℃。下列说法错误的是A.用装置b代替装置a的好处是便于控制反应的发生与停止B.反应前应打开弹簧夹,先通入一段时间氮气,除去装置中的空气C.装置中冰水浴的作用是冷凝,使NO2液化D.装置中热水浴有利于促进NO2生成,便于检验是否有NO生成
8.亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用右图所示装置(夹持装置已省略)及药品探究亚硝酸钠与硫酸的反应及气体产物的成分。
解析 b代替a利于液体流下,不能控制反应的发生与停止。
9.将充有m mL NO和n mL NO2的量筒倒立于水槽中,然后通入m mL O2,若m
A.该过程中产生标准状况下的氢气4.48 LB.向c点处的反应液中加入稀盐酸后无明显现象C.图中a=1.5、b=1.5D.当加入铁粉n ml时(0.1
向硝酸中加入铁粉发生的反应为Fe+4HNO3===Fe(NO3)3+NO↑+2H2O,硝酸的物质的量为0.4 ml,则消耗铁的物质的量为0.1 ml,b=0.1,生成硝酸铁0.1 ml,随后发生反应2Fe(NO3)3+Fe===3Fe(NO3)2,生成硝酸亚铁为0.15 ml,则a=0.15,C错误;
根据上述分析,当加入铁粉n ml时(0.1
A.一般来说,硝酸与铁反应的还原产 物不是单一的B.用一定量的铁粉与大量的9.75 ml·L-1 HNO3溶液反应得到标准状况下 气体2.24 L,则参加反应的硝酸的物质的量为0.1 mlC.硝酸的浓度越大,其还原产物中价态越高的成分越多D.当硝酸浓度为9.75 ml·L-1时还原产物是NO、NO2、N2O,且其物质 的量之比为5∶3∶1
解析 根据图像可知硝酸的还原产物有多种,因此一般来说,硝酸与铁反应的还原产物不是单一的,A正确;参加反应的硝酸包括被还原的,以及没有被还原的(转化为硝酸铁),因此参加反应的硝酸的物质的量大于0.1 ml,B错误;
根据图像可知随着硝酸浓度的升高,NO2的含量增大,这说明硝酸的浓度越大,其还原产物中价态越高的成分越多,C正确;根据图像可知当硝酸浓度为9.75 ml·L-1时还原产物是NO、NO2、N2O,且其物质的量之比为10∶6∶2=5∶3∶1,D正确。
12.某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程。NH3的转化过程如图所示。
甲、乙两同学分别按右图所示装置进行实验。用于A、B装置中的可选药品:浓氨水、30%H2O2溶液、蒸馏水、NaOH固体、MnO2。
(1)装置A的圆底烧瓶中发生反应的化学方程式为______________________。装置E有多种作用,下列关于装置E的作用或其中所盛液体的说法中,不正确的是____(填字母)。a.使氨气和氧气充分混合b.控制通入氨气和氧气的体积比c.平衡装置内的压强d.锥形瓶内液体是饱和食盐水
解析 由题给条件和实验装置图可知,装置A是制备氧气的装置,装置B是制备氨气的装置,装置A的圆底烧瓶中发生反应的化学方程式为2H2O22H2O+O2↑;装置E可以使氨气和氧气充分混合,观察装置E中气泡的速率可以控制通入氨气和氧气的体积比,装置E还可以平衡装置内的压强。因为氨气极易溶于水,所以锥形瓶中液体不能是饱和食盐水,选d。
(2)甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,成功模拟了反应过程,并将实验中产生的气体持续通入装置H一段时间后,H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为__________________________________________,若制得的氨气仅按Ⅰ→Ⅱ→Ⅲ的顺序完全转化为硝酸,欲使装置H中所得溶液为纯净的CuSO4溶液(忽略Cu2+的水解),理论上所需氨气在标准状况下的体积为______ L(假设硝酸与铜反应产生的还原产物全部排出反应装置)。
8H++ ===3Cu2++2NO↑+4H2O
解析 铜与稀硫酸不反应,溶液呈蓝色,说明铜与硝酸发生了反应:3Cu+8H++ ===3Cu2++2NO↑+4H2O。n(H2SO4)=0.15 L×1 ml·L-1=0.15 ml,n(H+)=0.15 ml×2=0.3 ml,n( )=0.15 ml,根据上述反应和题目要求,可知 ,故需要HNO3的物质的量为0.1 ml,根据NH3~NO~NO2~HNO3,可知需要NH3的物质的量为0.1 ml,在标准状况下的体积为2.24 L。
(3)乙同学为模拟过程Ⅳ的反应,在甲同学操作的基础上对该装置进行了下列各项中的一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是___(填字母)。a.关闭K3并熄灭酒精灯b.关闭K4并熄灭酒精灯c.关闭K3、K4并熄灭酒精灯
解析 过程Ⅳ的反应是NH3与HNO3的反应,则应停止供O2,关闭K3,熄灭酒精灯,使氨气进入G发生反应,选a。
(4)丙同学认为该系统实验装置存在一处明显的设计缺陷,你认为该设计缺陷是__________________。
解析 整套装置没有尾气处理装置。
13.(2020·烟台模拟)某课题组同学查阅文献知,3(NH4)2SO4(s) 4NH3↑+3SO2↑+N2↑+6H2O。他们拟选择下列装置检验硫酸铵分解的产物(各装置中药品足量):
回答下列问题:(1)仪器A的名称是____________。
解析 硫酸铵分解的产物有NH3和SO2,NH3和SO2在水溶液中会发生反应。检验NH3之前必须除去SO2,检验SO2之前必须除去NH3。仪器A为球形干燥管。
(2)甲组同学设计方案:C→G→B→D→E。①能证明有水生成的实验现象是____________________;B装置的作用是_________。
解析 白色的无水硫酸铜遇水变为蓝色;浓硫酸只吸收NH3,不吸收SO2。
解析 亚硫酸钡能溶于盐酸,而硫酸钡不溶于盐酸,故取少量白色沉淀于洁净的试管中,向其中滴加足量盐酸,若白色沉淀溶解,则是BaSO3,否则是BaSO4。
②实验中,观察到D装置产生白色沉淀。实验完毕后,过滤D装置中混合物得白色沉淀。欲验证白色沉淀是BaSO4还是BaSO3,请你设计简单的实验方案:__________________________________________________________________________________________。
取少量白色沉淀于洁净的试管中,向其中滴加足量盐酸,
若白色沉淀溶解,则是BaSO3,否则是BaSO4
③D装置中发生的反应与硝酸钡的量有关,若硝酸钡足量,则D中反应的离子方程式为________________________________________________。
解析 若硝酸钡过量,SO2完全转化成BaSO4沉淀,化学方程式为3Ba(NO3)2+3SO2+2H2O===3BaSO4↓+2NO+4HNO3;若SO2过量,则硝酸钡完全反应,化学方程式为Ba(NO3)2+3SO2+2H2O===BaSO4↓+2NO+2H2SO4。
④该实验方案能证明硫酸铵的分解产物中有___________(填化学式)。
解析 G装置可检验H2O,D装置可检验SO2(同时生成NO),E装置可收集N2或NO或NO和N2。故该方案只能证明硫酸铵分解的产物中是否有H2O和SO2,不能证明是否有NH3和N2。
新高考化学一轮复习精品课件 第5章 第27讲 氮及其化合物的转化关系 (含解析): 这是一份新高考化学一轮复习精品课件 第5章 第27讲 氮及其化合物的转化关系 (含解析),共60页。PPT课件主要包含了必备知识,关键能力,缺少尾气处理装置,观察气泡的速,真题演练明确考向,A或B,dcfei,红棕色气体颜色,慢慢变浅,NO2+8NH3等内容,欢迎下载使用。
第25讲 氮及其化合物的转化关系-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第25讲 氮及其化合物的转化关系-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共35页。PPT课件主要包含了复习目标,必备知识,专项突破,缺少尾气处理装置,观察气泡的速,真题演练,A或B,dcfei,红棕色气体颜色,慢慢变浅等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第4章 第24讲 氮及其化合物的转化关系: 这是一份2024年高考化学一轮复习课件(鲁科版)第4章 第24讲 氮及其化合物的转化关系,文件包含第4章第24讲氮及其化合物的转化关系pptx、第4章第24练氮及其化合物的转化关系docx、第4章第24讲氮及其化合物的转化关系docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。












