




2022高三一轮复习化学 第四章 第15讲 氮及其化合物课件
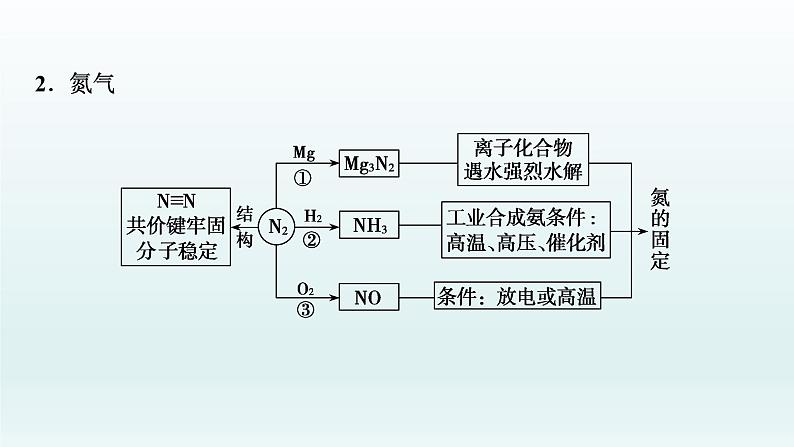
展开考点 1 氮气及氮氧化物1.氮元素的存在与氮的固定
写出有关化学方程式:①_____________________;②_________________________;③_____________________。
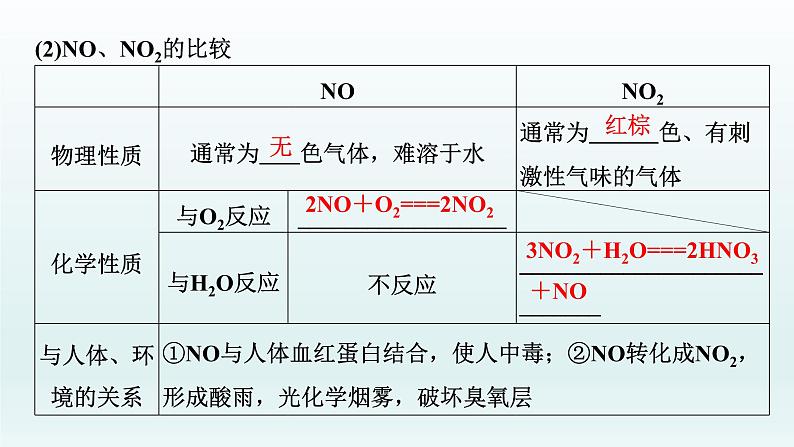
3.氮的氧化物(1)氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,如N2O、______、N2O3、NO2(或______)、N2O5,其中属于酸性氧化物的是N2O3、N2O5。
(2)NO、NO2的比较
2NO+O2===2NO2
3NO2+H2O===2HNO3
1.依据教材必修1 P99“思考与交流”,请用图示表示工业用NH3为原料生产HNO3的过程,并写出每步反应的化学方程式。____________________________________________________________________________________________________________________________
2.依据教材必修1 P92“科学视野”,回答下列问题:(1)火箭的燃料为________,其结构简式为________,其中C、N元素的化合价分别为________。(2)火箭燃料燃烧的化学方程式为____________________________________________________________________________________________。
(1)豆科植物通过根瘤菌吸收空气中的氮属于氮的固定,是化学变化。( )(2)在实验室里,NO可用排空气法收集。( )(3)通过灼热的镁粉,可除N2中的少量氧气。( )(4)N2与O2在放电条件下直接化合生成NO2。( )(5)将1 ml NO与0.5 ml O2混合后分子数为NA。( )(6)NO2与H2O反应中氧化剂与还原剂的质量比为1∶2。( )
1.学科思想:“加合式”法处理氮氧化物溶于水的计算无论是单一气体(NO2),还是NO、NO2、O2中的两者或三者的混合气体,反应的实质是3NO2+H2O===2HNO3+NO,2NO+O2===2NO2,故若有气体剩余只能是NO或O2,不可能是NO2。(1)若NO和O2通入水中,总关系式为4NO+3O2+2H2O===4HNO3。(2)若NO2和O2通入水中,总关系式为4NO2+O2+2H2O===4HNO3。
2.方法归纳:常见的NOx尾气处理方法(1)催化转化法在催化剂、加热条件下,氨可将氮氧化物转化为无毒气体(N2),或NOx与CO在一定温度下催化转化为无毒气体(N2和CO2)。一般适用于汽车尾气的处理。(2)碱液吸收法2NO2+2NaOH===NaNO3+NaNO2+H2O;NO2+NO+2NaOH===2NaNO2+H2O。NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是n(NO2)≥n(NO)。一般适合工业尾气中NOx的处理。
题组一 自然界中氮的循环1.研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图所示)。
分析图示回答相关问题:(1)雾霾中所含氮成分为______________________。(2)为减少雾霾污染,可以采取的措施为________(填字母)。a.禁止秸秆焚烧b.控制SO2、NOx的排放c.减少农业生产中的铵态氮肥的施用(3)SO2、NOx同时排放会加快、加重酸雨污染,原因是__________________________________________________________(用方程式表示)。
答案:(1)NH4NO3、(NH4)2SO4 (2)abc (3)SO2+NO2===SO3+NO、2NO+O2===2NO2、SO3+H2O===H2SO4、3NO2+H2O===2HNO3+NO
题组二 氮氧化物的污染及其防治2.汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一。在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2===2NO+2O,②2NO+O2===2NO2,③O+O2===O3。问题:(1)NO2在反应过程中的作用________________________。(2)生成O3的总反应方程式为______________________________。
解析:(1)NH3和NO2反应生成N2和H2O,氧化产物与还原产物均为N2,其质量之比是4∶3。
(2)工业尾气中氮的氧化物常采用碱液吸收法处理。①NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,写出该反应的化学方程式:_________________________________________________________________________________________________。②NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式是______________。
解析:(2)①生成两种钠盐,必须是NO2的歧化反应,依据量的关系可知两种盐分别为NaNO3和NaNO2。②NO中氮的化合价为+2价,NO2中氮的化合价为+4价,二者1∶1混合时与NaOH反应生成一种钠盐,依据电子守恒可知,钠盐中氮的化合价为+3,即为NaNO2。答案:(2)①2NO2+2NaOH===NaNO3+NaNO2+H2O ②NaNO2
题组三 氮氧化物溶于水的计算4.在一定条件下,将NO2和O2的混合气体12 mL通入足量水中,充分反应后剩余2 mL气体(同温同压下),则原混合气体中氧气的体积为( )①1.2 mL ②2.4 mL ③3 mL ④4 mLA.①② B.②③C.③④D.①④
考点 2 典型的氧化性酸——硝酸1.物理性质
2.化学性质(1)不稳定性化学方程式:_________________________________。
(2)强氧化性硝酸无论浓、稀都有强氧化性,而且浓度越大,氧化性越强。
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
Fe2+、H2S、SO2、Na2SO3、HI
1.规律总结:硝酸与金属反应规律的归纳与整合(1)金属与硝酸反应一般不生成H2。还原产物一般为HNO3(浓)→NO2,HNO3(稀)→NO,如果硝酸的浓度很稀,其还原产物也可能是N2O、N2或NH4NO3。(2)铜与浓HNO3反应:若Cu过量,开始时硝酸的还原产物为NO2,随着反应的进行,浓HNO3变稀,硝酸的还原产物为NO,最终应得到NO2和NO的混合气体。
2.思维建模:金属与硝酸反应的思维模型
题组一 硝酸的性质1.下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
A. 由①中的红棕色气体,推断产生的气体一定是混合气体B .红棕色气体不能表明②中木炭与浓硝酸发生了反应C .由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物D . ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应解析:本题考查硝酸的氧化性、不稳定性、挥发性等性质。③中的CO2可能是空气中的氧气与木炭反应的产物。答案:D
2.(1)写出下列事实对应硝酸的性质①浓硝酸使紫色石蕊溶液先变红后褪色__________________________。②不能用稀硝酸与锌反应制氢气________________________________。③用棕色瓶盛装浓硝酸________________________________________。④能使滴有酚酞的氢氧化钠溶液的红色褪去______________________。答案:(1)①酸性、强氧化性 ②强氧化性 ③不稳定性 ④酸性
(2)木炭屑与浓HNO3共热,产生的气体X等分为①和②两份,将两份气体分别按图进行实验: ①、②中澄清石灰水中的现象分别为①________、②________。答案:(2)①变浑浊 ②无现象
题组二 铜与硝酸的反应3.将1.92 g铜粉投入到一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L(标准状况),则反应消耗HNO3的物质的量为( )A.0.8 ml B.0.6 mlC.0.11 mlD.无法计算
4.用如图所示装置进行实验: 实验发现开始时烧杯中导管内液面上升,一段时间后导管口有气泡冒出。(1)如图装置设计与将铜粉直接加入硝酸中相比较,优点为_________。(2)开始时烧杯中导管内液面上升的原因为(用化学方程式表示)_____。答案:(1)通过铜丝的抽拉控制反应 (2)4NO+3O2+2H2O===4HNO3
5.在浓硝酸中放入Cu片:(1)反应开始时的化学方程式为____________________________________________________________________________________________,实验现象为_________________________________________________。(2)若Cu片有剩余,则反应将要结束时的化学方程式为______________________________________________________________________。(3)待反应停止后,再加入少量的稀硫酸,这时Cu片上又有气泡产生,原因是____________________________________________________。
答案:(1)Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O 溶液逐渐变蓝色,有红棕色气体逸出(2)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O(3)加入稀硫酸后,氢离子与原溶液中硝酸根离子构成强氧化性酸,又能与过量的铜反应
题组三 铁与硝酸的反应6.将某稀硫酸和稀硝酸的混合溶液200 mL平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。
下列分析或结果不正确的是( )A.混合酸中HNO3物质的量浓度为2 ml·L-1B.OA段产生的是NO,AB段的反应为Fe+2Fe3+===3Fe2+,BC段产生氢气C.原混合酸中H2SO4物质的量为0.4 mlD.第二份溶液中最终溶质为FeSO4
7.甲、乙两同学用如图所示装置进行实验,探究硝酸与铁反应的产物。 文献记载:ⅰ.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、-3价等氮的化合物。ⅱ.FeSO4+NOFe(NO)SO4(棕色)(ΔH<0)。ⅲ.NO2和NO都能被酸性KMnO4氧化吸收。
甲的实验操作和现象记录如下:
请回答下列问题:(1)滴入浓硝酸加热前没有明显现象的原因是__________________________________________________________________________________。(2)检测是否生成-3价氮的化合物,应进行的实验操作是_______________________________________________________________________。(3)甲取少量B中溶液,加热,实验现象是_____________________________________________________________________________________。请用平衡移动原理解释原因: ________________________________。甲依据该现象得出的结论是A中有NO生成。
(4)乙认为甲得出A中有NO生成的证据不足。为获取充足的证据,乙仍采用该装置和操作进行对照实验,乙作出的改变是______________,证明有NO生成的实验现象是_________________________________________________________________________________________________。答案:(4)浓硝酸换成稀硝酸 A中没有红棕色气体生成,B中溶液变为棕色
考点 3 氨 铵盐1.氨的物理性质
1.结合教材必修1 P99,归纳氨的重要用途,并对液氨作制冷剂做出解释。____________________________________________________________________________________________________________________________提示:制硝酸、铵盐、纯碱、尿素、制冷剂等;氨易液化,液氨汽化时吸收大量的热,使周围温度急剧降低。
2.将氨与氯气混合也会产生白烟,用化学方程式解释产生白烟的过程。____________________________________________________________________________________________________________________________提示:2NH3+3Cl2===N2+6HCl,NH3+HCl===NH4Cl(或8NH3+3Cl2===N2+6NH4Cl)
思维拓展:实验室制取氨气的其他方法
题组一 氨气和铵盐的性质及应用1.NH3是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是( )A.NH4Cl和NaHCO3都是常用的化肥B.NH4Cl、HNO3和Na2CO3受热时都易分解C.NH3和NO2在一定条件下可发生氧化还原反应D.图中所涉及的盐类物质均可以水解
解析:A项,NaHCO3不是化肥;B项,Na2CO3受热不易分解;D项,NaCl不水解。
2.如图所示,向培养皿中NaOH固体上滴少量浓氯化铵溶液,迅速盖上另一个培养皿,观察现象。
答案:(1)NH3+HCl===NH4Cl(2)(NH4)2SO4(或NH4HSO4)(3)4Fe(OH)2+O2+2H2O===4Fe(OH)3
题组二 氨气的实验室制法3.资料显示:一定条件下NH3能还原CuO。为了证明资料的真实性,利用下列装置(含药品)进行实验,其中错误的是( )
解析:氯化铵受热分解生成氨气和氯化氢,在试管口附近氨气和氯化氢遇冷又生成了白色固体氯化铵,故不能用于制备氨气,A项错误;可以在硬质玻璃管中进行氨还原氧化铜的反应,B项正确;碱石灰可以干燥氨气,C项正确;氨与稀硫酸反应,用该装置吸收尾气中的氨可以防止倒吸,D项正确。
4.某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究。
回答下列问题:(1)若用装置①制取NH3,其反应的化学方程式为__________________;若要测定生成的NH3的体积,则必须选择的装置是________(填装置序号),装置中所盛试剂应具有的性质是___________________________。(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是________,分液漏斗中装的试剂是_______,收集装置应选择_______(填装置序号)。
解析:(1)装置①适用于固固加热制取气体,制取NH3时试剂是NH4Cl和Ca(OH)2。若测定NH3的体积,必须用排液体法,而NH3极易溶于水,故不能用排水法,所用的液体必须不与NH3反应,也不溶解NH3才行。(2)装置②是固液反应,不需要加热的装置,制取NH3时,可用浓氨水和碱石灰作用。
喷泉实验及拓展应用1.喷泉实验的原理使烧瓶内外在短时间内产生较大的压强差,利用大气压将烧瓶下面烧杯中的液体压入烧瓶内,在尖嘴导管口形成喷泉。
2.形成喷泉的类型下面是几种常见的能形成喷泉的气体和液体。
3.喷泉实验的发散装置及操作方法喷泉实验是中学化学的重要实验,其本质是形成压强差而引发液体上喷,以教材中的装置(发散源)可设计如图所示的多种不同的装置和采用不同的操作(如使气体溶于水、热敷或冷敷、生成气体等)来形成喷泉。
装置(Ⅰ):改变了胶头滴管的位置,胶头滴管挤入少量水于试剂瓶中,即可使少量溶液沿导管进入烧瓶中,导致大量的NH3溶解,烧瓶内形成负压而产生喷泉。装置(Ⅱ):省去了胶头滴管,用手(或热毛巾等)捂热烧瓶,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即产生喷泉(或用浸冰水的毛巾“冷敷”烧瓶,使水进入烧瓶中,瓶内氨气溶于水)。装置(Ⅲ):在水槽中加入能使水温升高的物质致使锥形瓶内酒精因升温而挥发,锥形瓶内气体压强增大而产生喷泉。
装置(Ⅳ):向导管中通入一定量的H2S和SO2,现象为有淡黄色粉末状物质生成,瓶内壁附有水珠,NaOH溶液上喷形成喷泉。装置(Ⅴ):打开①处的止水夹并向烧瓶中缓慢通入等体积的HCl气体后关闭该止水夹,等充分反应后再打开②处的止水夹,观察到先有白烟产生,后产生喷泉。装置(Ⅵ):挤压胶头滴管,然后打开导管上部的两个活塞,则在右面烧瓶出现喷烟现象,再打开导管下部活塞,则可产生双喷泉。
[考能突破练]1. 如图所示装置中,干燥烧瓶内盛有某种气体,烧杯和胶头滴管内盛放某种溶液。挤压胶头滴管,然后打开止水夹,下列与实验事实不相符的是( )A.Cl2(饱和食盐水),无色喷泉B.NH3(H2O含石蕊),蓝色喷泉C.HCl(H2O含石蕊),红色喷泉D.SO2(NaOH溶液),无色喷泉
解析:因NaCl溶液抑制Cl2的溶解,则挤压胶头滴管,气压变化不明显,则不会形成喷泉,故A错误。
2.如图是课外活动小组的同学设计的4个喷泉实验方案,下列有关操作不可能引发喷泉的是( )
A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹D.在装置④的水槽中慢慢加入足量浓硫酸并打开止水夹解析:H2难溶于NaOH溶液,不能使烧瓶内外形成较大压强差,故不能引发喷泉。答案:B
3.(1)图中胶头滴管中的水挤入烧瓶后,观察到的现象是__________。解析:(1)将胶头滴管中的水挤入圆底烧瓶后,由于NH3溶于水使瓶中的气压减小,气球的体积逐渐变大。答案:(1)气球逐渐变大
(2)按如图装置进行NH3性质实验。 ①先打开旋塞1,B瓶中的现象是_________________________________________________________,原因是__________________________________________________________________。稳定后,关闭旋塞1。②再打开旋塞2,B瓶中的现象是_______________________________。
解析:(2)A瓶的压强大于B瓶的,因此A瓶中的氯化氢进入B瓶中,与氨气反应生成氯化铵,可以看到B瓶中有白烟生成。由于氯化氢和氨气反应导致B瓶中的压强降低,且B瓶中的氯化氢相对过量,因此当打开旋塞2时,石蕊水溶液会被倒吸入B瓶中,遇氯化氢溶液变红色。答案:(2)①有白烟生成 A瓶中的氯化氢移动到B瓶中,与B瓶中的氨气反应生成氯化铵,能看到白烟 ②液体进入B瓶中,溶液的颜色变红
4.如图为化学教学中所用的喷泉实验装置。某同学用烧瓶中盛不同成分的气体进行喷泉实验,请帮助分析实验后烧瓶中所得溶液的浓度(假设是在标准状况下完成实验,且溶质不扩散)。(1)若用HCl气体,则c(HCl)=____________。(2)若用NO2气体,则c(HNO3)=____________。(3)若用n(NO2)∶n(O2)=4∶1的混合气体,则c(HNO3)=___________。
环境保护与绿色化学1.常见的大气污染物及其危害
2.环境保护(1)空气质量日报:主要包括“空气污染指数”“空气质量级别”“首要污染物”。(2)三废污染:是指废水、废气、废渣。(3)环保措施:①工业废气携带颗粒物的回收利用。②工业、生活污水经处理达标后排放,限制使用含磷洗涤剂。③回收、限制难降解塑料,研制可降解塑料。
3.绿色化学(1)核心:利用化学原理从源头上减少或消除工业生产对环境的污染。(2)最高目标:原子利用率为100%,即反应物中的原子全部转化为期望的最终产品。
[考能突破练]题组一 化学与环境1.化学与环境密切相关,下列有关说法正确的是( )A.CO2属于大气污染物B.酸雨是pH小于7的雨水C.CO2、NO2或SO2都会导致酸雨的形成D.大气中CO2含量的增加会导致温室效应加剧
解析:SO2及氮的氧化物是导致酸雨形成的主要物质,而CO2是造成温室效应的主要物质,C错误;CO2无毒,不属于大气污染物;酸雨是pH小于5.6的降水。
2.PM2.5是指大气中直径小于或等于2.5×10-6 m的颗粒物,它主要来自化石燃料的燃烧(如机动车尾气、燃煤等)。下列有关说法正确的是( )A.PM2.5又称可入肺颗粒物,对人体健康无害B.PM2.5在空气中一定能产生丁达尔效应C.开发利用新能源,实施“低碳经济”,可减少PM2.5的产生D.PM2.5中含有的铅、铬、砷等元素均为主族元素
解析:PM2.5粒子半径小,易附带有毒、有害物质,且在大气中停留时间长,因而对人体健康有害,A项错误;PM2.5是指大气中直径小于或等于2.5微米的颗粒物,颗粒物直径不一定在胶体粒子直径(1~100 nm)的范围内,因而在空气中不一定能产生丁达尔效应,B项错误;铅、砷等元素为主族元素,铬为副族元素,D项错误。
题组二 绿色化学——高考命题新宠儿3.(融合可持续发展)化学在资源利用、环境保护等与社会可持续发展密切相关的领域发挥着积极作用。下列做法与社会可持续发展理念相违背的是 ( )A.改进汽车尾气净化技术,减少大气污染物的排放B.开发利用可再生能源,减少化石燃料的使用C.研发可降解高分子材料,减少“白色污染”D.过度开采矿物资源,促进地方经济发展
解析:改进汽车尾气净化技术,减少大气污染物的排放,A项正确;开发利用太阳能、风能、潮汐能、地热能等可再生能源,可以减轻温室效应的压力,符合绿色化学理念,B项正确;“白色污染”在土壤和水体中富集可长期影响农作物的生长、海洋渔业等,研发可降解高分子材料,给塑料工业带来可持续发展的机遇,C项正确;过度开采矿物资源,不利于地方经济发展的可持续发展,甚至导致资源浪费,环境污染,D项不正确。
4.(融合实验细节)下列符合化学实验“绿色化学”的有( )①在萃取操作的演示实验中,将CCl4萃取溴水改为CCl4萃取碘水 ②在铜与浓硫酸反应的实验中,将铜片改为可调节高度的铜丝 ③将实验室的废酸液与废碱液中和后再排放A.①② B.①③ C.②③ D.①②③
解析:因为溴易挥发,所以在萃取操作的演示实验中,可将CCl4萃取溴水改为CCl4萃取碘水;在Cu与浓硫酸反应的实验中为避免生成过量的SO2污染环境,可将铜片改为可调节高度的铜丝;将实验室的废酸液与废碱液中和后再排放,可减少水体污染。
5.(融合反应类型)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率100%,不产生其他有毒物质,预防污染即防患于未然,从根本上消除污染。下列反应类型能体现“原子经济性”原则的是 ( )①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥加聚反应A.①②⑤ B.②⑤⑥ C.只有⑤⑥ D.只有④
解析:高效的绿色有机合成反应应最大限度地利用原料分子的每一个原子,使之结合到目标分子中,如完全的加成反应、加聚反应、化合反应:A+B===C,达到零排放。
解析:A方案虽然步骤少,但反应过程中会产生大量氮氧化物,污染空气,另外消耗原料也多,不符合“绿色化学”的要求;B方案步骤烦琐,所用原料种类多,不符合“绿色化学”的要求;C方案步骤较少,节约原料,无污染,符合“绿色化学”的要求;D方案所用原料较多,在第一步还会产生大量的SO2气体,污染空气,又浪费原料,不符合“绿色化学”的要求。
解析:根据绿色化学的含义,在生成的产品CH2==C(CH3)COOCH3与原料之间元素种类和原子数目都完全相同,即原子守恒。将生成物中各个原子个数减去反应物各个原子差值为C2H4O2,对照答案,反应物中原子数之和为C2H4O2的只有B项。
8.(融合生产工艺)某研究小组采用如图所示电解法处理石油炼制过程中产生的大量H2S废气的工艺流程。该方法对H2S的吸收率达99%以上,并可制取H2和S。下列说法正确的是 ( )A.吸收H2S的离子方程式为Fe3++H2S===Fe2++S↓+2H+B.电解过程中的阳极反应主要为2Cl--2e-===Cl2↑C.该工艺流程体现了绿色化学思想D.实验室可用点燃充分燃烧的方法消除H2S对环境的污染
解析:A项,电子不守恒;B项,由循环箭头可知,阳极电极反应为Fe2+-e-===Fe3+;D项,H2S完全燃烧的产物SO2仍是大气污染物。
1.把握两种大气污染物SO2导致酸雨;NOx导致酸雨或光化学烟雾。2.熟记氨的三种性质氨极易溶于水,氨水的碱性和氨的还原性。3.把握NH3三种检验方法湿润的红色石蕊试纸变蓝、蘸有浓盐酸的玻璃棒靠近试管口冒白烟、蘸有酚酞的玻璃棒变红色。4.辨析铵盐两个“特例”盐类不一定含有金属离子,如铵盐;铵盐受热都易分解,但不一定产生氨气。
7.熟知氮及其化合物之间的转化关系
1.(2020·高考江苏卷)打赢蓝天保卫战,提高空气质量。下列物质不属于空气污染物的是( )A.PM2.5 B.O2 C.SO2 D.NO解析:空气污染物主要有一氧化碳(CO)、氮氧化物(NOx)、硫氧化物和可吸入颗粒物等。氧气是空气的主要成分之一,不属于空气污染物。
2.(2018·高考海南卷)某工业废气所含氮氧化物(NOx)的氮氧质量比约为7∶4,该NOx可表示为( )A.N2O B.NO C.N2O3 D.NO2
(1)装置1用来制备二氧化碳气体:将块状石灰石放置在试管中的带孔塑料板上,漏斗中所加试剂为________________________________;装置2中所加试剂为________。(2)装置4中试剂为固体NH4Cl和Ca(OH)2,发生反应的化学方程式为_______________,试管口不能向上倾斜的原因是_________________。装置3中试剂为KOH,其作用为_____________________________________________________________________________________________。(3)反应时三颈烧瓶需用冷水浴冷却,其目的是________________________________________________________________________________。
第15讲 氮及其化合物(二)-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第15讲 氮及其化合物(二)-备战2024年高考化学一轮复习精品课件(全国通用),共17页。PPT课件主要包含了考点1氨铵盐,强烈刺激性,氨的化学性质,2化学性质,1反应原理,2发生装置类型,3干燥方法,CaO和NaOH,氨的实验室制法,4收集方法等内容,欢迎下载使用。
第15讲 氮及其化合物(二)-备战2023年高考化学一轮复习全考点精选课件(全国通用): 这是一份第15讲 氮及其化合物(二)-备战2023年高考化学一轮复习全考点精选课件(全国通用),共18页。PPT课件主要包含了考点1氨铵盐,强烈刺激性,氨的化学性质,2化学性质,1反应原理,2发生装置类型,3干燥方法,CaO和NaOH,氨的实验室制法,4收集方法等内容,欢迎下载使用。
高考化学一轮复习第4章非金属及其重要化合物第3讲氮及其重要化合物课件: 这是一份高考化学一轮复习第4章非金属及其重要化合物第3讲氮及其重要化合物课件,共60页。PPT课件主要包含了N2O3,N2O5,刺激性,有白烟生成,浓硝酸,向下排空气,+NO↑+2H2O等内容,欢迎下载使用。












