




2022高三一轮复习化学 第十二章 第41讲 晶体结构与性质课件
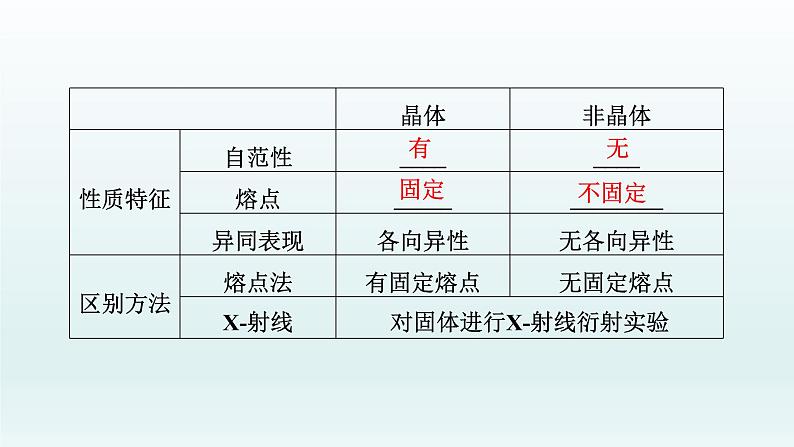
展开考点 1 晶体的常识和常见四种晶体比较一、晶体1.晶体与非晶体
2.获得晶体的途径(1)熔融态物质凝固;(2)气态物质冷却不经液态直接凝固(凝华);(3)溶质从溶液中析出。
3.晶胞(1)晶胞:晶胞是描述晶体结构的基本单元。(2)晶体中晶胞的排列——无隙并置①无隙:相邻晶胞之间没有__________。②并置:所有晶胞_____排列、_____相同。
4.离子晶体的晶格能(1)定义气态离子形成1 ml离子晶体释放的能量,通常取正值,单位:__________。(2)影响因素①离子所带电荷数:离子所带电荷数越多,晶格能越____。②离子的半径:离子的半径越____,晶格能越大。(3)与离子晶体性质的关系晶格能越大,形成的离子晶体越_____,且熔点越高,硬度越____。
1.比较下列晶格能大小(1)NaCl________KCl;(2)CaF2________MgO;(3)Na2S________Na2O;(4)CaO________KCl。提示:(1)> (2)< (3)< (4)>
2.在下列物质中:NaCl NaOH Na2S H2O2 Na2S2 (NH4)2S CO2 CCl4 C2H2 SiO2 SiC 晶体硅 金刚石 晶体氩(1)其中只含有离子键的离子晶体是__________________________。(2)其中既含有离子键又含有极性共价键的离子晶体是_____________。(3)其中既含有离子键又含有极性共价键和配位键的离子晶体是________。(4)其中既含有离子键又含有非极性共价键的离子晶体是________。答案:(1)NaCl、Na2S (2)NaOH、(NH4)2S (3)(NH4)2S (4)Na2S2
(5)其中含有极性共价键的非极性分子是___________________。(6)其中含有极性共价键和非极性共价键的非极性分子是________。(7)其中含有极性共价键和非极性共价键的极性分子是________。(8)其中含有极性共价键的原子晶体是________。(9)不含共价键的分子晶体是________,只含非极性键的原子晶体是________。答案:(5)CO2、CCl4、C2H2 (6)C2H2 (7)H2O2 (8)SiO2、SiC (9)晶体氩 晶体硅、金刚石
(1)晶体的熔点一定比非晶体的熔点高。( )(2)具有规则几何外形的固体一定是晶体。( )(3)缺角的NaCl晶体在饱和NaCl溶液中会慢慢变为完美的立方体块。( )(4)通过X射线衍射实验的方法可以区分晶体和非晶体。( )(5)粉末状的物质不是晶体,具有各向异性的固体一定是晶体。( )(6)某晶体的熔点为112.8 ℃,溶于CS2、CCl4等溶剂,可推出该晶体可能为分子晶体。( )(7)在晶体中只要有阴离子就一定有阳离子。( )
1.归纳整合:判断晶体类型的方法(1)主要根据各类晶体的特征性质判断如低熔、沸点的化合物形成分子晶体;熔、沸点较高,且在水溶液中或熔融状态下能导电的化合物形成离子晶体;熔、沸点很高,不导电,不溶于一般溶剂的物质形成原子晶体;晶体能导电、传热、具有延展性的为金属晶体。
(2)根据物质的分类判断金属氧化物(如K2O、Na2O2等)、强碱(如NaOH、KOH等)和绝大多数的盐类是离子晶体;大多数非金属单质(除金刚石、石墨、晶体硅、晶体硼外)、气态氢化物、非金属氧化物(除SiO2外)、酸、绝大多数有机物(除有机盐外)是分子晶体。常见的原子晶体中单质有金刚石、晶体硅、晶体硼等;常见的原子晶体中化合物有碳化硅、二氧化硅等。金属单质(注:汞在常温为液体)与合金是金属晶体。
2.宏微结合:比较物质的熔、沸点高低的方法(1)首先看物质的状态,一般情况下:固体>液体>气体;二是看物质所属类型,一般是原子晶体>离子晶体>分子晶体。(2)同类晶体熔、沸点比较思路:原子晶体→共价键键能→键长→原子半径;分子晶体→分子间作用力→相对分子质量;离子晶体→离子键强弱→离子所带电荷数、离子半径。
题组一 晶体类型的判断1.如下表为锗卤化物的熔点和沸点,可知三种物质为_________晶体。并分析其变化规律及原因___________________________________________________________________________________________________。
解析:根据熔、沸点看出三种物质为分子晶体。它们的熔点和沸点大小顺序均为GeCl4
解析:根据晶体的物理性质分析,A物质,固态时能导电,能溶于盐酸,属于金属晶体;B物质,能溶于CS2,不溶于水,根据相似相溶规律,CS2为分子晶体,故B属于分子晶体;C物质,固态时不导电,液态时能导电,可溶于水,属于离子晶体;D物质,固态、液态时均不导电,熔点为3 500 ℃,属于原子晶体。答案:金属晶体 分子晶体 离子晶体 原子晶体
题组二 晶体熔、沸点的比较3.下列物质的熔、沸点高低顺序正确的是( )A.金刚石>晶体硅>二氧化硅>碳化硅B.CI4>CBr4>CCl4>CH4C.MgO>H2O>O2>Br2D.金刚石>生铁>纯铁>钠
解析:对于A选项,同属于原子晶体,熔、沸点高低主要看共价键的强弱,显然对键能而言,晶体硅<碳化硅,A错误;B选项,同为组成、结构相似的分子晶体,熔、沸点高低要看相对分子质量大小,正确;C选项,对于不同晶体类型熔沸点高低一般为原子晶体>离子晶体>分子晶体,MgO>(H2O、O2、Br2),H2O>(Br2、O2),Br2>O2,C项错误;D选项,生铁为铁合金,熔点要低于纯铁,D项错误。
答案:(1)H2O分子间形成氢键(2)> 两者均为离子化合物,且阴、阳离子的电荷数均为1,但后者的离子半径较大,离子键较弱,因此其熔点较低
(3)CO熔点________(填“>”或“<”)N2的熔点,原因是______________________________________________________________________。(4)CH4、SiH4、GeH4的熔、沸点依次______(填“增大”或“减小”),其原因是_________________________________________________________________________________________________________________。(5)SiO2比CO2熔点高的原因是_______________________________________________________________________________________________。
答案:(3)> CO为极性分子而N2为非极性分子,CO分子间作用力较大(4)增大 三种物质均为分子晶体,结构与组成相似,相对分子质量越大,范德华力越大,熔、沸点越高(5)SiO2为原子晶体而CO2为分子晶体
考点 2 常见的晶体模型一、常见金属晶体的原子堆积模型
二、原子晶体1.金刚石
(1)金刚石晶体中,每个C与另外___个C形成共价键,C—C键之间的夹角是109°28′,最小的环是___元环。含有1 ml C的金刚石中,形成的共价键有___ ml。(2)在金刚石晶胞中:C原子占据立方晶胞的顶点、面心和互不相邻的四个小立方体的中心,与每个C原子等距紧邻的C原子有4个,它们之间的距离为_____。
(1)SiO2晶体中,每个Si原子与___个O成键,每个O原子与___个硅原子成键,最小的环是_____元环,在“硅氧”四面体中,处于中心的是___原子,1 ml SiO2中含有___ ml Si—O键。(2)将金刚石中的C原子换成Si原子,每两个Si原子中间加一个O原子,就得到了SiO2的晶胞(图中大球代表Si原子,小球代表O原子)。
1.氯化钠(1)在晶体中,每个Na+同时吸引__个Cl-,每个Cl-同时吸引__个Na+,配位数为__。每个晶胞含__个Na+和__个Cl-。(2)在NaCl晶胞中,Na+和Cl-各自均为面心立方最密堆积。设晶胞的边长为a,与每个Na+等距紧邻的Cl-有6个,它们之间的距离为___;与每个Na+等距紧邻的Na+有12个,它们之间的距离为_____。Na+周围与每个Na+等距紧邻的6个Cl-围成的空间构型为_________。
2.氯化铯(1)在晶体中,每个Cl-吸引__个Cs+,每个Cs+吸引__个Cl-,配位数为 __。(2)在CsCl晶胞中,Cs+和Cl-各自均为简单立方堆积。设晶胞的边长为a,与每个Cs+等距紧邻的Cl-有8个,它们之间的距离为______;与每个Cs+等距紧邻的Cs+有6个,它们之间的距离为a。Cs+周围与每个Cs+等距紧邻的8个Cl-围成的空间构型为________。
1.干冰(1)干冰晶体中,每个CO2分子周围等距且紧邻的CO2分子有____个。(2)在干冰晶胞中:CO2分子为面心立方最密堆积。设晶胞的边长为a,与每个CO2等距紧邻的CO2有12个,它们之间的距离为______。2.冰冰的结构模型中,每个水分子与相邻的__个水分子以氢键相连接,含1 ml H2O的冰中,最多可形成__ ml“氢键”。
五、石墨晶体石墨是具有层状结构的混合型晶体(如图),层内存在______键、_____键,层间存在__________;层内每个C原子与3个C原子连接,构成六边形,其键长、键角相等,每个六边形平均占有__个C原子,C原子数与C—C键数之比为______。
1.下列排列方式中:A.ABCABCABCB.ABABABABAB C.ABBAABBAD.ABCCBAABCCBA,属于镁型堆积型式的是________;属于铜型堆积型式的是________。提示:B A
2.(1)硼化镁晶体在39 K时呈超导性。在硼化镁晶体中,镁原子和硼原子是分层排布的,如图是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。则硼化镁的化学式为________。提示:(1)MgB2
(2)在硼酸盐中,阴离子有链状、环状等多种结构形式。如图是一种链状结构的多硼酸根,则多硼酸根离子符号为________。
(1)金属钠形成的晶体中,每个钠原子周围与其距离最近的钠原子有8个。( )(2)金属镁形成的晶体中,每个镁原子周围与其距离最近的原子有6个。( )(3)在NaCl晶体中,每个Na+周围与其距离最近的Na+有12个,Na+周围的Cl-构成一个正八面体。( )
1.判断下列物质的晶胞结构,将对应序号填在线上。
(1)干冰晶体________;(2)氯化钠晶体________;(3)金刚石________;(4)钠________;(5)冰晶体________;(6)铜晶体________。答案:(1)② (2)① (3)③ (4)④ (5)⑤ (6)⑥
2.下列是几种常见的晶胞结构,填写晶胞中含有的粒子数。
A.NaCl(含________个Na+,________个Cl-)B.干冰(含________个CO2)C.CaF2(含________个Ca2+,________个F-)D.金刚石(含________个C)E.体心立方(含________个原子)F.面心立方(含________个原子)答案:4 4 4 4 8 8 2 4
3.(1)将等径圆球在二维空间里进行排列,可形成密置层和非密置层。如图1所示的半径相等的圆球的排列中,A属于________层,配位数是________;B属于________层,配位数是________。(2)将非密置层一层一层地在三维空间里堆积,得到如图2所示的一种金属晶体的晶胞,它被称为简单立方堆积,在这种晶体中,金属原子的配位数是________,平均每个晶胞所占有的原子数目是________。
答案:(1)非密置 4 密置 6 (2)6 1
2.方法(1)长方体(包括立方体)晶胞中不同位置的粒子数的计算。
命题角度一 晶胞中粒子数目及晶体、化学式的计算[典例1] 一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。 图中F-和O2-共同占据晶胞的上下底面位置,若两者的比例依次用x和1-x代表,则该化合物的化学式表示为________。
[答案] SmFeAsO1-xFx
命题角度二 晶胞中微粒配位数的计算[典例2] O和Na两元素能够形成化合物F,其晶胞结构如图所示,晶胞边长a=0.566 nm,F的化学式为________;晶胞中氧原子的配位数为________。
[解析] 由晶胞结构可知,一个晶胞中小球个数为8,大球个数为4,小球代表离子半径较小的Na+,大球代表离子半径较大的O2-,故化合物F的化学式为Na2O;晶胞中与每个氧原子距离最近且相等的钠原子有8个。[答案] Na2O 8
如:NaCl的晶胞模型如图,Na+配位数为6,Cl-配位数为6
金属P为简单立方堆积,P的配位数为6金属Na、K、Fe为体心立方堆积,配位数为8
[答案] InAs 4.275
[考能突破练]1.(1)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为________。
(2)一个Cu2O晶胞(如图)中,Cu原子的数目为________。
2.某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。
3.测定阿伏加德罗常数有多种方法,X射线衍射法是其中的一种。通过对CuCl晶体的X射线衍射图像的分析,可得出CuCl的晶胞如图所示,则距离每个Cu+最近的Cl-的个数为________。答案:4
4.磷化硼晶体的晶胞结构如图所示,其中实心球为磷原子,在一个晶胞中磷原子的空间堆积方式为________,磷原子的配位数为________,该结构中有一个配位键,提供空轨道的原子是________。答案:面心立方最密堆积 4 硼(B)
5.砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有________个,与每个硼原子紧邻的硼原子有________个,若其晶胞参数为b pm,则该晶体的密度为________g·cm-3(列出表达式,设NA为阿伏加德罗常数的值)。
晶胞参数及相关计算1.晶胞参数的相关计算(1)晶胞参数晶胞的形状和大小可以用6个参数来表示,包括晶胞的3组棱长a、b、c和3组棱相互间的夹角α、β、γ,即晶格特征参数,简称晶胞参数。
(2)晶胞参数的计算方法
(2)金属晶体空间利用率分类简析①简单立方堆积(如图1所示)立方体的棱长为2r,球的半径为r
②体心立方堆积(如图2所示) 过程:b2=a2+a2
③六方最密堆积(如图3所示)
④面心立方最密堆积(如图4所示)
命题角度一 坐标参数的确定[典例1] 一种四方结构的超导化合物的晶胞如图1所示。晶胞中Sm和As原子的投影位置如图2所示。
命题角度二 晶胞中微粒半径或距离的计算[典例2] 图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=______pm,Mg原子之间最短距离y=______pm。
命题角度三 晶体中空间利用率的计算[典例3] GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该晶体的类型为________,Ga与As以________键键合。Ga和As的摩尔质量分别为MGa g·ml-1和MAs g·ml-1,原子半径分别为rGa pm和rAs pm,阿伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为________。
3.利用新制的Cu(OH)2检验醛基时,生成砖红色的Cu2O,其晶胞结构如下图所示。
(1)根据所给晶胞,计算所含粒子数、化学式。(2)能写出晶胞中某些粒子的坐标点。(3)能计算出晶胞中某些特殊点之间的距离。(4)能根据所给量计算出晶胞的密度。(5)熟悉四种晶体类型,能根据已知性质判断晶体类型。(6)会比较各类不同晶体的熔、沸点大小。(7)会分析常见晶体中粒子的位置关系。
1.(1)(2019·高考全国卷Ⅰ)一些氧化物的熔点如下表所示:解释表中氧化物之间熔点差异的原因________________________________________________________________________________________。
答案:(1)Li2O、MgO为离子晶体,P4O6、SO2为分子晶体。晶格能MgO>Li2O,分子间作用力(分子量)P4O6>SO2
(2)(2017·高考全国卷Ⅰ)K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是__________________________________________________________________________。(3)(2017·高考全国卷Ⅲ)在CO2低压合成甲醇反应(CO2+3H2===CH3OH+H2O)所涉及的4种物质中,沸点从高到低的顺序为______________,原因是______________________________________________________。(4)(2016·高考全国卷Ⅲ)GaF3的熔点高于1 000 ℃,GaCl3的熔点为77.9 ℃,其原因是________________________________________________。
答案:(2)K原子半径较大且价电子数较少,金属键较弱(3)H2O>CH3OH>CO2>H2 H2O与CH3OH均为极性分子,水中氢键比甲醇多;CO2与H2均为非极性分子,CO2相对分子质量较大,范德华力较大(4)GaF3为离子晶体,GaCl3为分子晶体
2.(2020·高考全国卷Ⅰ)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。每个晶胞中含有LiFePO4的单元数有________个。
电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=______,n(Fe2+)∶n(Fe3+)=________。
3.(2020·高考全国卷Ⅱ节选)(1)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是______。(2)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是________;金属离子与氧离子间的作用力为________,Ca2+的配位数是________。
解析:(1)TiF4的熔点明显高于TiCl4,而TiCl4、TiBr4、TiI4的熔点依次升高,由此说明TiF4为离子化合物,而TiCl4、TiBr4、TiI4为共价化合物,共价化合物随相对分子质量的增大,分子间作用力增大,因此熔点依次升高。(2)三种元素中O的电负性最大,Ca的电负性最小,因此三种元素电负性的大小顺序为O>Ti>Ca。氧离子与金属离子之间形成的是离子键。由图(a)可知,每个Ca2+周围与之等距离的O2-的个数为12,即配位数为12。
答案:(1)TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高 (2)O>Ti>Ca 离子键 12
4.(2020·高考全国卷Ⅲ节选)(1)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),电负性大小顺序是________。与NH3BH3原子总数相等的等电子体是________(写分子式),其熔点比NH3BH3________(填“高”或“低”),原因是在NH3BH3分子之间,存在________,也称“双氢键”。
解析:(1)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),说明N的电负性强于H,B的电负性弱于H,故电负性N>H>B。NH3BH3分子含8个原子,其价电子总数为14,与其互为等电子体的分子是CH3CH3。CH3CH3分子中的H都呈正电性,NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),则CH3CH3熔点比NH3BH3低的原因是在NH3BH3分子之间存在Hδ+与Hδ-的静电引力。答案:(1)N>H>B CH3CH3 低 Hδ+与Hδ-的静电引力
(2)研究发现,氨硼烷在低温高压条件下为正交晶系结构,晶胞参数分别为a pm、b pm、c pm、α=β=γ=90°。氨硼烷的2×2×2超晶胞结构如图所示。氨硼烷晶体的密度ρ=________________ g·cm-3(列出计算式,设NA为阿伏加德罗常数的值)。
2022年高考化学一轮复习课件 第十二章 第55讲 晶体结构与性质 (含解析): 这是一份2022年高考化学一轮复习课件 第十二章 第55讲 晶体结构与性质 (含解析),共60页。PPT课件主要包含了复习目标,内容索引,考点一晶体常识,真题演练明确考向,课时精练巩固提高,知识梳理·夯基础,周期性有序,不固定,各向异性,各向同性等内容,欢迎下载使用。
2022届高考化学(人教版)一轮总复习课件:第32讲 晶体结构与性质: 这是一份2022届高考化学(人教版)一轮总复习课件:第32讲 晶体结构与性质,共60页。PPT课件主要包含了高考备考导航,考点一晶体和晶胞,核心知识梳理,周期性有序,不固定,各向异性,无各向异性,X-射线衍射,凝固凝华,基本单元等内容,欢迎下载使用。
人教版2022届高中化学一轮复习课件 第38讲 晶体结构与性质: 这是一份人教版2022届高中化学一轮复习课件 第38讲 晶体结构与性质,共55页。PPT课件主要包含了考点透视,栏目导航,课堂评价,考前8min,金属键较弱,阳离子,分子间作用力,共价键,离子键,静电作用等内容,欢迎下载使用。












