
2022高三一轮复习化学 第十章 第32讲 常见气体的实验室制备课件
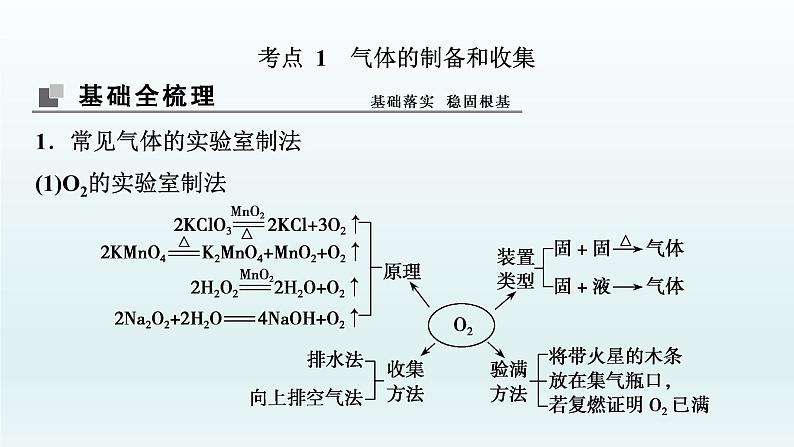
展开考点 1 气体的制备和收集1.常见气体的实验室制法(1)O2的实验室制法
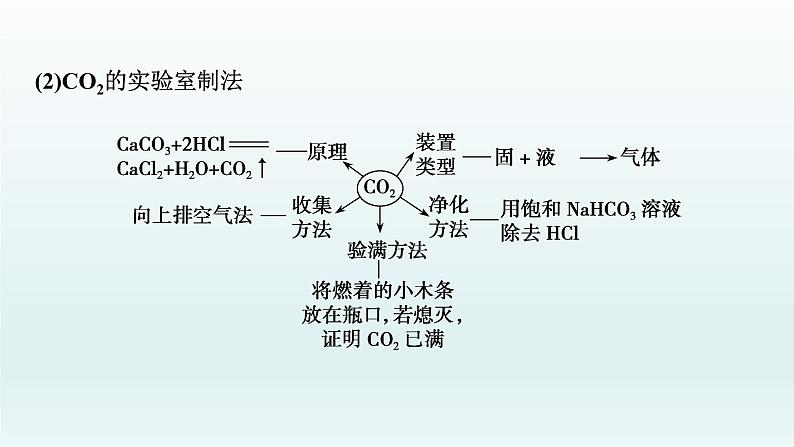
(2)CO2的实验室制法
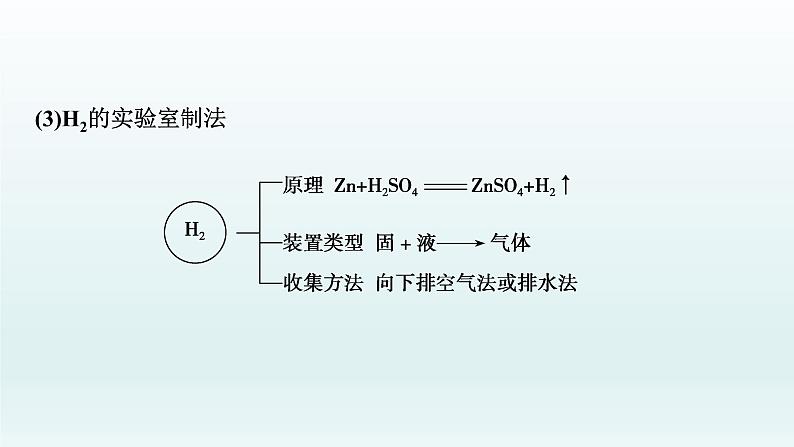
(3)H2的实验室制法
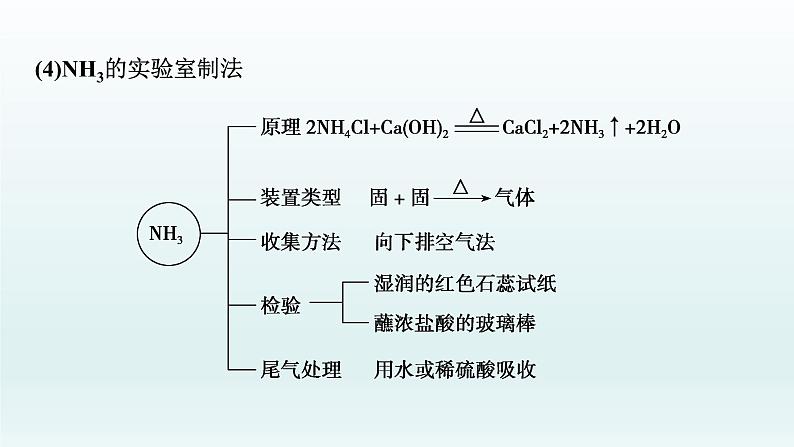
(4)NH3的实验室制法
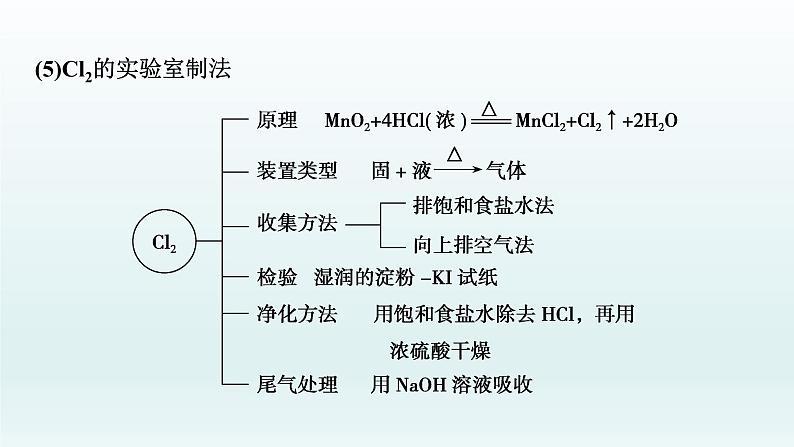
(5)Cl2的实验室制法
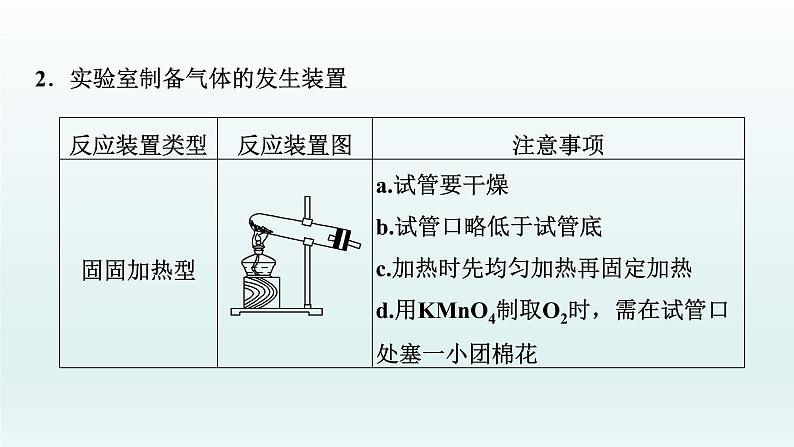
2.实验室制备气体的发生装置
3.常见气体的收集方法
1.在加热条件下,使用可燃烧气体(如H2、CO、CH4等),为防止爆炸应如何操作?________________________________________________________________________________________________________________________2.制备一些易与空气中的成分发生反应的物质(如H2还原CuO),反应结束时应如何操作?________________________________________________________________________________________________________________________
提示:1.先用反应气赶走系统内空气,再点燃酒精灯进行加热。2.先熄灭酒精灯,继续通入H2至试管冷却。
(1)用大理石和稀硫酸反应制备CO2。( )(2)用镁粉和稀硝酸反应制备H2。( )(3)加热NH4Cl可制得纯净Cl2。( )(4)用排水法可收集NH3、NO2。( )(5)用排空气法可收集CH2CH2和NO等气体。( )(6)用排饱和NaCl溶液法收集Cl2。( )
图A的改进优点是能控制反应液的温度。图B的改进优点是使圆底烧瓶和分液漏斗中的气体压强相等,便于液体顺利流下。
2.百变的“启普发生器”
启普发生器(如图a所示)①用启普发生器制取气体的三个条件:块状固体与液体反应;不需加热;生成的气体难溶于水。②使用方法:使用时,打开导气管上的旋塞,球形漏斗中的液体进入容器与固体反应,气体的流速可用旋塞调节。停止使用时,关闭旋塞,容器中的气体压强增大,将液体压回球形漏斗中,使液体和固体脱离,反应停止。
3.集气装置的创新——排液集气装置
装置(Ⅰ)从a管进气b管出水可收集难溶于水的气体,如H2、O2等。若将广口瓶中的液体更换,还可以收集以下气体。①饱和食盐水——收集Cl2。②饱和NaHCO3溶液——收集CO2。③饱和NaHS溶液——收集H2S。④四氯化碳——收集HCl或NH3。装置(Ⅱ)储气式集气。气体从橡胶管进入,可将水由A瓶排入B瓶,在瓶A中收集到气体。
4.化学实验操作中的先后原则(1)“从下往上”原则以Cl2的实验室制法为例,组装发生装置的顺序是放好铁架台→摆好酒精灯→根据酒精灯位置固定好铁圈→垫上石棉网→固定好圆底烧瓶。(2)“从左到右”原则组装复杂装置应遵循从左到右的原则,如气体制取实验中装置连接顺序为发生装置→除杂装置→集气装置→尾气吸收装置。
(3)先“塞”后“定”原则带导管的塞子在烧瓶固定前塞好,以免烧瓶固定后因不宜用力而塞不紧或因用力过猛而损坏烧瓶。(4)“固体先放,液体后加”原则固体试剂应在固定仪器前加入,而液体药品在仪器固定后加入。如实验室用MnO2和浓盐酸制取Cl2,MnO2应在烧瓶固定前装入,而浓盐酸应在烧瓶固定后从分液漏斗中缓慢加入。
(5)“先验气密性”原则进行与气体有关的实验时,应在装入药品前进行气密性检查。(6)“先验纯”原则可燃性气体在点燃前,必须先检验气体的纯度,否则可能会发生爆炸。
题组一 气体的制备原理及发生装置的选择1.实验室对制备气体反应的基本要求是:反应条件易满足、能平稳地产生气流、所得气体中尽可能不含杂质成分(除少量水蒸气及少量原料汽化形成的物质)。下列反应一般能用于实验室制备气体的是( )A.Na2O2与CO2反应制备O2B.H2O2溶液与MnO2混合制备O2C.加热浓硝酸制备NO2D.加热NH4Cl固体制备NH3
2.用KMnO4和浓盐酸可制备Cl2:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。下列装置可用于上述反应制备Cl2的是( )解析:由题给反应及化学方程式,可排除A、D两项;KMnO4为粉末状固体,故不能选用B装置。
题组二 气体收集装置的选择和利用3.某学生想利用如图装置(烧瓶不能移动)收集下列气体:①H2;②Cl2;③SO2;④HCl;⑤NH3;⑥NO;⑦NO2。下列说法正确的是( )A.若烧瓶是干燥的,由b进气,可收集②③④⑥⑦B.若烧瓶是干燥的,由a进气,可收集①⑤C.在烧瓶中充满水,由a进气,可收集①⑤⑦D.在烧瓶中充满水,由b进气,可收集⑥
解析:NO不能用排空气法收集,A错误;由a进气可以收集比空气密度小且与空气中的成分不反应的气体,B正确;NH3、NO2不能用排水法收集,C错误;用排水法集气不能由b进气,D错误。
4.如图为中学化学实验中的常见实验装置。 (1)装置A可用于制备多种气体,请写出用装置A制备下列气体时,圆底烧瓶和分液漏斗中应装的化学试剂。
(2)装置B可用于收集多种气体,若要用于收集氨气,则进气管为________;若要收集NO,简述用装置B收集NO的方法:_______________________________________________________________________。答案:(2)b 将集气瓶中装满水,塞上塞子,从b端通入NO气体,从a端排出水
A.①⑤⑧ B.③⑤⑦C.②⑤⑥D.③④⑧
解析:由反应物的状态和反应条件可知只能选用③作为发生装置,除去CO2可选用④或⑤装置,收集CO选用⑧装置,故合理的装置组合为③④⑧或③⑤⑧。
6.如图所示装置可用于实验室制备少量无水FeCl3,仪器连接顺序正确的是( )A.a—b—c—d—e—h—j—fB.a—e—d—c—b—h—j—gC.a—d—e—c—b—h—j—gD.a—c—b—d—e—h—j—f
解析:先制备氯气,再除去氯气中的HCl和水蒸气,将得到的纯净、干燥的氯气通入装有铁粉的玻璃管中,最后要有尾气吸收装置,正确的连接顺序是a—e—d—c—b—h(j)—j(h)—g。故选B。
考点 2 气体的净化和尾气处理1.气体的净化(1)原理:酸性杂质用碱性物质吸收;碱性杂质用酸性物质吸收;易溶于水或能与水反应的用水吸收;还原性杂质可用氧化性较强的物质来吸收或转化;氧化性杂质可用还原性较强的物质来吸收或转化。
2.尾气的处理通常有毒和有污染的尾气必须适当处理。常见仪器装置有:(1)吸收溶解度较小的尾气(如Cl2等)用A装置。(2)吸收溶解度较大的尾气(如HCl、NH3等)用B或C装置。(3)CO等气体可用点燃或收集于塑料袋(气球)中的方法除去,如D装置或E装置。
欲对Cl2进行干燥、吸收,需选用下列装置中的________(填序号)。答案:②④
(1)用五氧化二磷可干燥H2、NH3。( )(2)用饱和Na2CO3溶液可除去Cl2中混有的HCl。( )(3)用灼热的铜粉可除去CO中混有的O2。( )(4)用碱石灰干燥氨气,用浓硫酸干燥SO2。( )(5)实验室制备Cl2时,可用石灰水进行尾气处理。( )(6)实验制备NH3时,可用CCl4吸收多余的NH3。( )
1.气体除杂原则(1)不引入新的杂质。如除去甲烷中的乙烯不能用酸性高锰酸钾溶液,因为酸性高锰酸钾溶液氧化乙烯会生成二氧化碳,又引入了新的杂质。(2)不减少被净化气体的量。如除去CO2中混有的SO2,不能用NaOH溶液,而应该用饱和NaHCO3溶液。
2.气体的净化和尾气处理操作的注意事项(1)有氧化性的干燥剂(如浓硫酸)不能干燥有还原性的气体(如H2S、HI等)。(2)不能用无水CaCl2干燥NH3,因为无水CaCl2与NH3能反应。(3)当气体中含有多种杂质时,若采用洗气装置除杂,通常是除杂在前,干燥在后。若用加热装置除杂,通常是干燥在前,除杂在后。(4)尾气处理装置应与大气相通,如图所示装置不能作为尾气处理装置。
3.常见改进的尾气吸收装置
题组一 常见气体的净化1.有关气体的除杂或收集方法。下列说法合理的是 ( )A.要除去NO中混有的NO2,可以将混合气体先通过足量水,然后用无水CaCl2干燥B.CO2中混有的CO气体可用点燃法除去 C.除去H2S中混有的水蒸气,用浓硫酸干燥即可D.如图装置只能用来收集CO2,不能收集H2、NH3等
解析:A项,NO中混有NO2时,先通过足量水,NO2与水发生反应得到稀硝酸和NO,然后通过无水CaCl2干燥即可得到纯净的NO,正确;B项,由于CO2不支持燃烧,无法用点燃法除去CO2中混有的CO,可将混合气体通过灼热的CuO,利用CO的还原性将CO除去,错误;C项,H2S具有还原性,能被浓硫酸氧化,错误;D项,用题图装置收集气体时,从a端进气可收集CO2等密度比空气大的气体,从b端进气可收集H2、NH3等密度比空气小的气体,错误。
2.(2021·山西孝义联考)已知饱和氯化铵溶液与亚硝酸钠晶体混合加热可制备氮气。利用如下装置制取氮气,并用氮气制备Ca3N2,Ca3N2遇水发生水解反应。下列说法错误的是( )
中有氧气,为防止氧气与钙反应,应利用装置③除去氧气,而NaOH与O2不反应,错误。D项,实验结束,装置⑤中有生成的Ca3N2,Ca3N2遇水发生水解反应生成NH3和Ca(OH)2,NH3可以使湿润的红色石蕊试纸变蓝,正确。答案:C
题组二 尾气处理方法3.双球洗气管是一种多用途仪器,常用于除杂、气体干燥、气体吸收等实验操作。如图是一个以双球洗气管为尾气处理装置,用吸收剂X吸收气体Y的情形,其中符合事实的组合是 ( )
解析:A项,Cl2在饱和NaCl溶液中的溶解度很小,不能被吸收,错误;B项,因HCl极易溶于水,则极易被吸收,正确;C项,SO2能用浓硫酸干燥,但不能被吸收,错误;D项,NO有毒,不能直接排放到大气中,且NO不能与NaOH反应,不能被吸收,错误。
4.(2021·广州期末联考)MnSO4·H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:下列说法错误的是( )A.装置Ⅰ烧瓶中放入的药品X为铜屑B.装置Ⅱ中用“多孔球泡”可增大SO2的吸收速率C.装置Ⅲ用于吸收未反应的SO2D.用装置Ⅱ反应后的溶液制备MnSO4·H2O需经历蒸发结晶、过滤、洗涤及干燥的过程
解析:Cu与浓硫酸常温下不反应,X不可能为Cu,A项错误;装置Ⅱ中用“多孔球泡”,增大接触面积,可增大SO2的吸收速率,B项正确;装置Ⅲ中NaOH溶液可吸收尾气,C项正确;用装置Ⅱ反应后的溶液制备MnSO4·H2O,需要经过蒸发结晶、过滤、洗涤及干燥的过程,D项正确。
巧记四个“3”3类气体发生装置,3种气体净化装置、3种气体收集装置,3类尾气处理装置。
1.(2019·高考全国卷Ⅲ)下列实验不能达到目的的是( )
解析:A错:将Cl2通入碳酸钠溶液中发生反应:Cl2+2Na2CO3+H2O===NaCl+NaClO+2NaHCO3,不能制取较高浓度的次氯酸溶液。B对:在过氧化氢溶液中加入少量二氧化锰作催化剂,可加快氧气的生成速率。C对:加入饱和碳酸钠溶液可以中和乙酸,降低乙酸乙酯在水中的溶解度,便于析出。D对:向饱和亚硫酸钠溶液中滴加浓硫酸,应用强酸制弱酸的原理,可以制备二氧化硫气体。
2.(2017·全国高考卷Ⅰ)实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气)。下列说法正确的是( )A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度C.结束反应时,先关闭活塞K,再停止加热D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
解析:装置Q是启普发生器,是氢气的发生装置,装置排列顺序是氢气发生装置→安全瓶→除去HCl、O2装置→除去H2S装置→干燥氢气装置→氢气还原氧化钨装置→尾气处理装置。Zn+2HCl===ZnCl2+H2↑、ZnS+2HCl===ZnCl2+H2S↑,用装置Q制得的氢气中含有H2S、O2、HCl、H2O等杂质,由于酸性高锰酸钾溶液氧化氯化氢生成氯气,所以,应先用焦性没食子酸溶液吸收氧气,同时除去氯化氢(易溶于水),再用酸性高锰酸钾溶液吸收硫化氢,最后用浓硫酸干燥,试剂盛放顺序依次为焦性没食子酸溶液、酸性高锰酸钾溶液、浓硫酸,A项错误;类似氢
气还原氧化铜,实验完毕后,先停止加热,再继续通入氢气一段时间,C项错误;装置Q不能加热,适合块状固体与液体在常温下反应,而实验室用二氧化锰与浓盐酸反应制氯气需要加热,且二氧化锰是粉末状固体,故不能用装置Q制备氯气,D项错误。
3.(2016·高考全国卷Ⅰ)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NO2反应进行了探究。回答下列问题:
(1)氨气的制备①氨气的发生装置可以选择上图中的________,反应的化学方程式为___________________________________________________________。②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为发生装置→________(按气流方向,用小写字母表示)。
(2)氨气与二氧化氮的反应将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
第38讲 常见气体的实验室制备-备战2024年高考化学一轮复习精品课件(全国通用): 这是一份第38讲 常见气体的实验室制备-备战2024年高考化学一轮复习精品课件(全国通用),共30页。PPT课件主要包含了发生装置,气体的收集方法,收集Cl2,收集CO2,收集H2S,收集HCl或NH3等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第4章 第25讲 常见气体的实验室制备、净化和收集: 这是一份2024年高考化学一轮复习课件(鲁科版)第4章 第25讲 常见气体的实验室制备、净化和收集,文件包含第4章第25讲常见气体的实验室制备净化和收集pptx、第4章第25练常见气体的实验室制备净化和收集docx、第4章第25讲常见气体的实验室制备净化和收集docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
新高考化学一轮复习课件 第4章 第24讲 常见气体的实验室制备、净化和收集: 这是一份新高考化学一轮复习课件 第4章 第24讲 常见气体的实验室制备、净化和收集,共60页。PPT课件主要包含了高考化学一轮复习策略,真题演练明确考向,课时精练等内容,欢迎下载使用。












