



2022高三一轮复习化学 第八章 第24讲 弱电解质的电离平衡课件
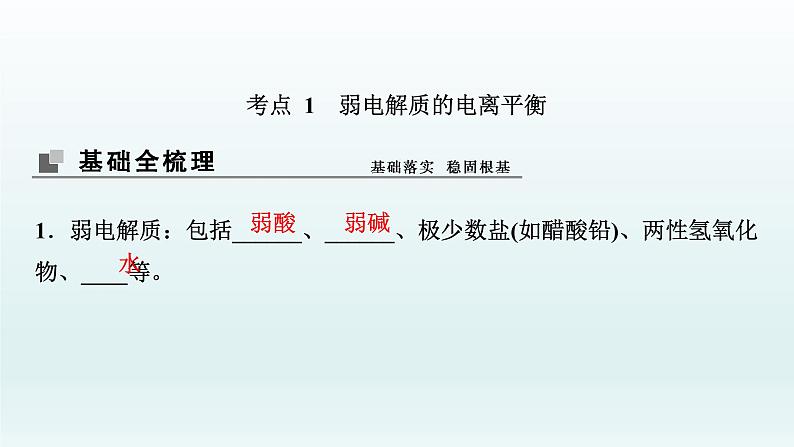
展开考点 1 弱电解质的电离平衡1.弱电解质:包括______、______、极少数盐(如醋酸铅)、两性氢氧化物、____等。
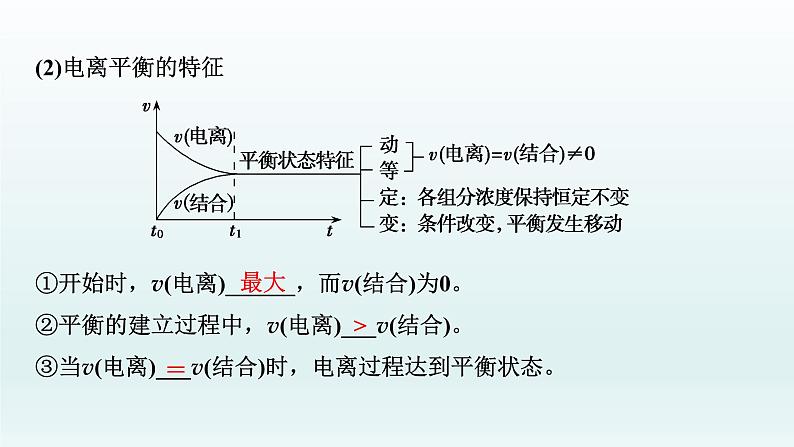
2.弱电解质的电离平衡(1)电离平衡的建立在一定条件下(如温度、压强等),当弱电解质电离成离子的速率和离子结合成分子的速率相等时,达到电离平衡状态。
(2)电离平衡的特征 ①开始时,v(电离)______,而v(结合)为0。②平衡的建立过程中,v(电离)___v(结合)。③当v(电离)___v(结合)时,电离过程达到平衡状态。
3.外因对电离平衡的影响(1)浓度:在一定温度下,同一弱电解质溶液,浓度越小,电离程度越大。(2)温度:温度越高,电离程度越大。(3)同离子效应:加入与弱电解质具有相同离子的电解质时,可使电离平衡向结合成弱电解质分子的方向移动。(4)化学反应:加入能与弱电解质电离出的离子反应的物质时,可使电离平衡向电离方向移动。
1.测定溶液中离子浓度变化的实验方法有多种,如:(1)有颜色的离子:通过溶液颜色的变化来判断,可用比色计测量离子浓度。(2)H+或OH-浓度:可用酸碱指示剂或pH计测量H+或OH-浓度的变化。(3)溶液的导电性:常用溶液的电导率,定量描述溶液的导电性。电解质溶液的电导率与离子浓度和离子所带电荷数成正比。
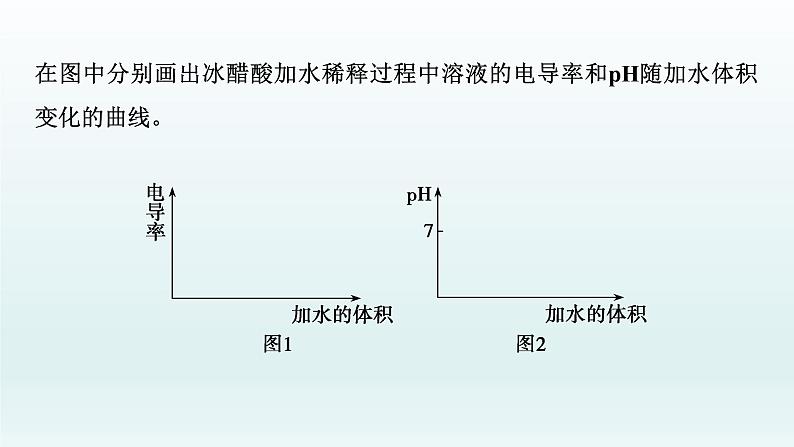
在图中分别画出冰醋酸加水稀释过程中溶液的电导率和pH随加水体积变化的曲线。
提示:→ 增大 减小 减弱 不变 → 增大 增大 增强 不变 ← 增大 增大 增强 不变 → 减小 减小 增强 不变 → 减小 减小 增强 不变 → 增大 增大 增强 增大 ← 减小 减小 增强 不变
1.错点提醒:外界条件对电离平衡影响的四个“不一定”(1)加水稀释时,溶液中不一定所有的离子浓度都减小。如稀醋酸加水稀释时,溶液中的c(H+)减小,因为温度不变,Kw=c(H+)·c(OH-)是定值,故c(OH-)增大。
(4)电离平衡右移,电离程度也不一定增大,加水稀释或增大弱电解质的浓度,都使电离平衡向电离方向移动,但加水稀释时弱电解质的电离程度增大,而增大弱电解质的浓度时弱电解质的电离程度减小。
2.归纳整合:影响电解质溶液导电能力的主要因素电解质溶液的导电能力主要取决于离子的浓度、离子在电场中的运动速率以及离子所带的电荷数目。(1)相同条件下溶液的离子浓度越大,其导电能力越强。(2)相同离子浓度时,离子所带的电荷数越多,溶液的导电能力越强。(3)温度越高,溶液的导电能力越强。
答案:(1)增大 (2)不 (3)向右 减小 (4)减小 增大
解析:HCl为强电解质,CH3COOH为弱电解质,滴加NH3·H2O,NH3·H2O先与HCl反应,生成同样为强电解质的NH4Cl,但溶液体积不断增大,溶液被稀释,所以电导率下降。当HCl被中和完后,继续与CH3COOH弱电解质反应,生成CH3COONH4,它为强电解质,所以电导率增大。HCl与CH3COOH均反应完后,继续滴加弱电解质NH3·H2O,电导率变化不大,因为溶液被稀释,有下降趋势。答案:D
考点 2 电离平衡常数电离平衡常数(即电离常数)(1)表达式
(2)意义:相同条件下,K值越大,表示该弱电解质______电离,所对应的酸性或碱性相对______。
(3)特点:①多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要决定于第____步电离。②影响因素
1.参照教材中的两级电离常数表达式,写出H3PO4的逐级电离常数表达式。______________________________________________________________2.结合教材中的H2CO3的电离平衡常数K1=4.4×10-7,K2=4.7×10-11,有人认为K1、K2差别很大的主要原因是第一步电离产生的H+对第二步的电离起抑制作用造成的。你认为这种观点对吗?试从影响平衡常数因素的角度阐明你的观点。______________________________________________________________
1.归纳整合:判断溶液中某些离子浓度比值变化的方法对弱电解质平衡移动过程中某些离子浓度比值的变化常用两种方法比较:第一种方法是将浓度之比转化为物质的量之比进行比较,这样分析起来可以忽略溶液体积的变化,只需分析微粒数目的变化即可。第二种方法是“凑常数”,解题时将某些离子的浓度比值关系,去乘以或除以某种离子的浓度,将会转化为一个常数与某种离子浓度乘积或相除的关系。
2.归纳整合:电离平衡常数的三大应用(1)判断弱酸(或弱碱)的相对强弱,电离常数越大,酸性(或碱性)越强。(2)判断盐溶液的酸性(或碱性)强弱,电离常数越大,对应的盐水解程度越小,酸性(或碱性)越弱。(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
题组一 应用电离常数判断酸性强弱或反应进行的可能性1.部分弱酸的电离平衡常数如下表:
答案:(1)变小 (2)不变 (3)变大 (4)不变
题组三 利用电离常数与Qc的关系,判断平衡移动方向3.试用平衡移动原理、Qc分别解释弱电解质溶液加水稀释时平衡移动的方向(以CH3COOH电离平衡为例)。
细查电离常数的5种求法及其相关计算
[答案] 4.2×10-7
[答案] 10-5.4
[策略技巧] 在微粒浓度或物质的量或含量等随pH或时间等变化的图像中,若某点(如起点、交叉点等)有确定的坐标值,可以用该点数据来计算相关平衡常数。
4.守恒法[典例4] 25 ℃时,将a ml NH4NO3溶于水,向该溶液滴加b L氨水后溶液呈中性,则所滴加氨水的浓度为________ml/L(NH3·H2O的电离平衡常数取Kb=2×10-5 ml/L)。
[策略技巧] 对于电离平衡或水解平衡常数,若不方便建立平衡三段式计算,可先根据溶液中的电荷守恒、物料守恒等关系找出各微粒的浓度,再代入平衡常数的定义式中计算。
[答案] 8.7×10-7
[策略技巧] 已知多个相关反应的平衡常数,可用“盖斯定律”法将多个方程式相加或相减,得到目标方程式,对应方程式的K是相乘或相除的关系,若目标方程式系数是已知方程式的n倍,则目标方程式K是已知方程式K的n次方。
二、利用电离常数计算c(H+)[典例6] 已知室温时,0.1 ml·L-1某一元酸HA在水中有0.1%发生电离。求:(1)溶液的pH=________;(2)室温时,Ka(HA)=________。
[答案] (1)4 (2)1×10-7
[策略技巧] 由于弱酸只有极少一部分电离,c(H+)的数值很小,可做近似处理:c(HX)-c(H+)≈c(HX)。
强酸(碱)与弱酸(碱)的实验确定与性质比较一、证明HA为弱酸的实验方法(25 ℃)
二、一元强酸与一元弱酸的比较1.相同物质的量浓度、相同体积的一元强酸与一元弱酸的比较
2.相同pH、相同体积的一元强酸与一元弱酸的比较说明:一元强碱与一元弱碱的比较规律与以上类似。
3.一元强酸(HCl)与一元弱酸(CH3COOH)稀释图像比较(1)相同体积、相同浓度的盐酸、醋酸溶液
(2)相同体积、相同pH的盐酸、醋酸溶液
[考能突破练]1.为了证明醋酸是弱电解质,甲、乙、丙、丁四人分别选用下列试剂进行实验:0.1 ml·L-1醋酸溶液、0.1 ml·L-1盐酸、pH=3的盐酸、pH=3的醋酸溶液、CH3COONa晶体、NaCl晶体、CH3COONH4晶体、蒸馏水、锌粒、pH试纸、酚酞、NaOH溶液等。(1)甲取出10 mL 0.1 ml·L-1的醋酸溶液,用pH试纸测出其pH=a,确定醋酸是弱电解质,则a应该满足的关系是________,理由是_______。答案:(1)a>1 因醋酸是弱酸,不能完全电离
(2)乙分别取pH=3的醋酸溶液和盐酸各1 mL,分别用蒸馏水稀释到100 mL,然后用pH试纸分别测定两溶液的pH,则可认定醋酸是弱电解质,判断的依据是________________________________________________。(3)丙分别取pH=3的盐酸和醋酸溶液各10 mL,然后加入质量相同的锌粒,醋酸溶液放出H2的速率快,则认定醋酸是弱电解质,你认为这一方法正确吗?________,请说明理由:__________________________。(4)丁用CH3COONa晶体、NaCl晶体、蒸馏水和酚酞做实验,也论证了醋酸是弱酸的事实,该同学的实验操作和现象是__________________。
答案:(2)盐酸的pH=5,醋酸的pH<5(3)正确。由于醋酸是弱酸,随着反应的进行,醋酸不断电离,c(H+)变化小,产生H2的速率醋酸比盐酸快(4)将CH3COONa晶体、NaCl晶体分别溶于适量水配成溶液,再分别滴入酚酞溶液,CH3COONa溶液变浅红色,NaCl溶液不变色
2.在一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸:(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________(用字母表示,下同)。(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________。(3)若三者c(H+)相同时,三种酸的物质的量浓度由大到小的顺序是______________。(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是________。
答案:(1)b>a>c (2)b>a=c (3)c>a>b (4)c>a=b
(5)当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为________,反应所需时间的长短关系是________。(6)将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是____________________________________________________。(7)将c(H+)相同、体积相同的三种酸,分别与等浓度的NaOH稀溶液反应至pH=7,则消耗NaOH溶液的体积由大到小的顺序是________。答案:(5)a=b=c a=b>c (6)c>a=b (7)c>a=b
3.相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于产生的氢气体积(V)随时间(t)变化的示意图正确的是( )
解析:强酸完全电离,中强酸部分电离,随着反应的进行,中强酸会继续电离出H+,所以溶液②产生氢气的体积多,在相同时间内,②的反应速率比①快。
4.pH=2的两种一元酸X和Y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 ml·L-1)至pH=7,消耗NaOH溶液的体积为VX、VY,则( )A.X为弱酸,VX<VYB.X为强酸,VX>VYC.Y为弱酸,VX<VYD.Y为强酸,VX>VY
解析:分析图像可知,X、Y两酸溶液稀释10倍时,X pH增大1,则X为强酸,Y的pH增大的范围小于1,则Y为弱酸,c(Y)>c(X),体积相同的pH=2的X、Y两酸溶液被NaOH溶液滴定至pH=7,则Y消耗NaOH溶液的体积大。
1.判断强弱电解质的核心依据:电解质在水溶液中的电离程度,若不完全电离则为弱电解质。2.电离平衡的5个特征:逆→等→动→定→变。3.高考必考的影响电离平衡的3个因素(1)升高温度:电离平衡右移。(2)稀释:电离平衡右移。(3)同离子效应:电离平衡左移。
4.电离常数(1)影响因素:弱电解质的性质、温度。(2)应用:判断弱电解质的强弱、盐类水解程度。(3)计算。①已知c(HX)和c(H+),求K。②已知K,求c(H+)。
2.(2019·高考天津卷)某温度下,HNO2和CH3COOH的电离常数分别为5.0×10-4和1.7×10-5。将pH和体积均相同的两种酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是( )
2022高中化学一轮专题复习电子稿课件 专题5 第24讲 弱电解质的电离平衡 溶液的pH: 这是一份2022高中化学一轮专题复习电子稿课件 专题5 第24讲 弱电解质的电离平衡 溶液的pH,共60页。PPT课件主要包含了考点透视,栏目导航,课堂评价,考前8min,弱电解质,~14,标准比色卡,pH计,酚酞或甲基橙,指示剂等内容,欢迎下载使用。
人教版2022届高中化学一轮复习课件 第24讲 弱电解质的电离平衡 溶液的pH: 这是一份人教版2022届高中化学一轮复习课件 第24讲 弱电解质的电离平衡 溶液的pH,共60页。PPT课件主要包含了考点透视,栏目导航,课堂评价,考前8min,弱电解质,~14,标准比色卡,pH计,酚酞或甲基橙,指示剂等内容,欢迎下载使用。
2022高考化学一轮复习(步步高)第八章 第37讲 弱电解质的电离平衡课件: 这是一份2022高考化学一轮复习(步步高)第八章 第37讲 弱电解质的电离平衡课件,共60页。PPT课件主要包含了复习目标,真题演练明确考向,课时精练巩固提高,考点二电离平衡常数,内容索引,知识梳理·夯基础,全部电离,部分电离,大多数盐,错误的写明原因等内容,欢迎下载使用。












