




2022高三一轮复习化学 第八章 第27讲 难溶电解质的溶解平衡课件
展开考点 1 沉淀溶解平衡及其应用1.难溶、可溶、易溶界定20 ℃时,电解质在水中的溶解度与溶解性存在如下关系:
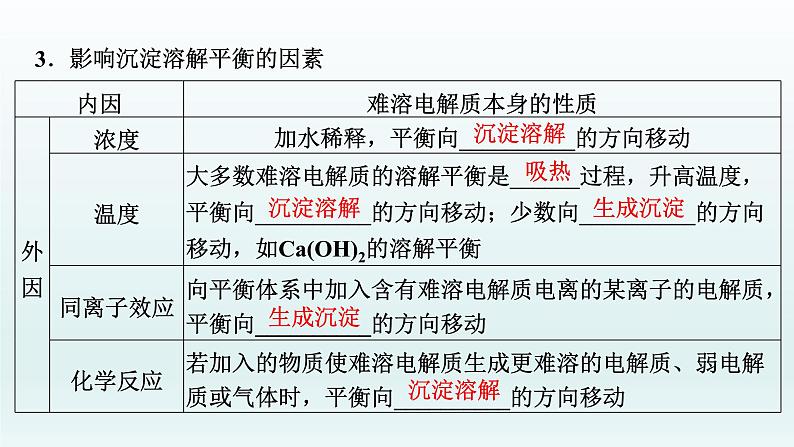
3.影响沉淀溶解平衡的因素
4.沉淀溶解平衡的应用(1)沉淀的生成:①调节pH法:如除去CuCl2溶液中的杂质FeCl3,可以向溶液中加入CuO,调节溶液的pH,使Fe3+形成Fe(OH)3沉淀而除去。离子方程式为___________________________,__________________________。②沉淀剂法:如用H2S沉淀Hg2+的离子方程式为___________________________。
CuO+2H+===Cu2++H2O
Hg2++H2S===HgS↓+2H+
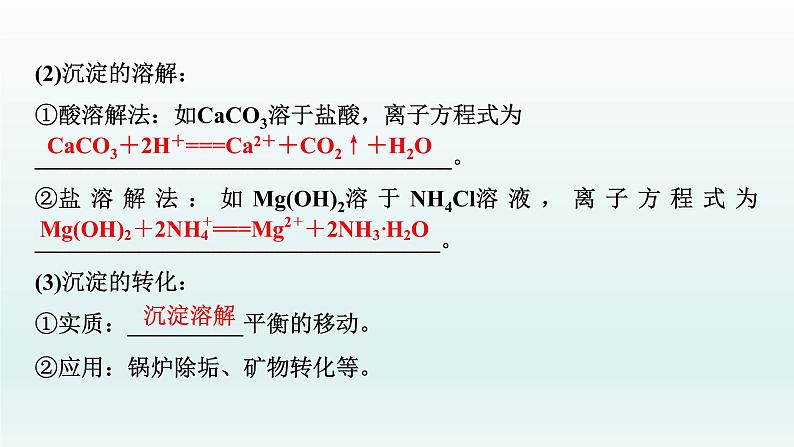
(2)沉淀的溶解:①酸溶解法:如CaCO3溶于盐酸,离子方程式为____________________________________。②盐溶解法:如Mg(OH)2溶于NH4Cl溶液,离子方程式为___________________________________。(3)沉淀的转化:①实质:__________平衡的移动。②应用:锅炉除垢、矿物转化等。
CaCO3+2H+===Ca2++CO2↑+H2O
提示:正向 增大 增大 增大 正向 不变 逆向 增大 减小 不变 逆向 减小 正向 减小 增大 不变
2.试用平衡移动原理解释下列事实。(1)BaCO3不溶于水,为什么不能做钡餐?__________________________________________________________________________________________________________________________(2)分别用等体积的蒸馏水和0.01 ml·L-1的盐酸洗涤AgCl沉淀,用水洗涤造成的AgCl的损失大于用稀盐酸洗涤的损失量。__________________________________________________________________________________________________________________________
(1)沉淀达到溶解平衡时,溶液中溶质电离出的离子浓度一定相等,且保持不变。( )(2)升高温度,沉淀溶解平衡一定正向移动。( )(3)室温下,AgCl在水中的溶解度小于在食盐水中的溶解度。( )(4)为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀。( )
(5)Ksp大的难溶电解质容易向Ksp小的转化,但Ksp小的不能向Ksp大的转化。( )(6)难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解的方向移动。( )
1.错点提醒:应根据Qc与Ksp的大小关系判断沉淀转化的方向(1)一般说来,溶解度小的沉淀转化成溶解度更小的沉淀容易实现,但溶解度小的沉淀转化成溶解度稍大的沉淀也能实现。(2)用沉淀法除杂不可能将杂质离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1×10-5 ml·L-1时,沉淀已经完全。
2.学科思想:溶解度曲线应用的归纳与整合(1)利用溶解度受温度影响分离、提纯物质①溶解度受温度影响较小的物质(如NaCl)采取蒸发结晶的方法:如NaCl溶液中含有KNO3,应采取蒸发结晶,趁热过滤的方法。②溶解度受温度影响较大的物质(或带有结晶水)采取蒸发浓缩、冷却结晶的方法:如Mg(ClO3)2溶液中含有NaCl,应采取加热浓缩、冷却结晶、过滤的方法。
(2)利用溶解度不同可以制备物质如侯氏制碱法:NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl;如MgCl2+2NaClO3===2NaCl↓+Mg(ClO3)2。
2.某兴趣小组进行下列实验:①将0.1 ml·L-1 MgCl2溶液和0.5 ml·L-1 NaOH溶液等体积混合得到浊液②取少量①中浊液,滴加0.1 ml·L-1 FeCl3溶液,出现红褐色沉淀③将①中浊液过滤,取少量白色沉淀,滴加0.1 ml·L-1 FeCl3溶液,白色沉淀变为红褐色沉淀④另取少量白色沉淀,滴加饱和NH4Cl溶液,沉淀溶解
题组二 沉淀溶解平衡的应用3.要使工业废水中的Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等做沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:由上述数据可知,沉淀剂最好选用( )A.硫化物B.硫酸盐C.碳酸盐D.以上沉淀剂均可
6.已知四种盐的溶解度(S)曲线如图所示,下列说法不正确的是( )A.将NaCl溶液蒸干可得NaCl固体B.将MgCl2溶液蒸干可得MgCl2固体C.Mg(ClO3)2中混有少量NaCl杂质,可用重结晶法提纯D.可用MgCl2和NaClO3制备Mg(ClO3)2
考点 2 溶度积常数及其应用
cm(An+)·cn(Bm-)
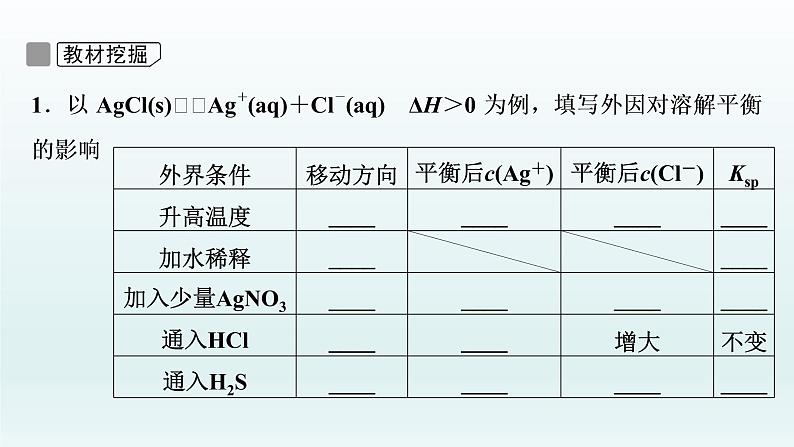
2.影响Ksp的因素(1)内因:难溶物质本身的性质,这是决定因素。(2)外因:①浓度:加水稀释,平衡向沉淀______的方向移动,但Ksp______。②温度:绝大多数难溶物的溶解是______过程,升高温度,平衡向______的方向移动,Ksp______。③其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解的方向移动,但Ksp不变。
1.根据教材选修4表中数据:Ksp(CaCO3)=2.8×10-9、Ksp(CaSO4)=9.1×10-6,溶解能力:CaSO4大于CaCO3。请用数据说明溶解能力小的CaCO3能否转化为溶解能力大的CaSO4?__________________________________________________________________________________________________________________________
2.根据教材选修4中“沉淀的转化”,你对“沉淀的转化”有什么新的认识?__________________________________________________________________________________________________________________________提示:①溶解能力大的沉淀均可以转化为溶解能力小的沉淀;②溶解能力差距不是太大的沉淀,溶解能力小的沉淀也可转化为溶解能力大的沉淀。
(1)Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度。( )(2)不可能使要除去的离子全部通过沉淀除去。一般认为残留在溶液中的离子浓度小于1.0×10-5 ml·L-1时,已经完全沉淀。( )(3)在一定条件下,溶解度较小的沉淀也可以转化成溶解度较大的沉淀。( )(4)常温下,向BaCO3的饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小。( )(5)溶度积常数Ksp只受温度影响,温度升高,Ksp增大。( )
模型构建:解沉淀溶解平衡曲线题的三个步骤第一步:明确图像中纵、横坐标的含义纵、横坐标通常是难溶电解质溶解后电离出的离子浓度。第二步:理解图像中线上点、线外点的含义
(1)以氯化银为例,在该沉淀溶解平衡图像上,曲线上任意一点都达到了沉淀溶解平衡状态,此时Qc=Ksp。在温度不变时,无论改变哪种离子的浓度,另一种离子的浓度只能在曲线上变化,不会出现在曲线以外。(2)曲线上方区域的点均为过饱和溶液,此时Qc>Ksp。(3)曲线下方区域的点均为不饱和溶液,此时Qc<Ksp。
第三步:抓住Ksp的特点,结合选项分析判断(1)溶液在恒温蒸发时,离子浓度的变化分两种情况:①原溶液不饱和时,离子浓度都增大;②原溶液饱和时,离子浓度都不变。(2)溶度积常数只是温度的函数,与溶液中溶质的离子浓度无关,在同一曲线上的点,溶度积常数相同。
题组一 沉淀溶解平衡曲线1.不同温度下(T1、T2),CaCO3在水中的沉淀溶解平衡曲线如图所示,回答下列问题(注:CaCO3均未完全溶解)。
(1)T1________(填“>”“<”或“=”)T2。(2)保持T1不变,怎样使A点变成B点?________________________________________________________________________________________________________________________(3)在B点,若温度从T1升到T2,则B点变到________点(填“C”“D”或“E”)。答案:(1)<(2)保持T1不变,向悬浊液中加入Na2CO3固体。(3)D
5.(1)Na2SO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 ml·L-1,则生成沉淀所需CaCl2溶液的最小浓度为____________________________________________________________。(2)已知25 ℃时Ksp[Fe(OH)3]=4.0×10-38,此温度下若在实验室中配制5 ml·L-1 100 mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入________mL 2 ml·L-1的盐酸(忽略加入盐酸的体积)。
答案:(1)6.2×10-4 ml·L-1 (2)2.5
用Ka(或Kb)、Kw、Kh推导Ksp及Ksp的应用
[答案] 3.6×10-9
2.计算沉淀存在时溶液的pH[典例3] 在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1 ml·L-1,将适量FeS投入其饱和溶液中,应调节溶液的pH约为________。
2.已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。常温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6 ml·L-1),需调节溶液的pH范围为____________。
答案:5.0
3.三个强化理解(1)沉淀溶解平衡是化学平衡的一种,沉淀溶解平衡移动分析时也同样遵循勒夏特列原理。(2)溶度积大的难溶电解质的溶解度不一定大,只有组成相似的难溶电解质才有可比性。(3)复分解反应总是向着某些离子浓度减小的方向进行,若生成难溶电解质,则向着生成溶度积较小的难溶电解质的方向进行。
1.(2019·高考全国卷Ⅱ)绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.图中a和b分别为T1、T2温度下CdS在水中的溶解度B.图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q)C.向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动D.温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
解析:难溶物质的溶解度可以用物质的量浓度表示,即图中a、b分别表示T1、T2温度下,1 L CdS饱和溶液里含a ml、b ml CdS,A对;Ksp在一定温度下是一个常数,所以Ksp(m)=Ksp(n)=Ksp(p)
时,消耗AgNO3溶液的体积为(0.040 0 ml·L-1×50.0 mL×10-3L·mL-1)/(0.100 ml·L-1)=20.0 mL,C错误;相同实验条件下,沉淀相同量的Cl-和Br-消耗的AgNO3的量相同,由于Ksp(AgBr)<Ksp(AgCl),当滴加相等量的Ag+时,溶液中c(Br-)<c(Cl-),故反应终点c向b方向移动,D正确。
3.(2017·高考全国卷Ⅲ)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
4.(2020·新高考山东卷)以菱镁矿(主要成分为MgCO3,含少量SiO2、Fe2O3和Al2O3)为原料制备高纯镁砂的工艺流程如下:已知浸出时产生的废渣中有SiO2、Fe(OH)3和Al(OH)3。下列说法错误的是( )A.浸出镁的反应为MgO+2NH4Cl===MgCl2+2NH3↑+H2OB.浸出和沉镁的操作均应在较高温度下进行C.流程中可循环使用的物质有NH3、NH4ClD.分离Mg2+与Al3+、Fe3+是利用了它们氢氧化物Ksp的不同
解析:氯化铵溶液显酸性,与MgO反应,相当于MgO促进了氯化铵的水解,生成氨气,A项正确;氨水易分解,故沉镁时温度不可太高,B项错误;由流程图可知氨气可循环使用,沉镁过程中产生氯化铵,故氯化铵也可循环使用,C项正确;浸出过程中产生Fe(OH)3和Al(OH)3,沉镁过程中加氨水调节pH产生Mg(OH)2,利用三种离子氢氧化物Ksp的不同,使其先后沉淀而分离,D项正确。
5.(2020·高考全国卷Ⅲ节选)某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示: 利用上述表格数据,计算Ni(OH)2的Ksp=________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 ml·L-1,则“调pH”应控制的pH范围是________。
2022届高考化学(人教版)一轮总复习课件:第24讲 难溶电解质的溶解平衡: 这是一份2022届高考化学(人教版)一轮总复习课件:第24讲 难溶电解质的溶解平衡,共60页。PPT课件主要包含了高考备考导航,核心知识梳理,沉淀溶解,沉淀生成,溶解的方向,生成沉淀的方向,沉淀溶解平衡,溶解度更小,××××,基础小题自测等内容,欢迎下载使用。
2022高考化学一轮复习课件:第8章 第6讲 难溶电解质的溶解平衡: 这是一份2022高考化学一轮复习课件:第8章 第6讲 难溶电解质的溶解平衡,共58页。PPT课件主要包含了知识点1,知识点2,知识点3,训练四十三等内容,欢迎下载使用。
人教版2022届高中化学一轮复习课件 第26讲 难溶电解质的溶解平衡: 这是一份人教版2022届高中化学一轮复习课件 第26讲 难溶电解质的溶解平衡,共57页。PPT课件主要包含了考点透视,栏目导航,课堂评价,考前8min,平衡常数,生成沉淀,数轴数值的含义,饱和溶液,不饱和溶液,有沉淀生成等内容,欢迎下载使用。












