




2022高三一轮复习化学 第五章 核心素养提升(五) 元素的综合推断课件
展开一 依据元素原子结构推断元素 利用原子结构、核外电子排布特征为元素推断的突破口,是元素推断题的重要类型之一,题目通常以文字叙述的形式给出元素原子的核外电子排布、位置关系等关键信息。解题时可结合短周期元素的原子结构及元素的特殊性质,对元素进行合理的推断。
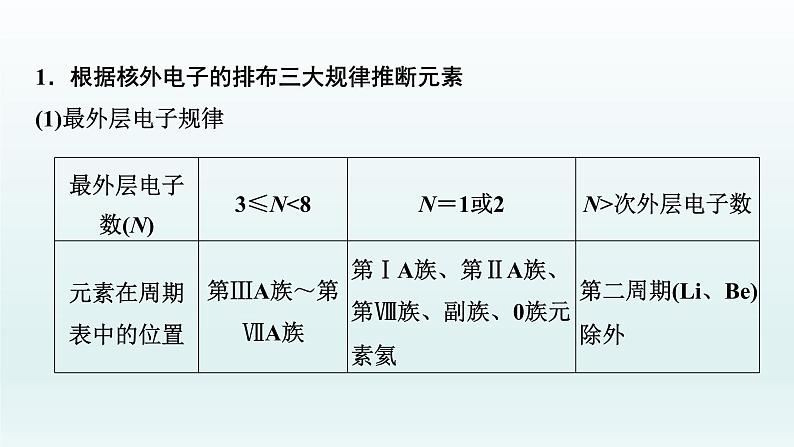
1.根据核外电子的排布三大规律推断元素(1)最外层电子规律
(2)“阴三、阳四”规律某元素阴离子最外层电子数与次外层电子数相等,该元素位于第三周期;若为阳离子,则位于第四周期。如S2-、K+最外层电子数与次外层电子数相等,则S位于第三周期,K位于第四周期。(3)“阴上、阳下”规律电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。如O2-、F-、Na+、Mg2+、Al3+电子层结构相同,则Na、Mg、Al位于O、F的下一周期。
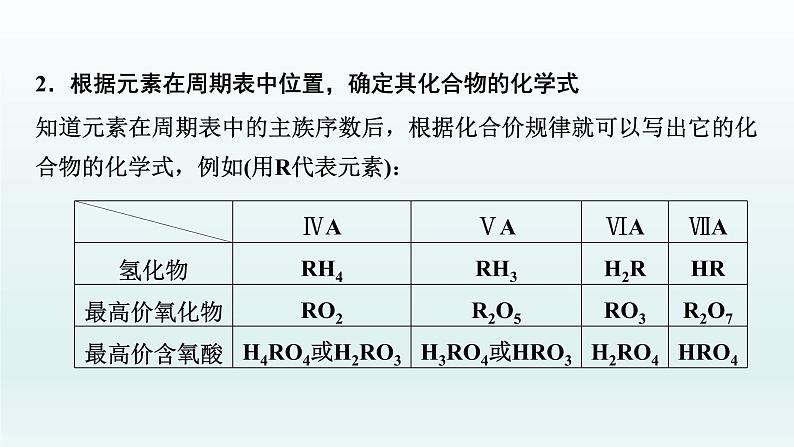
2.根据元素在周期表中位置,确定其化合物的化学式知道元素在周期表中的主族序数后,根据化合价规律就可以写出它的化合物的化学式,例如(用R代表元素):
依据元素周期表结构推断元素残缺元素周期表型推断题一般给出两种信息:一是给出局部的元素周期表,展示出几种不同元素的相对位置;二是给出某种元素的位置特征、原子结构特征或由该元素形成的单质或化合物的特殊性质。解答此类题目时,要先根据给出的某种元素的特殊结构或性质,确定该元素在周期表中的位置,然后以此为“坐标原点”,根据其他元素与该元素的位置关系,进而确定其他未知的元素。
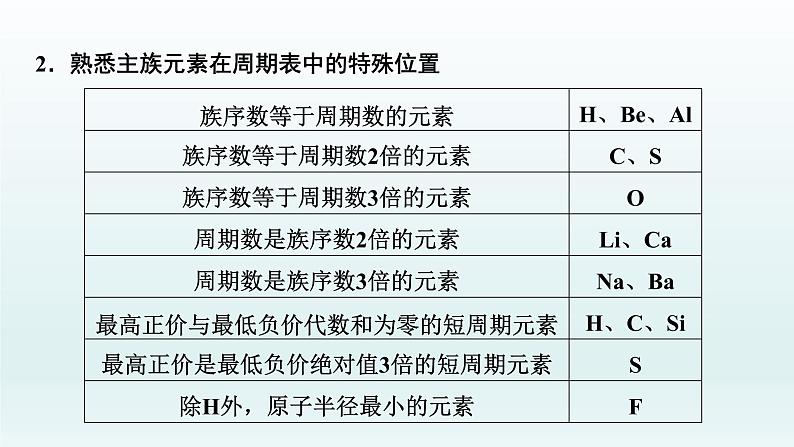
1.元素周期表中短周期特殊结构的应用(1)元素周期表中第一周期只有两种元素H和He,H元素所在的第ⅠA族为元素周期表的左侧边界,第ⅠA 族左侧无元素分布。(2)He为0族元素,0族元素为元素周期表的右侧边界,0族元素右侧没有元素分布。利用这个关系可以确定元素所在的周期和族。
2.熟悉主族元素在周期表中的特殊位置
三 依据元素及其化合物性质推断元素 利用元素及其化合物特殊组成与特殊性质的元素推断题,是近几年高考的热点题型,题目一般通过文字叙述提供某些元素及其化合物的相关性质(如能腐蚀玻璃、黄绿色气体等),解题时抓住这些关键特性,首先确定其为何种元素,然后以此为突破口,推知其他未知元素。
[素养专项练]1.(根据元素周期表片段推断)短周期元素W、X、Y和Z在周期表中的相对位置如表所示,这四种元素原子的最外层电子数之和为21。下列关系正确的是( )A.氢化物沸点:W
解析:由液氨可做制冷剂可推出W为N;由Y的原子半径是所有短周期主族元素中最大的可推出Y为Na;由Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O,结合W、X、Y、Z的原子序数依次增大可推出X为O,Z为S。C项,Na2S的水溶液呈碱性,可使红色石蕊试纸变蓝,错误。
3.(根据图表数据推断)(1)根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )A.E2-与B3+的核外电子数不可能相等B.离子半径大小:A+
解析:由表中数据可知,A为钠,B为铝,C为铍,D为硫,E为氧。
(2)如图是部分短周期元素原子半径与原子序数的关系图,下列说法正确的是( )A.最高价氧化物对应水化物的碱性:Z
解析:W、X、Y、Z是四种原子序数依次增大的短周期元素。a、b、c、d、e是由这些元素组成的化合物,气体a的水溶液呈碱性,a为氨气,则W为H元素;则X为N元素。c为红棕色气体,c为二氧化氮,根据流程图,m为氧气,b为一氧化氮,d为水,则Y为O元素,X为N元素,Z单质能够与水反应,则Z为Na元素,e是由W、Y、Z元素形成的化合物,为NaOH。电子层数越多,离子半径越大,电子层结构相同的离子,核电荷数越大,离子半径越小,简单离子半径:Z
(5)SiO2晶体熔化、液态SO3汽化均需克服分子间作用力。( )(6)Mg、MgO中镁元素的微粒半径:r(Mg2+)>r(Mg)。( )(7)常温常压下,18 g H2O中含有的原子总数为3NA。( )(8)AlN(原子晶体)和石英的化学键类型相同。( )(9)离子化合物中一定含有离子键。( )(10)单质分子中均不存在化学键。( )(11)含有共价键的化合物一定是共价化合物。( )(12)NaHCO3、HCOONa均含有离子键和共价键。( )
(13)结构和组成相似的物质,沸点随相对分子质量增大而升高,因而NH3沸点低于PH3。( )(14)第ⅠA族金属元素是同周期中金属性最强的元素。( )(15)同种元素的原子均有相同的质子数和中子数。( )(16)分子间作用力的大小决定分子稳定性的高低。( )(17)原子核外电子排布决定元素在周期表中的位置。( )(18)Ca(OH)2的碱性比Mg(OH)2的碱性强。( )(19)常压下,0 ℃时冰的密度比水的密度小,水在4 ℃时密度最大,这些都与分子间的氢键有关。( )
(20)12C18O和14N2同温同压下原子数相等时具有的中子数相等。( )(21)12C18O和14N2同温同压下,质量相等时具有的质子数相等。( )(22)CO2分子中的化学键为非极性键。( )(23)同主族元素含氧酸的酸性随核电荷数的增加而减弱。( )(24)酸性:H2SO3>H2SO4。( )(25)Cl-、S2-、Ca2+、K+半径逐渐减小。( )(26)热稳定性:HCl>HI。( )
02 电子式的规范书写1.电子式的书写(1)原子:一般先单后双。如:Na________;Mg________;Al________;Si________;P________;S________;Cl________;Ar________。(2)简单阳离子:写出元素符号,然后在其右上角标出电荷“n+”。如Na+、Mg2+、Al3+。
(5)共价分子:按原子间连接顺序将各原子的元素符号写出,然后将它们的最外层电子(包括得到和失去的一并分析)的共用和单独占有(孤电子对)情况在各元素符号周围标出。如:N2________;Cl2________;H2O________;NH3________;CO2________;H2O2________;HClO________;CH4________;CCl4________;HCHO________;HCOOH________;C2H4________。(6)离子化合物:将化学式中离子的电子式按连接顺序写在一起即可。如:MgCl2 ________;NaOH________;NH4Cl________;Na2O2 ________。
2.用电子式表示物质的形成过程(1)共价分子——左写原子的电子式(相同原子可合并),右写分子的电子式,中间用“―→”连接即可。如:N2:_______________________________________________________;NH3:______________________________________________________;CO2:______________________________________________________。
(2)离子化合物——左写原子的电子式(相同原子不可合并,因为要标出电子转移情况),用弯箭号标出电子转移情况。右写离子化合物的电子式,中间用“―→”连接即可。如:MgCl2:__________________________________________________;Na2S:____________________________________________________。答案:(2)
03 新素材命题与学科素养[命题新素材]2019年5月18日,作为中国科学院第十五届公众科学日的组成部分,科学院化学所,以“化学创造美好生活——纪念门捷列夫元素周期表发现150周年”作为主题,面向社会公众全方位开放,近2 000名参观者参与活动。
门捷列夫于1869年发现元素周期律,根据元素周期律,门捷列夫将一系列元素排队,绘制了第一张元素周期表。门捷列夫的元素周期表指出:元素的性质,随着原子量的增加呈周期性变化,但又不是简单的重复。门捷列夫根据这个道理,不但纠正了一些错误的原子量,还先后预言了15种以上未知元素的存在。
[设题新角度]问题1.根据以上材料可知,门捷列夫的元素周期律的具体规律是“元素的性质,随着原子量的增加呈周期性的变化,但又不是简单的重复”。此观点是否正确?为什么?(素养角度——科学探究与创新意识)答案:问题1 提示:不正确。原因是周期表是按照原子序数大小排列的,每一周期具有相同的电子层数,每一主族元素的价电子数相等、性质相似,同时按原子序数递增呈周期性变化。
问题2.门捷列夫在研究周期表时预言了包括“类铝”“类硅”在内的11种元素。(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。①已知主族元素锗的最高化合价为+4价,其最高价氧化物对应的水化物为两性氢氧化物。试比较元素Si与Ge的非金属性强弱。(素养角度——证据推理与模型认知)
②若锗位于硅的下一周期,则“锗”在周期表中的位置是什么?根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途。(素养角度——证据推理与模型认知)③硅和锗单质分别与H2反应时,反应较难进行的是哪种元素。(素养角度—证据推理与模型认知)答案:问题2 提示:(1)①Si的非金属性强于锗 ②第四周期第ⅣA族 可用作半导体材料 ③锗
2024届高考化学一轮复习课件 第五章 物质结构与性质、元素周期律 热点强化练4 元素位、构、性综合推断: 这是一份2024届高考化学一轮复习课件 第五章 物质结构与性质、元素周期律 热点强化练4 元素位、构、性综合推断,文件包含热点强化练4元素位构性综合推断pptx、热点强化练4元素位构性综合推断docx等2份课件配套教学资源,其中PPT共14页, 欢迎下载使用。
苏教版高考化学一轮复习9有机化学基础核心素养提升9有机综合推断题突破策略课件: 这是一份苏教版高考化学一轮复习9有机化学基础核心素养提升9有机综合推断题突破策略课件,共40页。
苏教版高考化学二轮复习5微观结构与物质的多样性核心素养提升5元素的综合推断课件: 这是一份苏教版高考化学二轮复习5微观结构与物质的多样性核心素养提升5元素的综合推断课件,共35页。PPT课件主要包含了答案C等内容,欢迎下载使用。












