




2022高三化学一轮复习 第四章 第14讲 硫及其化合物课件
展开考点 1 硫及其氧化物一、硫1.硫元素的存在形态
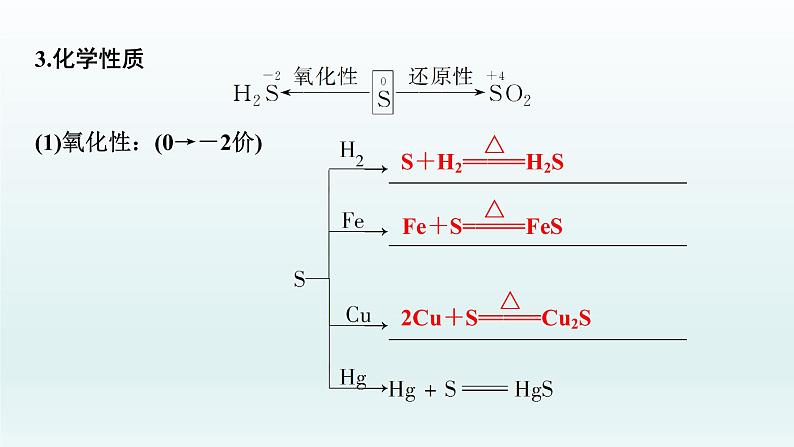
3.化学性质(1)氧化性:(0→-2价)
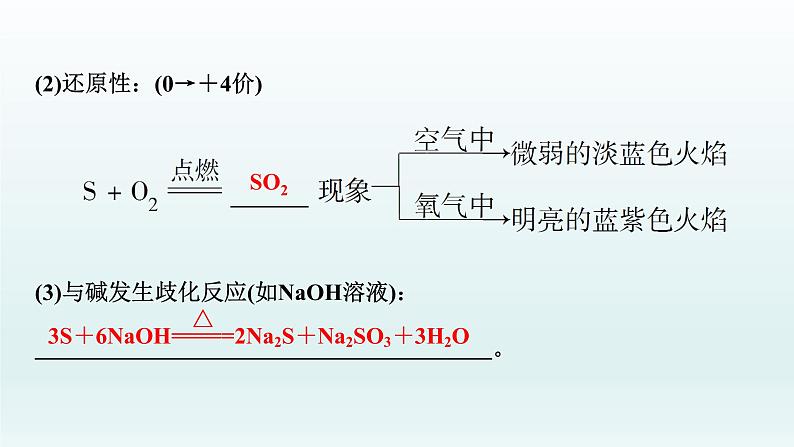
(2)还原性:(0→+4价)(3)与碱发生歧化反应(如NaOH溶液): 。
二、硫的氧化物1.二氧化硫(SO2)(1)物理性质二氧化硫是无色、有刺激性气味的有毒气体,是大气污染物之一;易溶于水,通常状况下,1体积水溶解约40体积SO2。
(2)化学性质①酸性氧化物的通性:
SO2+NaOH===NaHSO3
SO2+2NaOH===Na2SO3+H2O
②弱氧化性:(S:+4→0价) 。
SO2+2H2S===3S↓+2H2O
③强还原性:(S:+4→+6价)
SO2+Br2+2H2O===H2SO4+2HBr
Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
2.三氧化硫SO3在标准状况下为无色、针状晶体,能与水反应:____________________,放出大量的热,SO3是_____氧化物,它跟碱性氧化物或碱都能反应生成硫酸盐。
SO3+H2O===H2SO4
3.硫的氧化物对大气的污染与防治
1.从以下两个角度探究硫单质性质的应用。(1)从物理性质和化学性质两个角度简要阐述,如何洗涤附着在试管内壁上的硫?(2)你有哪些实例(证据)可以推知(推理)硫的氧化性比氯气的弱。____________________________________________________________________________________________________________________________
2.(1)SO2、Cl2分别通入石蕊溶液中,现象相同吗?(2)把Cl2和SO2混合在一起通入品红溶液,溶液一定会褪色吗?____________________________________________________________________________________________________________________________提示:(1)SO2通入石蕊溶液中,溶液只变红色,而Cl2通入该溶液中则先变红后又褪色。(2)不一定;SO2和Cl2虽然都能漂白品红溶液,但由于两者发生反应SO2+Cl2+2H2O===H2SO4+2HCl,两者等物质的量混合时,漂白性消失。
(1)硫在自然界中仅以化合态存在。( )(2)硫在空气中燃烧的产物是二氧化硫,在纯氧中燃烧的产物是三氧化硫。( )(3)硫黄易溶于CS2,所以可用CS2溶解试管内壁的硫。( )(4)SO2有漂白性,所以SO2可使溴水褪色。( )(5)SO2气体通入BaCl2溶液产生白色沉淀BaSO3。( )
(6)SO2和Cl2等物质的量混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好。( )(7)SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同。( )
1.学科思想:SO2化学性质的归纳与整合
3.易错提醒:SO2性质的易错易混点归纳(1)SO2不能漂白酸碱指示剂,只能使紫色的石蕊溶液变红,但不能使之褪色。(2)SO2能使溴水、酸性KMnO4溶液褪色,体现了SO2的还原性,而不是漂白性。(3)SO2、CO2通入BaCl2溶液中都不会产生沉淀。
题组一 硫的存在和性质1.有关硫元素循环说法不合理的是( )A.煤、石油中的硫元素燃烧时能生成SO2B.动物尸体腐败过程产生的H2S气体会进入大气C.循环过程中硫元素既发生氧化反应又发生还原反应D.大气中的硫元素会全部转化成H2SO4随雨水降落到土壤里
2.下列物质,不能由单质直接化合生成的是( )①CuS ②FeS ③SO3 ④H2S ⑤FeCl2A.①③⑤ B.①②③⑤C.①②④⑤ D.全部
题组二 SO2的多重性3.(1)在BaCl2溶液中通入SO2气体,未见沉淀生成,若再通入下列四种气体①Cl2、②NH3、③NO2、④H2S,均会产生沉淀。回答下列问题:a.通入四种气体时产生的沉淀分别是:①________;② ________;③________;④________。b.用方程式表示①和④产生沉淀的原因:①________________________________________________________;④________________________________________________________。
答案:(1)a.①BaSO4 ②BaSO3 ③BaSO4 ④Sb.①Ba2++SO2+Cl2+2H2O===BaSO4↓+2Cl-+4H+ ④SO2+2H2S===3S↓+2H2O
(2)将SO2分别通入下列四种溶液中,溶液都褪色。请回答下列问题:①a、b、c、d四支试管中的现象体现SO2的性质分别为_______________________________________________________________________。②加热又恢复颜色的试管为________(填试管代号)。答案:(2)①还原性、漂白性、酸性、还原性 ②b
题组三 SO2的检验4.(1)检验SO2的常选试剂为__________,现象为_________________。(2)下列实验中能证明某气体为SO2的是________(填序号)。①使澄清石灰水变浑浊;②使品红溶液褪色;③通入溴水中,能使溴水褪色,再滴加BaCl2溶液有白色沉淀产生。答案:(1)品红溶液 溶液褪色,加热又恢复红色(2)③
(3)气体A是SO2与CO2的混合气体,用如图装置进行检验,按要求回答下列问题。①B、C、D加入的试剂分别为_________________________________。②实验时,C中应观察到的现象是______________________________。答案:(3)①品红溶液、酸性KMnO4溶液、澄清石灰水 ②酸性KMnO4溶液的颜色变浅但不褪成无色(或不褪色,或不褪成无色)
方法二:氨水脱硫法该脱硫法采用喷雾吸收法,雾化的氨水与烟气中的SO2直接接触吸收SO2,其反应的化学方程式为2NH3+SO2+H2O===(NH4)2SO3,2(NH4)2SO3+O2===2(NH4)2SO4。(或生成NH4HSO3,然后进一步氧化)方法三:钠碱脱硫法用NaOH/Na2CO3吸收烟气中的SO2,得到Na2SO3和NaHSO3,发生反应的化学方程式为2NaOH+SO2===Na2SO3+H2O,Na2CO3+SO2===Na2SO3+CO2,Na2SO3+SO2+H2O===2NaHSO3。
阅读上述材料,回答下列问题:(1)如图所示,硫酸工业中产生的SO2通过下列过程既能制得H2SO4又能制得H2。请回答:①该过程可循环利用的物质是________(写化学式)。②该过程总反应的化学方程式为_______________________________。答案:(1)①I2和HI ②SO2+2H2O===H2SO4+H2
海水吸收烟气中SO2的原因为__________________________________。排放的废水中含硫微粒主要为_________________________________。
考点 2 硫酸 硫酸根离子的检验1.硫酸的物理性质(1)硫酸是一种油状液体,难挥发。(2)溶解性:浓H2SO4与水以任意比互溶,溶解时可放出大量热。(3)稀释方法:将________沿器壁慢慢注入____中并用玻璃棒不断搅拌。
Zn+H2SO4===ZnSO4+H2↑
BaSO3+2H+===Ba2++SO2↑+H2O
1.根据浓硫酸的性质,填写表格:
提示:1.蓝色固体变白 吸水性 沾有浓H2SO4的滤纸变黑 脱水性 铜片逐渐溶解,产生无色刺激性气味的气体 强氧化性
2.对重要硫酸盐填写表格:
提示:2.2CaSO4·H2O CaSO4·2H2O 绿矾 芒硝 KAl(SO4)2·12H2O
题组一 硫酸的性质1.浓硫酸分别与三种钠盐反应,现象如图。下列分析正确的是( )A.对比①和②可以说明还原性:Br->Cl-B.①和③相比可说明氧化性:Br2>SO2C.②中试管口白雾是HCl遇水蒸气所致,说明酸性:H2SO4>HClD.③中浓H2SO4被还原成SO2
解析:A项,反应①生成的红棕色气体是溴蒸气,反应②白雾是氯化氢,说明浓硫酸能将溴离子氧化成溴单质,而不能将氯离子氧化成氯气;B项,反应③生成的二氧化硫气体,非氧化还原反应,而且亚硫酸钠与溴化钠不是同一类型;C项,白雾说明氯化氢易挥发;D项,反应③生成的是二氧化硫气体,非氧化还原反应。
2.硫酸是中学化学实验室的常见药品,其性质有①酸性②吸水性 ③脱水性 ④强氧化性 ⑤催化作用,请将序号填在相应的横线上:(1)锌和稀H2SO4制H2________; (2)浓硫酸做干燥剂________;(3)实验室用乙醇和冰醋酸制取乙酸乙酯________;(4)乙酸乙酯的水解________; (5)纤维素的水解________;(6)浓硫酸与铜的反应________;(7)浓硫酸使湿润石蕊试纸变红,后来又变黑_______。答案:(1)① (2)② (3)②⑤ (4)⑤ (5)⑤ (6)①④ (7)①③
3.将适量的蔗糖(C12H22O11)放入烧杯,滴入几滴水,搅拌均匀,然后加入适量的浓硫酸。可观察到固体变黑,片刻后,黑色物质急剧膨胀,同时产生大量刺激性气味的气体,放出大量的热(如图所示)。
答案:(1)脱水 (2)①SO2 ②不能 SO2也可使澄清石灰水变浑浊 ③CO2↑+2SO2↑+2H2O
题组二 硫酸根离子的检验4.有一瓶Na2SO3溶液,可能已氧化变质,请根据要求设计实验验证以下情况:(1)Na2SO3溶液未变质:__________________________________________________________________________________________________。(2)Na2SO3溶液已完全变质:__________________________________。(3)Na2SO3部分变质:____________________________________________________________________________________________________。
答案:(1)取溶液少许置于试管中,加入盐酸酸化后再加BaCl2溶液,不生成白色沉淀,说明未变质(2)取溶液少许置于试管中,加入盐酸酸化,不产生气泡,滴入品红溶液,不褪色,说明已完全变质(3)取溶液少许置于试管中,加入盐酸酸化后,向所得溶液中滴入品红溶液,褪色,向所得溶液中滴入BaCl2溶液,生成白色沉淀,说明Na2SO3溶液部分变质
题组三 有关浓硫酸与金属反应的计算5.将一定量的锌与100 mL 18.5 ml/L 浓硫酸充分反应后,锌完全溶解,同时生成气体A 33.6 L(标准状况)。将反应后的溶液稀释至 1 L,测得溶液的pH=1,则下列叙述错误的是( )A.气体A为SO2和H2的混合物B.反应中共消耗Zn 97.5 gC.气体A中SO2和H2的体积比为4∶1D.反应中共转移3 ml 电子
考点 3 硫及其化合物的转化1.硫的价态——类别二维图
2.硫及其化合物之间的转化规律(1)相同价态硫的转化是通过酸、碱反应实现的如:反应②、③、④的化学方程式为②_________________________________;③______________________________________;④________________________________。
H2SO3+2NaOH===Na2SO3+2H2O
Na2SO3+H2SO4===Na2SO4+H2O+SO2↑
Na2SO3+H2O+SO2===2NaHSO3
1.硫是生物必需的营养元素之一,下列关于自然界中硫循环(如图所示)说法正确的是( )A.含硫杆菌及好氧/厌氧菌促进了硫的循环B.硫循环中硫的化合物均为无机物C.上述硫循环中硫元素均被氧化D.烧煤时加石灰石,可减少酸雨及温室气体的排放
2.含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品;该工艺流程如图所示,下列叙述不正确的是 ( )A.该过程中可得到化工产品H2SO4B.该工艺流程是除去煤燃烧时产生的SO2C.该过程中化合价发生改变的元素只有Fe和SD.图中涉及的反应之一为Fe2(SO4)3+SO2+2H2O===2FeSO4+2H2SO4
解析:根据工艺流程图可知,该工艺中Fe2(SO4)3溶液吸收SO2生成FeSO4和H2SO4,该反应的化学方程式为Fe2(SO4)3+SO2+2H2O===2FeSO4+2H2SO4,该工艺不仅吸收了二氧化硫,还得到了化工产品硫酸,A、D两项正确;根据A中分析可知该工艺流程是除去煤燃烧时产生的SO2,B项正确;该过程中化合价发生变化的元素有氧、铁、硫,C项错误。
4.物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据如图所示,回答下列问题:
(1)X的化学式为________,Y的化学式为________。(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为 _____________________________________________________________________________________________________________。(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填字母)。A.Na2S+S B.Na2SO3+SC.Na2SO3+Na2SO4D.SO2+Na2SO4(4)将X与SO2混合,可生成淡黄色固体,该反应的氧化产物与还原产物的质量之比为________。
1.(2020·高考全国卷Ⅰ)下列气体去除杂质的方法中,不能实现目的的是( )
解析:酸性高锰酸钾溶液不仅能与H2S反应,而且也能与SO2反应,A项不能实现目的。
2.判断正误,正确的打“√”,错误的打“×”。(1)(2019·浙江4月选考,11B)在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色。( )(2)(2019·浙江4月选考,11C)向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀。( )(3)(2019·浙江4月选考,8D)硫元素在自然界的存在形式有硫单质、硫化物和硫酸盐等。( )(4)(2018·浙江11月选考,8D)接触法制硫酸的硫元素主要来源于硫黄或含硫矿石。( )
3.(2017·高考全国卷Ⅰ)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是( )A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以B.氢硫酸的导电能力低于相同浓度的亚硫酸C.0.10 ml·L-1的氢硫酸和亚硫酸的pH分别为4.5 和2.1D.氢硫酸的还原性强于亚硫酸
解析:A能,氢硫酸不能与NaHCO3溶液反应,说明酸性:H2S
2022高考化学一轮复习第4章非金属及其化合物第4讲硫及其重要化合物课件: 这是一份2022高考化学一轮复习第4章非金属及其化合物第4讲硫及其重要化合物课件,共60页。PPT课件主要包含了知识点1,知识点2,浓硫酸,玻璃棒,强氧化,知识点3等内容,欢迎下载使用。
人教版2022届高中化学一轮复习课件 第13讲 硫及其化合物: 这是一份人教版2022届高中化学一轮复习课件 第13讲 硫及其化合物,共60页。PPT课件主要包含了考点透视,栏目导航,课堂评价,考前8min,向上排空气法,三颈烧瓶,检查装置气密性,白色沉淀,四氯化碳,橙黄色等内容,欢迎下载使用。
2022高考化学一轮复习 第四章 第14讲 硫及其化合物课件PPT: 这是一份2022高考化学一轮复习 第四章 第14讲 硫及其化合物课件PPT,共60页。PPT课件主要包含了硫化物,硫酸盐,物理性质,SO2,④漂白性,恢复红色,浓硫酸,浓硫酸的特性等内容,欢迎下载使用。












