人教版 (新课标)选修5 有机化学基础第二章 烃和卤代烃综合与测试学案设计
展开1、了解烷烃、烯烃、炔烃的物理性质的变化与分子中碳原子数目的关系;
2、能以典型代表物为例,理解烷烃、烯烃、炔烃和卤代烃等有机化合物的化学性质;
3、能根据有机化学反应原理,初步学习实验方案的设计、评价、优选并完成实验;
4、在实践活动中,体会有机化合物在日常生活中的重要应用,同时关注有机物的合理使用。
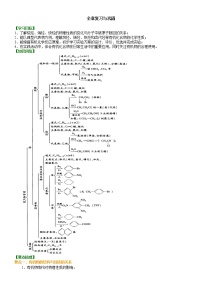
【知识网络】
【要点梳理】
要点一、有机物的结构与性质的关系
1、有机物结构对物理性质的影响。
①组成与结构相似的物质,相对分子质量越大,熔、沸点越高。相对分子质量相近或相同时,支链越多,熔点越低;在不考虑对称结构的分子式前提下,沸点也越低(结构对称的化合物的沸点一般比相同相对分子质量的化合物高)。
②组成与结构不相似的物质,当相对分子质量相近或相同时,分子的极性越大,熔、沸点越高。
③有机物一般不溶于水,而易溶于有机溶剂。但当有机物分子的极性较大时,则可溶于水,如乙醇、乙醛、乙酸等均可溶于水。
2、有机物的结构对化学性质的影响。
①有机物的性质由其分子结构决定,而官能团是决定有机物化学性质的主要因素,一般地,具有相同官能团的有机物具有相似的化学性质,有机物含有多个官能团时,也应具有多个官能团的性质。
②分子作为一个整体,组成的各原子或原子团之间存在着相互影响。尤其是相邻的原子或原子团之间的影响较大。如中,由于苯环对羟基(—OH)的影响,使得的—OH更活泼,表现出弱酸性;由于—OH对苯环的影响,使得的苯环上2,4,6位的氢原子更活泼,室温下就能与浓溴水发生取代反应,生成(三溴苯酚)白色沉淀。
要点二、乙烷、乙烯、乙炔的结构和性质的比较
各类烃与液溴、溴水、酸性KMnO4溶液反应的比较
要点三、重要的有机化学反应
熟练掌握本章中所学的取代、加成、消去、氧化和加聚等反应,包括反应条件、反应类型、方程式的书写、反应条件的选择等,尤其是单体与加聚产物的相互推导,由以前的定性推断发展为定量计算,更应引起重视。
常见的烃的相互转化关系图。
要点四、烃类的重要规律及其应用。
1、等量的烃完全燃烧时耗氧量的计算。
①等物质的量的烃完全燃烧时耗氧量的计算。
对于等物质的量(1 m1)的烃CxHy完全燃烧时,消耗氧气的物质的量为ml,若的值越大,消耗氧气的物质的量也越大。
②等质量的烃完全燃烧时耗氧量的计算。
等质量的烃CxHy完全燃烧时,若烃分子中氢元素的质量分数越大,其耗氧量也越大。即若的值越大。则该烃完全燃烧时的耗氧量也越大。
2、烃分子含氢原子数恒为偶数,其相对分子质量恒为偶数。
应用:如果你求得的烃分子(烃基除外)所含H原子数为奇数或相对分子质量为奇数,则求算一定有错。
请想一想:有机物CxHyOa、CxHyXa(X代表F、Cl、Br、I等卤素),其分子内的氢原子数、相对分子质量是奇数还是偶数?
3、烃燃烧反应中烃前配平化学计量数的变化规律。
设m、n、p、q为正整数,对mCxHy+nO2pCO2+qH2O(设已配平),其中烃前配平化学计量数只有两种可能:非l即2。①当y/2=偶数时,则m=1;②当y/2=奇数时,则m=2。
如:配平C6H6和C3H8分别完全燃烧反应的方程式。
因6/2=3(奇数),烃前配平化学计量数为2;因8/2=4(偶数),烃前配平化学计量数为1,可速得:
2C6H6+15O212CO2+6H2O
C3H8+5O23CO2+4H2O
4、燃烧前后气体体积大小变化规律。
对mCxHy+nO2pCO2+qH2O,若水为气体,则:
当y=4时,反应前后体积相等;
当y>4时,反应后气体体积>反应前气体体积:
当y<4时,反应后气体体积<反应前气体体积。
燃烧前后体积的变化只与H原子数有关。
5、烃类混合物燃烧的耗氧量规律。
①最简式相同的有机物,无论以何种比例混合。只要混合物的质量一定,完全燃烧后生成的CO2、H2O的量为定值,耗氧量也为定值。
②混合物总质量一定,只要含碳(或氢)的质量分数一定,生成CO2(或H2O)的量就相同,但耗氧量可能不同。
【典型例题】
类型一、烃的燃烧及有关计算
例1 现有CH4、C2H4、C2H4、C3H6、C3H8五种有机物,同质量的以上物质中,在相同状况下体积最大的是________;同质量的以上物质完全燃烧时耗O2的量最多的是________;同状况、同体积的以上物质完全燃烧时耗O2的量最多的是________;同质量的以上物质完全燃烧时,生成的CO2最多的是________,生成的水最多的是________。在120℃,1.01×105 Pa时,以上气态烃和足量的O2点燃完全燃烧,相同条件下测得反应前后气体体积没有发生变化的是________。
【思路点拨】等质量的五种气体,摩尔质量越大则气体的物质的量越大,在相同状况下体积也越大;分析烃燃烧的通式,可得出耗氧情况。
【答案】CH4 CH4 C3H8 C2H4、C3H6 CH4 CH4、C2H4
【解析】(1)同质量的以上烃完全燃烧,体积大小取决于气体的物质的量,所以应选CH4,当的值越大,耗氧量越多,生成的H2O的物质的量越大,CO2的物质的量越少。
(2)相同条件下,同体积、同物质的量的烃完全燃烧,耗氧量取决于的相对大小,当水为气态时,y=4,燃烧前后体积不变。
【总结升华】本题重点考查了烃的燃烧规律和计算,是本章的重点,同时也是高考的热点,解题关键是熟练掌握方程式的不同写法和燃烧规律。
举一反三:
【变式1】某气态烃在密闭容器中与氧气混合完全燃烧,若燃烧前后容器压强保持不变(120℃),则此气态烃是( )
A.C2H6 B.C2H4
C.C2H2 D.C3H8
【答案】B
类型二、烃和卤代烃的结构及性质
例2 下图表示4—溴环己烯所发生的4个不同反应。其中,产物只含有一种官能团的反应是
A.①② B.②③ C.③④ D.①④
【思路点拨】本题考查的是烯烃和卤代烃的性质及反应条件对有机反应产物的影响。注意所给物质的结构,根据题给条件确定发生反应的类型及产物结构特点。
【答案】C
【解析】题目给出的反应物(4—溴环己烯)中的碳碳双键会被①中酸性高锰酸钾溶液氧化,产物中会含有两种官能团,不合题意;反应②实质为碳碳双键与水的加成反应,产物中因为引入羟基所以会含有两种官能团,不合题意;反应③是卤代烃的消去反应,生成物中只含有碳碳双键一种官能团;反应④是不饱和有机化合物与HBr的加成反应,生成物中只含有“-Br”一种官能团。所以只有C选项满足题意。
【总结升华】本题考查了烯烃的化学性质:如双键能被氧化剂氧化、能与H2O加成、能与HX加成,以及卤代烃的化学性质:卤代烃的水解与消去的条件及产物;因此掌握常见官能团的化学性质是学好有机化学的关键。如果能在学习过程中从不同角度分类整理、对比记忆,会使有机化学的知识树更牢固,并且解题速度也会相应有大幅提高。
例3 从环己烷可制备1,4-环己二醇的二醋酸酯,下面是有关的8步反应(其中所有无机产物都已略去):
其中有3步属于取代反应,2步属于消去反应,3步属于加成反应。
(1)反应①、________和________属于取代反应。
(2)化合物的结构简式是B________,C________。
(3)反应④所用的试剂和条件是________。
【答案】(1)⑥⑦
【解析】本题通过一个多步转化反应流程命题,将若干有机反应组合起来,考查考生对常见的几类官能团的性质的掌握情况。对考生的逻辑思维能力,考虑问题的有序性,及善于借用已知条件的能力作了全面的考核。
仔细观察各步,虽然没有设问A~D 4种化合物的全部,也没有设问8个反应的全部,但要解本题,还是应通盘考虑。
本题步骤虽多,但条件很充分,可以通过前后物质的结构式,反应条件来推断出结果。
①氯代,也是取代反应;②消去HCl,A是环己烯( );③是加成,产物B是;④是消去2个HCl,产物已知是 ;⑤是1,4-加成,产物已知是;⑥是取代,产物是C,为;⑦是酯化,也是取代,产物D是;⑧是加氢,属于加成,产物是终产物(已知)。
上述结论中有2个难点,一是⑥、⑦、⑧三个反应,有个先后问题,因为⑦已经写明了反应试剂,所以这一步是酯化(取代)反应,它要求产物C提供—OH,因此⑥应该是卤代烃水解(也是取代)。这样反应⑧中才是加氢,使之饱和;再一个是反应用什么试剂和条件,要写完整,不容易记得很准确,但是题目中反应②也是消去,可以将它的反应试剂和条件完整的移植过来。
(2)
(3)浓NaOH、醇,△
举一反三:
【变式1】下列有机分子中,所有的原子不可能处于同一平面的是( )
A、CH2=CH-CN B、CH2=CH-CH=CH2
C、 D、
【答案】D
【解析】A项,所有原子一定处于同一平面;B项所有原子可能处于同一平面,注意中间的碳碳单键可以旋转;C项所有原子可能处于同一平面,苯环与乙烯基间的单键可以旋转;D项可通过甲基判断不可能在同一平面。
【变式2】某液态烃,它不跟溴水反应,但能使KMnO4酸性溶液褪色。将其0.5 ml完全燃烧生成的CO2通入含5ml NaOH的溶液中,所得碳酸钠和碳酸氢钠的物质的量之比为1:3 。则该烃是( )
A、1-丁烯 B、甲苯
C、1,3-二甲苯 D、2-甲基-3-乙基-2-戊烯
【答案】C
【解析】根据所给物质的性质判断,应该属于苯的同系物,排除AD;生成的CO2通入NaOH的溶液中,根据生成产物的比例关系,判断出CO2是4ml,即烃中所含C原子数是8个。
类型三、有机实验
例4 1,2-二溴乙烷可做汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18 g/cm3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学方程式:________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞,请写出堵塞时瓶b中的现象:________。
(3)容器c中NaOH溶液的作用是________________。
(4)某学生在做此实验时,使用一定量的溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况超出许多,如果装置的气密性没有问题,试分析其可能的原因。
【思路点拨】本题的装置图中有两个制备装置,一是抽取乙烯,另一个是利用生成的乙烯制备1,2-二溴乙烷分别考查了乙烯的制备和加成反应的性质,注意安全瓶b在此处的作用。
【答案】(1)CH3CH2OHCH2=CH2↑+H2O CH2=CH2+Br2—→CH2Br—CH2Br
(2)b中水面会下降,玻璃管中的水面会上升,甚至溢出
(3)除去乙烯中带出的酸性气体(或答除去CO2、SO2)
(4)①乙烯产生(或通过液溴)速度过快;②实验过程中,乙醇和浓硫酸的混合液的温度没有迅速升至170℃(或写控温不当也可以)
【解析】本题将两个有机制备实验联系起来综合组题。在考查一些典型有机反应的基础上着重考查考生灵活运用所学知识以及分析实验结果得出正确结论的能力,并且将从平时学习中获得的观察能力和分析能力纳入这一实验试题中。此外,实验也考查了安全操作,题中装置生疏,好像很难,但一步一步地思考下去却不难对试题作出回答。
(1)由乙醇在浓硫酸存在下制取乙烯,再由乙烯与溴反应制取1,2-二溴乙烷是两个很常见的有机反应,书写有关的化学方程式应当没有困难,但关键是要注意第一个化学方程式的反应温度以及有机物必须写结构简式。
CH3CH2OHCH2=CH2↑+H2O
CH2=CH2+Br2—→CH2Br—CH2Br
(2)由于1,2-二溴乙烷的熔点为9.79℃,要注意试管d外的冷水温度如果低于此熔点,就会使得1,2-二溴乙烷在试管d中凝固,发生堵塞现象,使试管d和它前面的容器a和b中的乙烯因排不出去而造成压强增大,将安全瓶b内的水压入长玻璃管里,使玻璃管中水柱液面上升甚至溢出,当然与此同时瓶b内的水面当略有下降。
(3)在乙醇在浓硫酸存在下制乙烯的反应中,除了可认为浓硫酸是脱水刑和催化剂外,浓硫酸还是一种强氧化剂。作为副反应,它还跟乙醇发生氧化还原反应,因而有SO2、CO2等副产物(酸性气体)生成。它们混入主产物乙烯中,因此瓶c内用NaOH溶液洗涤乙烯气体是为了除去乙烯中带出的酸性气体(或答除去SO2、CO2等)。
(4)由乙醇和浓硫酸反应制乙烯,要求将温度迅速升至170℃,如果不能迅速升温,过多地停留在140℃左右,将会有较多的乙醚生成;若温度过高,则又可以使乙醇与浓硫酸发生氧化还原反应生成较多的酸性气体(SO2、CO2)等副产品,这些都会造成原料消耗过多。本实验中乙烯与溴的反应是气体和液体之间的反应。如果乙烯产生得过快,将会来不及充分反应,使乙烯白白逸出,这也会使原料的消耗增大。
综上所述,本小题的答案可以概括为:
①乙烯产生(或通过液溴)速度过快:
②实验过程中,乙醇和浓硫酸的混合液的温度没有迅速升至170℃(或答控温不当也对)。
【总结升华】本题容易出现的错误有三:一是方程式书写不规范,反应条件不正确;二是不了解安全瓶及其相关现象,不能将物理学中的压强知识迁移到化学实验中来;三是不能全面正确地回答出造成生成物产率不高的原因,反映出平时学习中不能严格要求,相关学科知识不能灵活运用,整体思维水平不高,缺乏创造性思维能力等,要引起注意。
举一反三:
【变式1】实验室用溴和苯反应制取溴苯,得到粗溴苯后,要用如下操作精制:①蒸馏;②水洗;③用干燥剂干燥;④10% NaOH 溶液洗;⑤水洗。正确的操作顺序是( )
A、①②③④⑤ B、②④⑤③① C、④②③①⑤ D、②④①⑤③
【答案】B
【解析】先用水洗,FeBr3溶于水而被洗去;再用NaOH溶液洗,溴与NaOH溶液反应生成易溶于水的盐(NaBr和NaBrO)而被洗去;第二次用水洗时有效地除去残存在有机物中易溶于水的杂质;干燥时少量的水被除去,最后蒸馏时将溴苯中的苯分离出去(利用两者沸点的差异)。结构、性质
乙烷
乙烯
乙炔
结构简式
CH3—CH3
CH2=CH2
CH≡CH
结构特点
全部为单键;饱和链烃;正四面体型结构
含碳碳双键;不饱和链烃;平面型分子,键角120°
含碳碳三键;不饱和链烃;直线型分子,键角180°
物理性质
无色气体,难溶于水而易溶于有机溶剂,密度比水小
——
——
化
学
性
质
化学活动性
稳定
活泼
活泼
取代反应
光卤代
——
——
加成反应
——
能与H2、X2、HX、H2O、HCN等发生加成反应
氧化反应
燃烧火焰较明亮
燃烧火焰明亮,带黑烟
燃烧火焰很明亮,带浓黑烟
不与酸性KMnO4溶液反应
使酸性KMnO4溶液褪色
使酸性KMnO4溶液褪色
加聚反应
不能反应
能反应
能反应
鉴别
不能使溴水褪色;不能使酸性KMnO4溶液褪色
能使溴水褪色;能使酸性KMnO4溶液褪色
物质类别
液溴
溴水
酸性KMnO4溶液
烷烃
光照条件下取代
不反应,液态烷烃可将溴萃取褪色
不反应
烯烃
加成
加成褪色
氧化褪色
炔烃
加成
加成褪色
氧化褪色
苯
一般不反应,催化下可取代
不反应,苯可将溴萃取褪色
不反应
苯的同系物
一般不反应,催化下可取代
不反应,苯的同系物可将溴萃取褪色
氧化褪色
反应类型
定义
举例(反应的化学方程式)
取代反应
有机物分子里的原子或原子团被其他原子或原子团所代替的反应
加成反应
有机物分子中不饱和原子之间的部分化学键断开,不饱和原子与其他原子或原子团直接结合生成新的化合物的反应
CH2=CH2+Br2—→CH2Br—CH2Br
聚合反应
由相对分子质量较小的化合物分子相互结合成相对分子质量较大的高分子的反应。聚合反应包括加聚反应和缩聚反应
消去反应
有机物在一定条件下,从一个分子中脱去一个小分子(如H2O、HBr等),而生成不饱和(含双键或三键)化合物的反应
CH3CH2OHCH2=CH2↑+H2O
CH3—CH2Br+NaOHCH2=CH2↑+NaBr+H2O
氧化反应
有机物得氧或失氢的反应
2CH3CH2OH+O22CH3CHO+2H2O
2CH3CHO+O22CH3COOH
高中化学第五章 进入合成高分子化合物的时代综合与测试导学案: 这是一份高中化学第五章 进入合成高分子化合物的时代综合与测试导学案,共6页。学案主要包含了学习目标,知识网络,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。
高中化学第五章 进入合成高分子化合物的时代综合与测试导学案: 这是一份高中化学第五章 进入合成高分子化合物的时代综合与测试导学案,共6页。学案主要包含了学习目标,知识网络,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。
人教版 (新课标)选修5 有机化学基础第四章 生命中的基础有机化学物质综合与测试学案及答案: 这是一份人教版 (新课标)选修5 有机化学基础第四章 生命中的基础有机化学物质综合与测试学案及答案,共6页。学案主要包含了学习目标,知识网络,要点梳理,典型例题,思路点拨,总结升华等内容,欢迎下载使用。