

【鲁科版】高考化学一轮复习课时作业10铁及其重要化合物(含解析)
展开铁及其重要化合物
(本栏目内容,在学生用书中以独立形式分册装订!)
1.(2019·广东揭阳调研)录音磁带是在醋酸纤维、聚酯纤维等纤维制成的片基上均匀涂上一层磁性材料——磁粉制成的。制取该磁粉的主要物质是( )
A.FeO B.Fe2O3
C.Fe3O4 D.Al2O3
C [Fe3O4具有磁性。]
2.铁是人类应用较早,当前应用量最大的金属元素。下列有关铁及其化合物的说法中正确的是( )
A.赤铁矿的主要成分是Fe3O4
B.铁与水蒸气在高温下的反应产物为Fe2O3和H2
C.除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤
D.Fe3+ 与KSCN产生红色沉淀
C [赤铁矿的主要成分是Fe2O3;铁与水蒸气在高温下的反应产物为Fe3O4和H2;Fe3+遇KSCN溶液变为红色,但没有沉淀产生,一般可以用此方法检验Fe3+的存在。]
3.下列事实不能证明Fe3+有氧化性的是( )
A.电子工业上用FeCl3溶液腐蚀电路板上的铜
B.FeCl3溶液滴在淀粉KI试纸上,试纸变为蓝色
C.将KSCN溶液加入FeCl3溶液中,溶液变为血红色
D.将H2S气体通入FeCl3溶液中,产生淡黄色沉淀
C [A项中2Fe3++Cu===Cu2++2Fe2+;B项中2Fe3++2I-===2Fe2++I2;D项中H2S+2Fe3+===S↓+2Fe2++2H+,只有C项中Fe3+在反应中化合价未发生改变,不具有氧化性,选C。]
4.为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,其中实验方案设计错误的是( )
A.④ B.③
C.③④ D.①②③④⑤
C [实验③中溶液应变为浅蓝色;实验④与Fe3+的性质无关。]
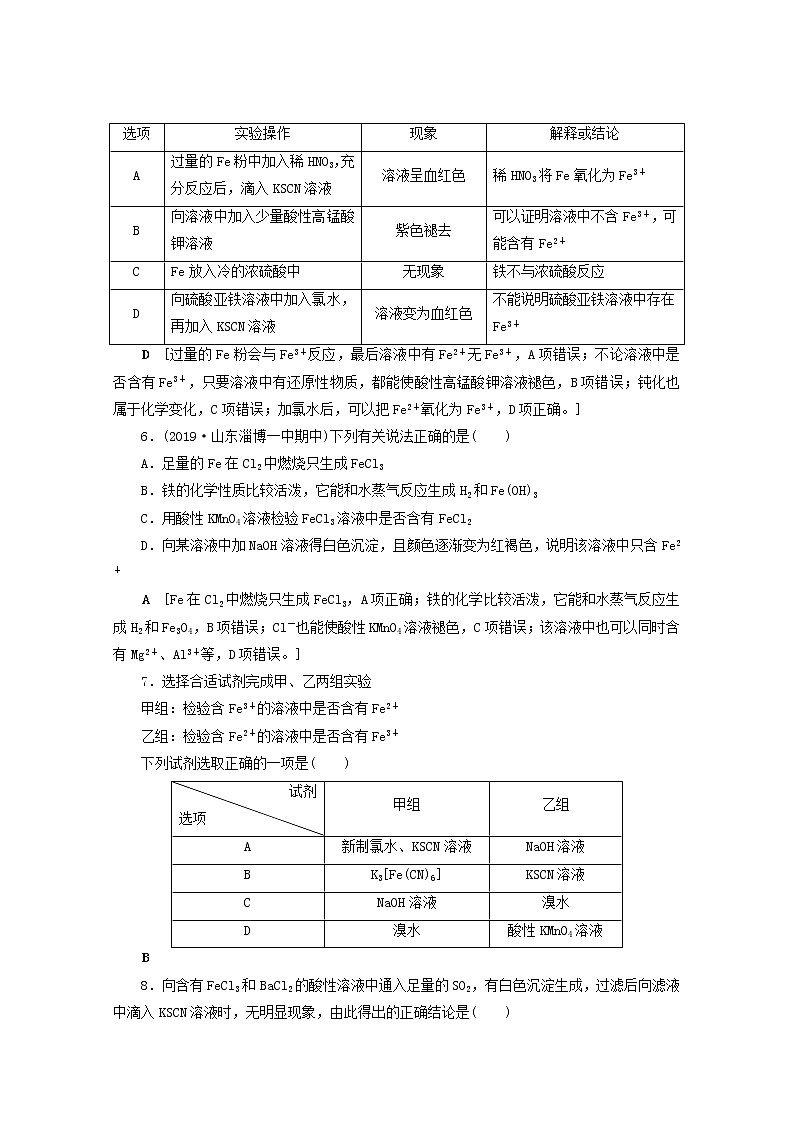
5.下列有关实验操作、现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 | 溶液呈血红色 | 稀HNO3将Fe氧化为Fe3+ |
B | 向溶液中加入少量酸性高锰酸钾溶液 | 紫色褪去 | 可以证明溶液中不含Fe3+,可能含有Fe2+ |
C | Fe放入冷的浓硫酸中 | 无现象 | 铁不与浓硫酸反应 |
D | 向硫酸亚铁溶液中加入氯水,再加入KSCN溶液 | 溶液变为血红色 | 不能说明硫酸亚铁溶液中存在Fe3+ |
D [过量的Fe粉会与Fe3+反应,最后溶液中有Fe2+无Fe3+,A项错误;不论溶液中是否含有Fe3+,只要溶液中有还原性物质,都能使酸性高锰酸钾溶液褪色,B项错误;钝化也属于化学变化,C项错误;加氯水后,可以把Fe2+氧化为Fe3+,D项正确。]
6.(2019·山东淄博一中期中)下列有关说法正确的是( )
A.足量的Fe在Cl2中燃烧只生成FeCl3
B.铁的化学性质比较活泼,它能和水蒸气反应生成H2和Fe(OH)3
C.用酸性KMnO4溶液检验FeCl3溶液中是否含有FeCl2
D.向某溶液中加NaOH溶液得白色沉淀,且颜色逐渐变为红褐色,说明该溶液中只含Fe2+
A [Fe在Cl2中燃烧只生成FeCl3,A项正确;铁的化学比较活泼,它能和水蒸气反应生成H2和Fe3O4,B项错误;Cl-也能使酸性KMnO4溶液褪色,C项错误;该溶液中也可以同时含有Mg2+、Al3+等,D项错误。]
7.选择合适试剂完成甲、乙两组实验
甲组:检验含Fe3+的溶液中是否含有Fe2+
乙组:检验含Fe2+的溶液中是否含有Fe3+
下列试剂选取正确的一项是( )
试剂 选项 | 甲组 | 乙组 |
A | 新制氯水、KSCN溶液 | NaOH溶液 |
B | K3[Fe(CN)6] | KSCN溶液 |
C | NaOH溶液 | 溴水 |
D | 溴水 | 酸性KMnO4溶液 |
B
8.向含有FeCl3和BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,过滤后向滤液中滴入KSCN溶液时,无明显现象,由此得出的正确结论是( )
A.白色沉淀是FeSO3
B.白色沉淀是BaSO3和BaSO4的混合物
C.白色沉淀是BaSO4
D.FeCl3已全部被SO2氧化成FeCl2
C [2Fe3++SO2+2H2O===2Fe2++SO+4H+,由于SO2过量溶液中无Fe3+;又SO+Ba2+===BaSO4↓,而BaSO3在酸性环境不能生成,所以白色沉淀为BaSO4。]
9.Fe2+、Fe3+、Zn2+完全地形成氢氧化物沉淀的pH分别为6.7、3.7、4.6。某硫酸锌酸性溶液中含有少量Fe2+、Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是( )
A.NaOH溶液 B.氨水
C.KMnO4、ZnCO3 D.H2O2、ZnO
D [由于Fe2+沉淀所需pH比Zn2+大,应首先将Fe2+氧化为Fe3+,然后调节溶液的pH使Zn2+还不沉淀时Fe3+已沉淀完全。氧化剂H2O2将Fe2+氧化为Fe3+,ZnO能消耗溶液中的H+且不引入新的杂质离子,故D项符合要求。]
10.下列关于Fe3+、Fe2+性质实验的说法错误的是( )
A.用如图装置可以制备Fe(OH)2沉淀
B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C.向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液显红色,此现象不能确定溶液中含有Fe2+
D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
C [A项,反应开始时打开止水夹C,使生成的氢气进入B中,可排出装置中的空气,防止生成的氢氧化亚铁被氧化;一段时间后关闭止水夹C,A中硫酸亚铁溶液进入B中反应生成Fe(OH)2,A项正确;B项,FeCl3易水解,配制其溶液时为抑制Fe3+水解,可先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度,B项正确;Fe3+与铁反应可生成Fe2+,故向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化,D项正确。]
11.FeCO3与砂糖混用可以作补血剂,实验室里制备FeCO3的流程如图所示,下列说法不正确的是( )
A.产品FeCO3在空气中高温分解可得到纯净的FeO
B.沉淀过程中有CO2气体放出
C.过滤操作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D.可利用KSCN溶液检验FeSO4溶液是否变质
A [FeCO3中的+2价的铁在高温时会被空气中的氧气氧化。]
12.制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A.通入过量Cl2:Fe2+、H+、NH、Cl-、SO
B.加入少量NaClO溶液:NH、Fe2+、H+、SO、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH、SO、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO、Cl-、ClO-、OH-
D [Cl2会氧化Fe2+,A项错误;ClO-会氧化Fe2+,且H+会与ClO-结合成弱电解质HClO,B项错误;OH-会与Fe2+反应生成Fe(OH)2沉淀,OH-也会与NH反应生成NH3·H2O,C项错误;加入过量的ClO-会氧化Fe2+生成Fe3+和Cl-,过量的OH-会除去Fe3+和NH,最终溶液中含Na+、SO和Cl-,且ClO-和OH-均是过量的,故D项正确。]
13.氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:
回答下列问题:
(1)操作Ⅰ的名称是________;操作Ⅱ的名称是________;操作Ⅱ的方法为
________________________________________________________________________
________________________________________________________________________。
(2)请完成生成FeCO3沉淀的离子方程式:
________________________________________________________________________
________________________________________________________________________。
解析: (1)从流程图中可知经操作Ⅰ后得到滤渣,故该操作是过滤;操作Ⅱ是在得到FeCO3沉淀后进行的,故该操作是洗涤;洗涤的具体操作为在漏斗中加入适量蒸馏水浸没沉淀,让蒸馏水自然流下,重复数次。(2)从流程图中分析,生成FeCO3沉淀的离子反应为Fe2++2HCO===FeCO3↓+CO2↑+H2O。
答案: (1)过滤 洗涤 在漏斗中加入适量蒸馏水浸没沉淀,让蒸馏水自然流下,重复数次
(2)Fe2++2HCO===FeCO3↓+CO2↑+H2O
14.在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液处理和资源回收的过程简述如下:
Ⅰ.向废液中投入过量铁屑,充分反应后分离出固体和滤液;
Ⅱ.向滤液中加入一定量石灰水,调节溶液pH,同时鼓入足量的空气。
(1)FeCl3蚀刻铜箔反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(2)过程Ⅰ加入铁屑的主要作用是
________________________________________________________________________,
分离得到的固体主要成分是
________________________________________________________________________,
从固体中分离出铜需采用的方法是
________________________________________________________________________。
(3)过程Ⅱ中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
解析: FeCl3溶液蚀刻铜箔的离子方程式为2Fe3++Cu===2Fe2++Cu2+,得到的废液中含有FeCl3、CuCl2、FeCl2。
答案: (1)2Fe3++Cu===2Fe2++Cu2+
(2)反应掉FeCl3、CuCl2 Fe、Cu 加入足量稀盐酸后过滤
(3)4FeCl2+4Ca(OH)2+O2+2H2O===4Fe(OH)3↓+4CaCl2
15.在高温条件下铁与水能发生反应。资料显示,在不同温度下,还原铁粉与水蒸气反应的产物是不同的,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。老师用如图所示实验装置,完成还原铁粉与水蒸气反应的演示实验。
(1)实验中使用肥皂液的作用是
________________________________________________________________________
________________________________________________________________________。
(2)某同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。
确定是否存在Fe3O4,需要测定并记录的实验数据是________________。
答案: (1)检验反应中生成的H2
(2)固体样品质量和红棕色固体的质量
16.(2019·湖南岳阳一中质检)某化学小组在实验室进行铁盐与亚铁盐相互转化的实验。
实验Ⅰ:将Fe3+转化为Fe2+(如图)
(1)Fe3+与Cu粉发生反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(2)探究白色沉淀产生的原因,请填写实验方案。查阅资料:
ⅰ.SCN-的化学性质与I-相似,ⅱ.2Cu2++4I-===2CuI↓(白色)+I2
实验方案 | 现象 | 结论 |
取4 mL________mol·L-1 CuSO4溶液,向其中滴加3滴0.1 mol·L-1KSCN溶液 | 产生白色沉淀 | CuSO4与KSCN反应产生了白色沉淀 |
取______________ | 无明显现象 |
Cu2+与SCN-反应的离子方程式为
________________________________________________________________________
________________________________________________________________________。
实验Ⅱ.将Fe2+转化为Fe3+
实验方案 | 现象 |
向3 mL 0.1 mol·L-1FeSO4溶液中加入1 mL 8 mol·L-1稀硝酸 | 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色 |
探究上述现象出现的原因。查阅资料:Fe2++NO⇌[Fe(NO)]2+(棕色)
(3)用离子方程式解释NO产生的原因
________________________________________________________________________
________________________________________________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析。
反应Ⅰ:Fe2+与HNO3反应 反应Ⅱ:Fe2+与NO反应
①依据实验现象,甲同学认为反应Ⅰ的速率比反应Ⅱ________(填“快”或“慢”)。
②乙同学认为反应Ⅰ是一个不可逆反应,并通过实验证明其猜测正确,乙同学设计的实验方案是__________________。
解析: (1)Fe3+与Cu粉发生反应生成铜离子与亚铁离子,反应的离子方程式为2Fe3++Cu===2Fe2++Cu2+。(2)由反应2Fe3++Cu===2Fe2++Cu2+,可知4 mL 0.1 mol·L-1Fe2(SO4)3溶液与过量Cu粉反应后得到的溶液中Fe2+为0.2 mol·L-1,Cu2+为0.1 mol·L-1,依据对照实验原则,取4 mL 0.1 mol·L-1CuSO4溶液,向其中滴加3滴0.1 mol·L-1KSCN溶液,另取4 mL 0.2 mol·L-1FeSO4溶液,向其中滴加3滴0.1 mol·L-1KSCN溶液。由题目信息ⅰ、ⅱ可知,Cu2+与SCN-反应生成CuSCN沉淀和(SCN)2,反应的离子方程式为2Cu2++4SCN-===2CuSCN↓+(SCN)2。(3)Fe2+和HNO3反应生成Fe3+、NO与水,反应的离子方程式为3Fe2++4H++NO===3Fe3++NO↑+2H2O。(4)①溶液先变为棕色,放置一段时间后,棕色消失,溶液变为黄色,反应速率快的反应现象最先表现,反应Ⅰ的速率比反应Ⅱ慢。②反应体系中硝酸过量,若反应Ⅰ可逆,反应后溶液中含有Fe2+,否则没有Fe2+,具体的实验方案是取少量反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应Ⅰ是不可逆反应。
答案: (1)2Fe3++Cu===2Fe2++Cu2+ (2)0.1 4 mL 0.2 mol·L-1 FeSO4溶液,向其中滴加3滴0.1 mol·L-1KSCN溶液 2Cu2++4SCN-===2CuSCN↓+(SCN)2 (3)3Fe2++4H++NO===3Fe3++NO↑+2H2O (4)①慢 ②取少量反应后的黄色溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应Ⅰ是不可逆反应(或通入NO气体到黄色溶液中没有出现棕色,答案合理即可)
高考化学一轮复习考点过关练习考点16 铁及其重要化合物(含解析): 这是一份高考化学一轮复习考点过关练习考点16 铁及其重要化合物(含解析),共20页。试卷主要包含了铁的性质,铁的氧化物和氢氧化物,“铁三角”及其应用,重要的铁盐等内容,欢迎下载使用。
鲁科版高考化学一轮复习课时练8铁及其重要化合物含答案: 这是一份鲁科版高考化学一轮复习课时练8铁及其重要化合物含答案
新教材高考化学一轮复习课时作业8铁及其重要化合物含答案: 这是一份新教材高考化学一轮复习课时作业8铁及其重要化合物含答案,共10页。试卷主要包含了单项选择题,不定项选择题,非选择题等内容,欢迎下载使用。












