






化学:高三二轮复习课件《常用化学计量》
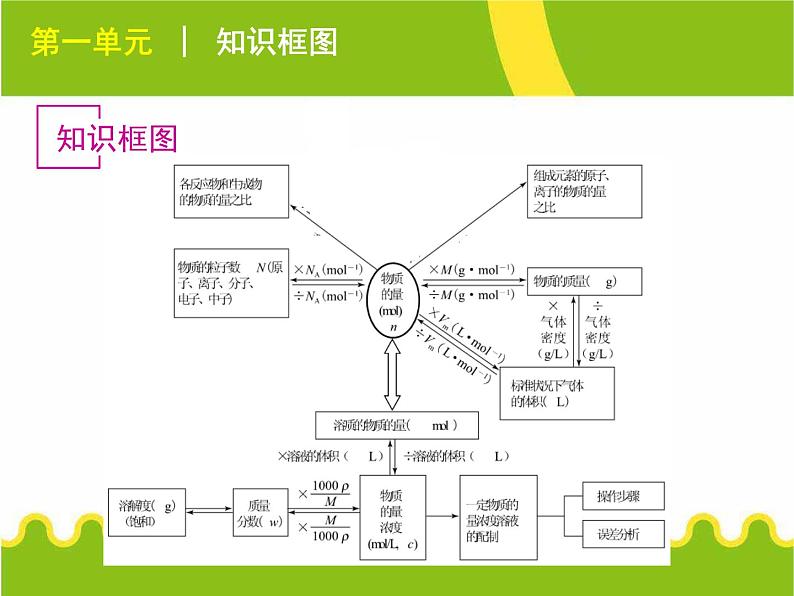
展开第一单元 │ 知识框图
第一单元 │ 内容特点
► 内容特点 1.物质的量是一种以“堆量”计量微观粒子的物理量,不仅难以理解,而且其涉及的知识面也很广泛。阿伏加德罗常数是物质的量的计量标准,有关它的判断是历年高考题的热点。 2.摩尔质量是在物质的量概念建立的基础上,连接微粒数目和物质质量的一个物理量,从定量角度了解或计算实验或反应中各物质的量的关系。 3.标况下气体摩尔体积是22.4 L·ml-1,是阿伏加德罗定律的特例。
4.物质的量浓度是便于了解溶液中分散质粒子的存在数量的物理量,以此可以了解溶液中离子的量的关系。 5.本单元的重点是物质的量、质量、气体体积、物质的量浓度及其他物理量之间的换算关系,这部分也是高考计算类命题的核心。
► 编写思路 1.因物质的量的概念抽象又难于理解,由此所派生的其他物理量在高考化学试题中作为计算考查的重点,所以本单元分为2讲:物质的量、气体摩尔体积和阿伏加德罗定律、物质的量浓度及溶液的配制。为分化难点,将常考的几个重要点也分解到两讲中予以突破。
第一单元 │ 编写思路
2.第1讲:对物质的量的概念简单介绍,点明了使用物质的量的注意事项。由于有关阿伏加德罗常数的正误判断是高考的热点,所以对其进行考查角度的归类分析,以帮助学生深化理解,看问题切中要害。摩尔质量的编写集中在如何理解概念及简单运算上。对气体摩尔体积的讲解主要集中在“标况下的气体摩尔体积”上,之后重点对阿伏加德罗定律进行拓展。至于物质的量应用于化学方程式的计算,只要能够知道罗列有关数据时,做到“左右相当,上下一致”即可,有待于在以后的复习中强化训练。
3.第2讲:物质的量浓度的编写主要简单地介绍其概念;而一定物质的量浓度溶液的配制是中学阶段重要的定量实验,因此对其进行细致的编写;关于物质的量浓度的计算则将其重点放在与质量分数、溶解度之间的换算关系上。
► 使用建议 1.教学时要注意引导学生加深对一系列易混淆的概念予以综合辨析,澄清模糊认识。对各化学计量的求算公式进行推导,追根溯源。注意公式及其适用条件的理解,并能灵活变通,熟练应用。在此基础上通过适当的训练强化常用计量在各类化学题目中的渗透和应用,学会归纳、分析、类比,并强调对化学原理的分析(如运用守恒思想),避免繁杂的数学运算,同时注意对常考点(如NA)的针对性训练,但不做综合性太强的题目,不研究太复杂的计算,始终把握化学计算的基础是相关化学知识的正确理解与应用,数学计算只是工具和手段,只有“明确化学含义”,才能“理解数量关系”。
第一单元 │ 使用建议
2.本单元概念较多,对概念的教学要使学生明确概念的内涵与外延,多进行概念的变式教学和比较教学,以澄清概念。 3.本单元的另一个特点就是计算量大。教学过程中要始终围绕物质的量为中心进行,让学生在教师的引导下自主构建转化关系图,而不要直接投放给学生,让学生硬性去记忆和模仿计算。 ► 课时安排 本单元共2讲,建议5课时完成,2课时用于在课堂上互动式完成1~2讲,1课时为习题讲评,1课时进行测试,1课时用于试卷讲评 。
第1讲 │ 物质的量 气体摩尔体积
第1讲 物质的量 气体 摩尔体积
第一单元 │ 考纲导学
► 探究点一 物质的量 摩尔质量
一、物质的量 1.物质的量:物质的量是一个表示含有____________粒子集合体的物理量,它的符号是________,物质的量的单位是摩尔(简称摩,符号是________)。物质的量适用于微观粒子,如原子、分子、________、________、电子、质子、中子等。
2.阿伏加德罗常数:国际上规定,1 ml粒子所含的粒子数与0.012 kg 12C中所含的碳原子数相同,符号为________,通常用______________ 表示。 3.关系式:物质所含粒子数目(N)、物质的量(n)、阿伏加德罗常数(NA)三者之间的关系式: ____________。
6.02×1023ml-1
二、摩尔质量 单位物质的量的物质所具有的质量叫____________。符号为________,单位为________(或____________)。表达式:M=____________。摩尔质量单位为g/ml时,在数值上与物质的___________________________ 相等。
相对分子质量或相对原子质量
1.洞悉阿伏加德罗常数的误区 (1)状况条件在对气体的体积与物质的量关系考查时,题目经常给出非标准状况,如常温常压下或不指明温度和压强等,要特别注意。 (2)物质状态考查气体摩尔体积时,常结合在标准状况下非气态的物质,如H2O、SO3、己烷、辛烷、CHCl3等。SO3标准状况下为固态。
(3)物质结构考查一定物质的量的物质中含有多少粒子(分子、原子、电子、质子、中子、离子等),常涉及稀有气体He、Ne等单原子分子,Cl2、N2、O2、H2等双原子分子及O2、18O2、D2O、Na2O2等特殊物质,也会考查一些物质中的化学键数目,如Si、CH4、P4、CO2等。 (4)氧化还原反应考查指定物质参加氧化还原反应时,常设置氧化还原反应中氧化剂、还原剂、氧化产物、还原产物、被氧化、被还原、电子转移(得失)数目方面的陷阱。如Na2O2与H2O的反应,与NaOH的反应,电解AgNO3溶液等。
(5)弱电解质的电离或盐类的水解考查电解质溶液中粒子数目及粒子浓度大小关系时,常涉及弱电解质的电离平衡及盐类的水解平衡。如NH4Cl溶液中n(NH4+)<n(Cl-)。
例1 [2010·上海卷] NA表示阿伏加德罗常数,下列叙述正确的是( )A.等物质的量的N2和CO所含分子数均为NAB.1.7 g H2O2中含有的电子数为0.9NAC.1 ml Na2O2固体中含离子总数为4NAD.标准状况下,2.24 L戊烷所含分子数为0.1NA
例1 B 本题考查了阿伏加德罗常数的应用,中档题。因为不知道NO和CO具体的物质的量,所以无法求出其分子数,A错;1.7 g H2O2的物质的量是0.05 ml,每一个H2O2含有18个电子,所以总的电子数是0.9NA,B项正确;1 ml Na2O2含有2 ml Na+和1 ml O22-,所以离子总数应为3 NA,C项错误;在标准状况下,戊烷不是气态,所以2.24 L并不是0.1 ml,D项错误。
[点评] 有关阿伏加德罗常数的考查是高考命题的热点之一,在近几年的各种高考试题中保持了相当强的连续性。关于阿伏加德罗常数的正误判断的主要考查点有:①判断一定量的物质所含的某种粒子数目的多少;②物质的组成,如本题中的C选项容易误以为Na2O2中含有4 ml离子,判断错误;③通过阿伏加德罗常数进行一些量之间的换算等;在解题时要抓住其中的易错点,准确解答,如本题中的D选项戊烷标况下是液体,不适应气体摩尔体积。本题主要集中考查“一定量的物质所含的某种粒子数目”,变式题从原子的组成、电子转移、物质的量浓度等角度进行考查。
例2 [2010·课标全国卷] 某气体物质的质量为4.4 g,含有6.02×1022个分子,则气体( ) A.其相对分子质量为44 g·ml-1 B.一定是CO2 C.1 ml该气体的质量是44 g D.该气体的摩尔质量是44
[点评] 本题通过几种物理量之间的换算关系,考查摩尔质量的计算和表示方法等。注意摩尔质量是既有数值,又有单位(g·ml-1)的物理量,不可与相对分子质量(单位为“1”,忽略不写)混淆。变式题则是利用摩尔质量进行有关计算。
[高考命题者说]成书课件中,将引用教育部考试中心《高考试题分析》中本题对应的分析供教师参考(仅限2010年大纲全国卷和课标全国卷试题)。
► 探究点二 气体摩尔体积 阿伏加德罗定律
1.影响物质体积的因素。影响物质体积的因素有____________、____________、____________。在粒子数目相同的情况下,固体、液体的体积大小主要由____________决定,气体体积主要由__________决定,而气体的粒子间距离又由________和________决定。
1.全面理解标况下的气体摩尔体积 (1)标准状况:指0 ℃、1.01×105Pa的状态。温度越高,体积越大;压强越大,体积越小。故在非标准状况下,气体摩尔体积不一定就是22.4 L·ml-1。但若同时增大压强,升高温度,或是降低压强和温度,1摩尔任何气体所占的体积有可能为22.4 L。 (2)1 ml气体在非标准状况下,其体积可能为22.4 L,也可能不为22.4 L。如在室温(20 ℃,一个大气压)的情况下1 ml气体的体积是24 L。
(3)气体分子间的平均距离比分子的直径大得多,因而气体体积主要决定于分子间的平均距离。在标准状况下,不同气体的分子间的平均距离几乎是相等的,所以任何气体在标准状况下的气体摩尔体积都约是22.4 L·ml-1。 (4)理解此概念时应注意:①是气态物质;②物质的量为1 ml;③气体状态为0 ℃和1.01×105Pa(标准状况);④22.4 L体积是近似值;⑤Vm的单位为L·ml-1或m3·ml-1。 (5)适用对象:纯净气体与混合气体均可。
[点评] 本题中虽然没有给定三个容器的体积关系,实际上在密度给定的前提下,压强关系与容器的大小无关。阿伏加德罗定律的使用,一般是先确定气体的物质的量关系,然后推导其他物理量之间的关系,如下面的变式题。
► 探究点三 物质的量应用于化学方程式的计算
1.化学方程式在量方面的含义化学方程式可以明确地表示出化学反应中粒子之间的数目关系,即化学计量数之比等于反应中各物质的____________之比。 2.根据化学方程式计算需注意的问题 (1)化学方程式所表示的是纯净物之间的量的关系,所以不纯物质或不完全转化物质的质量只有换算成纯净物的质量,才能按化学方程式列出比例式进行计算。
[点评] “差量法”解题的一般步骤可分为: ①正确写出有关反应的化学方程式; ②深入细致地分析题意,关键在于有针对性地找出产生差量的“对象”及“理论差量”。该“理论差量”可以是质量、物质的量、气体体积、压强、密度、反应过程中热量的变化等,且该差量的大小与参加反应物质的有关量成正比; ③根据反应方程式,从“实际差量”寻找比例关系,列比例式求解。常见的差量有:质量、物质的量、气体体积、反应过程中热量的变化等。
2023届高考化学二轮复习专题2化学常用计量及其应用课件: 这是一份2023届高考化学二轮复习专题2化学常用计量及其应用课件
高考化学二轮复习专题2化学常用计量及其应用课件: 这是一份高考化学二轮复习专题2化学常用计量及其应用课件,共60页。PPT课件主要包含了浅蓝色至无色,视的分析,典例1,技巧点拨,典例2,规律方法,典例3,典例4,题后反思,典例5等内容,欢迎下载使用。
高考化学二轮复习专题二常用化学计量及应用课件: 这是一份高考化学二轮复习专题二常用化学计量及应用课件,共60页。PPT课件主要包含了内容索引,专项模块素养培优,五年高考命题研究,要点归纳•再提升,经典对练•得高分,思路点拨,答案D,答案C,答案A,答案CD等内容,欢迎下载使用。












