






高考化学一轮复习方案_第3讲_物质的量在化学实验中的应用课件
展开1.了解溶液的含义。2.了解溶解度、饱和溶液的概念。3.了解溶液的组成,理解溶液中溶质的质量分数、物质的量浓度的概念,并能进行相关计算。4.掌握一定溶质质量分数、物质的量浓度溶液的配制方法。
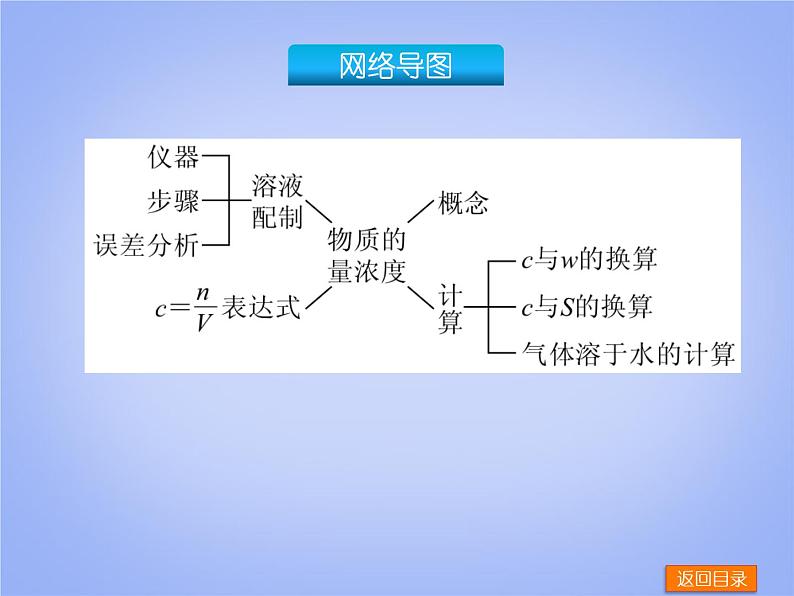
► 探究考向一 物质的量浓度—— 知 识 梳 理 —— 化学定量分析常涉及溶液配制和溶液浓度的计算,利用化学反应进行定量分析时,用物质的量浓度来表示溶液的组成更为方便。 1.定义:以单位体积溶液里所含__________的物质的量来表示__________的物理量,叫溶质B的物质的量浓度。符号为____________。 2.表达式:cB=__________。 3.单位:______________。 4.注意点:(1)单位体积为溶液的体积,不是溶剂的体积;(2)溶质必须用物质的量来表示。
第三单元 物质的量在化学实验中的应用
【触摸高考】 高考选项正误判断
—— 核心突破 ——
—— 典例精析 ——
► 探究考向二 一定物质的量浓度溶液的配制—— 知 识 梳 理 —— 1.所用仪器 必须用到的仪器有________ 、烧杯、玻璃棒、胶头滴管四种。若用固体溶质配制,则还需要用到________ __、药匙等称量仪器;若用液体来配制,则还需要滴定管(或量筒)等量取仪器。
2.容量瓶的使用 (1)特点
(2)使用方法及注意事项 ①容量瓶使用前一定要检查____________。其操作顺序为装水→盖塞→倒立→正立→玻璃塞旋转180°→倒立。 ②________(填“能”或“不能”,下同)将固体或浓溶液直接在容量瓶中溶解或稀释。 ③________作为反应容器或长期贮存溶液的容器。 ④________加入过冷或过热的液体。 ⑤只能配制容量瓶上规定体积的溶液,即不能配制任意体积的一定物质的量浓度的溶液。
(1)计算:计算所需固体的质量。 (2)称量:根据计算结果,称量固体质量。 (3)溶解:将称量好的固体放入烧杯中,加适量水溶解,并用________搅拌。 (4)转移:待恢复到__________后,将溶液转移到__________中。 (5)洗涤:用适量蒸馏水将烧杯及玻璃棒洗涤______次,将每次洗涤液也注入容量瓶中,并振荡容量瓶。 (6)定容:往容量瓶中缓慢加蒸馏水,等液面离容量瓶瓶颈刻度线________cm时,改用________滴加蒸馏水至液面与刻度线________。塞好瓶塞,反复上下颠倒,摇匀。
提醒 俯视、仰视的分析 结果:仰视时,容器内液面高于刻度线;俯视时,容器内液面低于刻度线。
—— 典例精析 —— 例2 [2012•海口模拟] 实验室需要配制0.50 ml/L NaCl溶液480 mL。 按下列操作步骤填上适当的文字,以使整个操作完整。 (1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。 (2)计算。配制该溶液需取NaCl晶体________g。
(3)称量。 ①天平调平之后,应将天平的游码调至某个位置,请在图1-2-4中用一根竖线标出游码左边缘所处的位置: ②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。 ③称量完毕,将药品倒入烧杯中。 (4)溶解、冷却。该步实验中需要使用玻璃棒,目的是____________________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了___________________ ___。 (6)定容,摇匀。 (7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。 (8)在配制过程中,某学生观察定容时液面情况如图1-2-5所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。
[答案](1)500 mL容量瓶 胶头滴管 (2)14.6 (3)① ②左盘 (4)搅拌,加速NaCl溶解 (5)玻璃棒 保证溶质全部转移入容量瓶中 (8)偏低 [解析] 配制480 mL的0.50 ml/L的NaCl溶液,必须用500 mL的容量瓶。m(NaCl)=0.50 ml/L×0.5 L×58.5 g/ml=14.6 g(托盘天平精确到0.1 g)。用托盘天平称量时,物品放在左盘,配制一定物质的量浓度溶液的一般步骤为:计算→称量(或量取)→溶解、冷却→转移、洗涤→定容、摇匀→装瓶贴签。定容时仰视液面会造成溶液体积偏大,浓度偏低。
互动探究 上述例2第三步称量时,若把NaCl晶体放在右盘,砝码放在左盘。对配制溶液的物质的量浓度有何影响? [答案] 提示: NaCl和砝码放颠倒时,由于使用了游码(0.6 g),所以称量NaCl的质量为13.4 g,导致所配溶液物质的量浓度偏小。
[答案] (1)A、C 烧杯、玻璃棒 (2)BCE (3)2.0 小于 小于 (4)13.6 15 将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌
► 探究考向三 以物质的量为中心的各物理量之间的换算—— 知 识 梳 理 —— 1.溶液中各量间的关系 溶质的物质的量浓度: 2.溶质的质量分数、固体溶质的溶解度、溶液的物质的量浓度等概念之间的换算关系 [c为物质的量浓度(ml/L),ρ为溶液的密度(g•mL-1),w为溶质的质量分数,M为溶质的摩尔质量(g•ml-1),下同。]
(1)物质的量浓度与溶质质量分数之间的换算:_____________ ______________________。 (2)物质的量浓度与溶解度(S)之间的换算:____________________________ __。 (3)质量分数与溶解度之间的换算:_______________________ ____。
(4)气体溶质溶于水中制得溶液,其物质的量浓度的计算 在标准状况下,1 L水中溶解某气体y L,所得溶液密度为ρ(单位为g/cm3),则其溶质的物质的量浓度:__________ ;
质量分数:____________ 。
(5)两种溶液混合后所得溶液物质的量浓度的计算 ①混合后溶液体积不变时, ; ②混合后溶液体积改变时,____________ 。
②气体溶质溶于水所得溶液的物质的量浓度的计算 当气体作为溶质溶于水制得的溶液,其质量是气体的质量和溶剂的质量之和。但是一定要注意所得溶液的体积不是气体的体积和溶剂的体积之和,溶液的体积应根据溶液的质量和溶液的密度具体求算。 ③溶液稀释前后所得溶液的物质的量浓度的计算 溶液的稀释问题,可概括为两种情况:一种是往浓溶液中加水进行稀释;另一种是往浓溶液中加稀溶液进行稀释。不论是哪一种情况都涉及两个问题。 a.溶质在稀释前后物质的量相等。
b.溶液的体积是不是发生变化,也就是说稀释后溶液的体积是把两种溶液的体积直接相加,还是先求出混合溶液的总质量,然后再由溶液的密度求出溶液的体积。对混合溶液的体积是否改变,其判断方法如下:如果在题干中指出不考虑溶液体积的变化,则可以把两种溶液的体积(或溶液和水的体积)直接相加;如果在题干中指出两种溶液混合后溶液的密度,则说明混合后溶液的体积发生了变化,此时就不能把两种溶液的体积直接相加,而是先求出混合溶液的总质量,然后再换算为溶液的体积。
—— 典例精析 ——
方法点拨 守恒法是化学计算中常用的基本方法,守恒法包括电荷守恒、电子守恒、质量守恒、元素守恒、物料守恒等。只有平时多加练习,考试时才会正确使用,达到事半功倍的效果。
► 规范1 语言表述、数字与单位的书写规范 例 进行某实验需要0.5 ml/L的氢氧化钠溶液约400 mL,根据溶液配制的过程,回答下列问题: (1)实验除了需要托盘天平(带砝码)、药匙和玻璃棒外,还需要的其他玻璃仪器是_________________。 (2)根据计算得知,所需要氢氧化钠固体的质量为__g。 (3)配制溶液的过程中,以下操作正确的是_(填序号)。 A.将氢氧化钠固体放在纸片上称量 B.在烧杯中溶解氢氧化钠固体后,立即将溶液倒入容量瓶中 C.将溶解氢氧化钠固体的烧杯用蒸馏水洗涤2~3次,并将洗涤液转移到容量瓶中
(4)玻璃棒在该实验中的作用有: ①____________________________; ②____________________________。 (5)400 mL 0.5 ml/L的该NaOH溶液加入到足量的MgCl2溶液中,产生的沉淀的质量为____________。 (6)取0.5 ml/L的NaOH溶液 100 mL,所含Na+的数目为________。
提示 定量实验要注意三个问题:一是注意关键仪器的规格;二是所用定量仪器的精确度;三是注意计算过程中有效数字的处理。如要量取9.6 mL液体,应选用10 mL量程的量筒,而不能选9.6 mL的量筒或100 mL的量筒。因为没有规格为9.6 mL的量筒。天平称量药品时,要读到0.1 g,例如天平读数读成8.0 g,不能读成8 g。 (4)问学生答案表述不规范,仅用了两个动词“搅拌”、“引流”,并没有把操作目的交待清楚。 (5)问丢掉了质量的单位g。在化学计算题中,要特别注意单位的书写规范,如果题目所留空后无单位,则一定要写明单位,当然像相对分子质量这样的数字后是不能加单位的。
(6)微粒的个数不能用ml来表示,摩尔是物质的量的单位。 提升 我们今后在解这类题目时,要注意两点:①答题时要特别注意物理量的单位,相对分子质量这样的数字后是不能加单位的;②复习有关定量实验时要注意三个问题:一是注意关键仪器的规格,如:容量瓶、量筒、滴定管;二是注意所用定量仪器的精确度,如量筒、滴定管;三是注意计算过程中有效数字的处理。
人教版高考化学一轮复习第1章化学计量在实验中的应用第2讲物质的量在化学实验中的应用课件: 这是一份人教版高考化学一轮复习第1章化学计量在实验中的应用第2讲物质的量在化学实验中的应用课件
人教版高考化学一轮复习1.2物质的量在化学实验中的应用课件: 这是一份人教版高考化学一轮复习1.2物质的量在化学实验中的应用课件
高考化学一轮复习第1章化学计量在实验中的应用第2节物质的量在化学实验中的应用课件: 这是一份高考化学一轮复习第1章化学计量在实验中的应用第2节物质的量在化学实验中的应用课件,共60页。PPT课件主要包含了必备知识·关键能力,g溶剂,饱和状态,真题验收·新题预测等内容,欢迎下载使用。












