




人教版 (新课标)选修4 化学反应原理第三节 电解池评课ppt课件
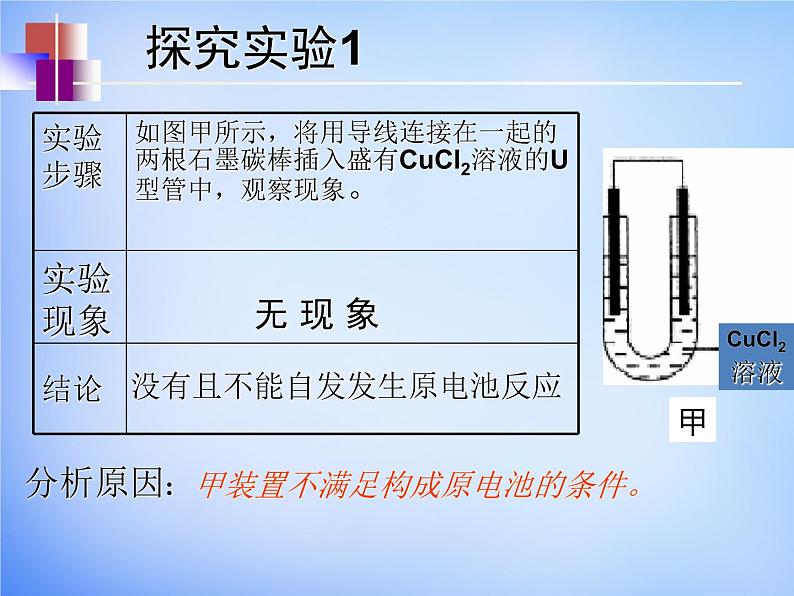
展开没有且不能自发发生原电池反应
甲装置不满足构成原电池的条件。
电解电解水 :2 H2O ====2 H2 ↑+ O2↑
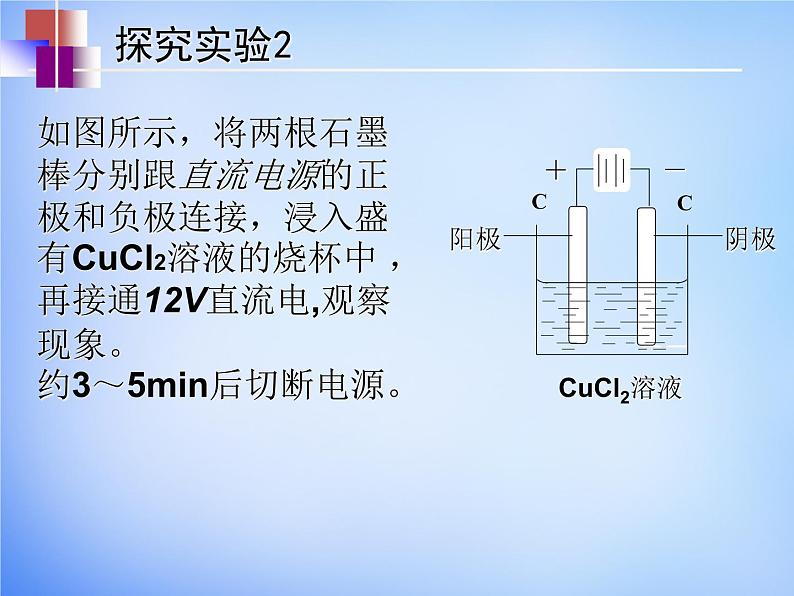
如图所示,将两根石墨棒分别跟直流电源的正极和负极连接,浸入盛有CuCl2溶液的烧杯中 ,再接通12V直流电,观察现象。约3~5min后切断电源。
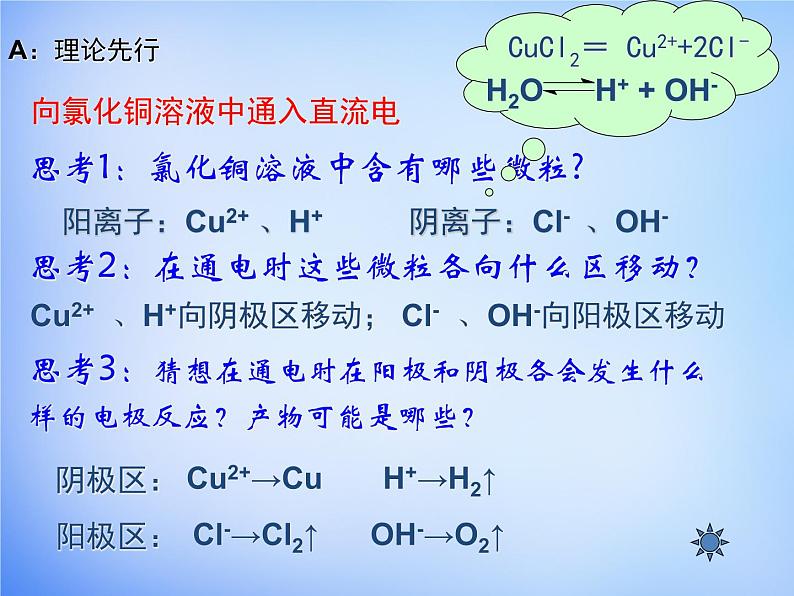
向氯化铜溶液中通入直流电
思考1:氯化铜溶液中含有哪些微粒?思考2:在通电时这些微粒各向什么区移动?思考3:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
阳离子:Cu2+ 、H+ 阴离子:Cl- 、OH-
Cu2+ 、H+向阴极区移动; Cl- 、OH-向阳极区移动
Cl-→Cl2↑ OH-→O2↑
H2O H+ + OH-
CuCl2= Cu2++2Cl-
Cu2+→Cu H+→H2↑
使湿润的碘化钾淀粉试纸变蓝
阴离子失去电子,阳离子得到电子的过程叫放电。
Ag+> Hg2+> Fe3+ >Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+Al3+>Mg2+>Na+>Ca+>K+
阴极:氧化性强的离子先得电子。
阳极:还原性强的离子先失电子。
金属 > S2->I->Br->Cl->OH->NO3->SO42->F-
- +
电解氯化铜溶液实验装置
2Cl- - 2e- = Cl2↑(氧化反应)
Cu2+ + 2e- = Cu(还原反应)
使直流电通过电解质溶液而在阴、阳两极引起 氧化还原反应的过程,叫做电解。
3.构成电解池的条件:
阴极:与电源负极相连 [还原反应]
阳极:与电源正极相连 [氧化反应]
③电解质溶液或熔融电解质;
电能转变为化学能的装置。
电子从负极流向阴极,经溶液离子导电,再从阳极流回正极
电解硫酸钠溶液中会有怎样的结果?
4OH--4e-=2H2O +O2↑
4H+ +4e-=2H2 ↑
1.分析溶液中存在的所有离子(包括水的电离)、并分成阳离子组和阴离子组。2.根据放电规律,阳离子在阴极发生还原反应,而阴离子在阳极发生氧化反应,完成电极反应式。(注意得失电子守恒)3.由阴阳两电极反应式,合并得总反应式。(弱电解质的须保持分子形式)
写电极反应【方法小结】
[例]以石墨碳棒为电极,请写出分别电解下列溶液时,在阴、阳两极上发生的电极反应式及总的化学方程式。(1)NaCl溶液: (2)CuSO4溶液:
阳极:4OH--4e-=2H2O+O2↑ 阴极:2Cu2+ +4e-=2Cu
总反应式:2Cu2++2H2O=2Cu+O2↑+4H+
阳极:2Cl--2e-=Cl2↑阴极:2H++2e-=H2↑
总反应:2Cl-+2H2O = Cl2↑+H2↑+2OH-
电解池与原电池有哪些异同
①两电极接直流电源②电解质溶液③形成闭合回路
①活泼性不同的两电极②电解质溶液③形成闭合回路自发的氧化还原反应
将电能 转变成化学能的装置
将化学能 转变成电能的装置
电解池与原电池有哪些异同(续)
电源负极→电解池阴极电解池阳极→电源正极
阳极:氧化反应,溶液中的阴离子失电子或电极金属失电子阴极:还原反应,溶液中的阳离子得电子
负极:氧化反应,金属失电子正极:还原反应,溶液中的阳离子得电子
阳极:与电源正极相连阴极:与电源负极相连
负极:较活泼金属正极:较不活泼金属(或能导电的非金属)
二、电解规律(用惰性电极电解时)
1、电解含氧酸、强碱溶液、活泼金属的含氧酸盐溶液时,如电解H2SO4、HNO3、NaOH、Na2SO4等溶液
电解后溶液中溶质的质量分数 ,若要恢复原来的浓度,只需加入一定量的 即可。
2、电解无氧酸溶液(氢氟酸除外)、不活泼金属的无氧酸盐溶液,如电解盐酸、CuCl2溶液等
电解后溶液中溶质的质量分数 ,若要恢复原来的组成和浓度,需加入一定量的 (通入一定量的HCl气体)
阳极: 2Cl -- 2e-=Cl2↑
阴极: 2H+ +2e-= H2 ↑
实质:电解质本身被电解
3、电解不活泼金属的含氧酸盐时,电解质和水都有一部分被电解,如电解CuSO4溶液、AgNO3溶液等。
阳极 : 4OH--4e-=2H2O +O2↑
阴极: 2Cu2+ +4e-=2Cu
电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需加入一定量金属氧化物。
4、电解活泼金属的无氧酸盐溶液时,电解质和水都有一部分被电解,如电解NaCl溶液等。
电解后原溶液中溶质的质量分数减小,若要恢复原来的组成和浓度,需通入一定量的HCl。
阳极 (C): 2Cl -- 2e-=Cl2↑
阴极 (C): 2H+ +2e-= H2 ↑
练习:以石墨作电极,电解下列溶液,写出电极反应及电解总反应式。 AgNO3溶液
阳极:4OH--4e-=2H2O+O2↑阴极:4Ag++4e-=4Ag总反应式:4Ag++2H2O==4Ag +O2 ↑+4H+
1、下列说法或实验现象的描述不正确的是( )A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速度加快D.与电源负极相连的是电解槽的阴极
Zn -2e-=Zn2+
Cu2+ +2e-=Cu
(1)在NaCl溶液中,NaCl电离出 ,H2O电离出 。 通电后,在电场的作用下, 向阴极移动, 向阳极移动。 在阳极,由于 容易失去电子,被氧化生成 。 阳极方程式: ; (2)在阴极,由于 容易得到电子被还原生成 . 使H2O 电离向右移动,因此阴极 浓度增大,PH 。 阴极方程式: 。
2Cl- - 2e- = Cl2
2H+ + 2e- = H2
1、氯碱工业 电解饱和食盐水以制造烧碱、氯气和氢气。
总化学方程式: ;总离子方程式: .(3)电解前向溶液中滴加酚酞,通电后现象为: ___________ ,两极极板上都有气体产生,如何检验气体的种类?
阴极附近的溶液无色变为红色
阳极:产生刺激气体使湿润KI淀粉试纸变蓝色.
阴极:产生无色、无味气体
(2)避免生成物H2和Cl2混合,因为: .
(1)避免Cl2接触NaOH溶液会反应,使产品不纯,反应方程式: .
Cl2 +2 NaOH =NaCl + NaClO + H2O
解决方法:使用离子交换膜
电解饱和食盐水必须解决两个主要问题:
Zn、Fe、Ni、Ag、Au等
以粗铜为阳极,以纯铜为阴极, 以CuSO4溶液为电解液进行电解
阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+ Ni -2e-=Ni2+ Cu-2e-=Cu2+
阴极: Cu2+ +2e-=Cu
⑴、概念:应用电解原理在某些金属表面镀上一层 其它金属或合金的过程。
③、含镀层金属阳离子 的盐溶液作电解液
电镀液的组成及酸碱性保持不变
4、电冶金(冶炼活泼金属钠、镁、铝等)
电解熔融状态的氯化钠。
2Cl - -2e- == Cl2↑
2Na+ + 2e- == 2Na
结论:电解法是冶炼金属的一种重要方 法,是最强有力的氧化还原的手段。
电解熔融状态的氧化铝。
6O 2- -12e- == 3O2↑
4Al 3+ + 12e- == 4Al
原电池、电解池、电镀池判定规律
若无外接电源, 可能是原电池,然后依据原电池的形成条件分析判定,主要思路是“三看” 先看电极:两极为导体且活泼性不同 再看溶液:两极插入电解质溶液中 后看回路:形成闭合回路或两极接触 若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同,则为电镀池,其余情况为电解池。
讨论:比较电解池和原电池的异同~~~~~~
发生氧化还原反应,从而形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)
由电极本身决定正极:流入电子 负极:流出电子
由外电源决定阳极:连电源正极 阴极:连电源负极
(外电路)负极 → 正极
电源负极→阴极→阳极→电源正极
电源正极→阳极→阴极→电源负极
负极:Zn - 2e- =Zn2+(氧化反应) 正极:2H+ + 2e- =H2↑(还原原应)
阳极:2 Cl- - 2e- = Cl2 ↑(氧化反应)阴极: Cu2+ + 2e- = Cu (还原反应)
氯碱工业、电镀、电冶、金属精炼
第二个问题:精制食盐水
高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池备课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池备课课件ppt,共21页。PPT课件主要包含了有关电解,☆分析,实验分析,牢记放电顺序,巩固练习等内容,欢迎下载使用。
人教版 (新课标)第三节 电解池教课内容课件ppt: 这是一份人教版 (新课标)第三节 电解池教课内容课件ppt,共3页。PPT课件主要包含了概念形成,以氯化铜为例等内容,欢迎下载使用。
化学人教版 (新课标)第三节 电解池课堂教学课件ppt: 这是一份化学人教版 (新课标)第三节 电解池课堂教学课件ppt,共60页。PPT课件主要包含了现象原因,⑵电镀池形成条件,①镀件作阴极,②镀层金属作阳极,⑶电镀的特点,铜的电解精炼,⑴粗铜所含的杂质,⑵粗铜的精炼,氯碱工业,Cl-等内容,欢迎下载使用。













