




高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用评课课件ppt
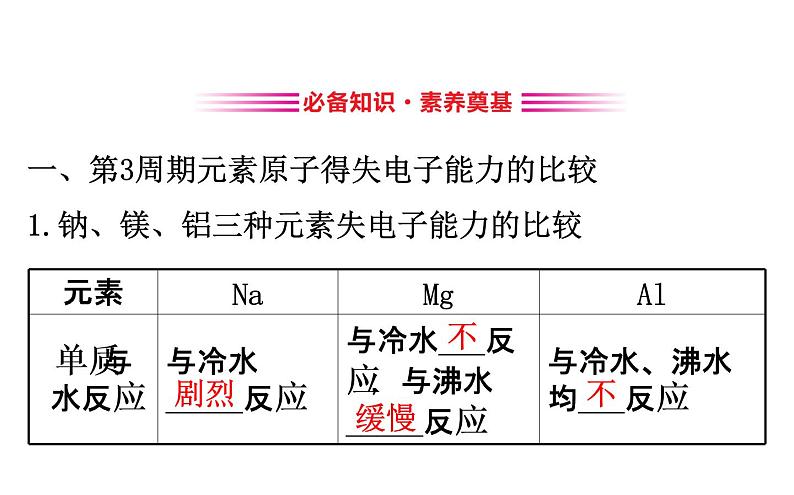
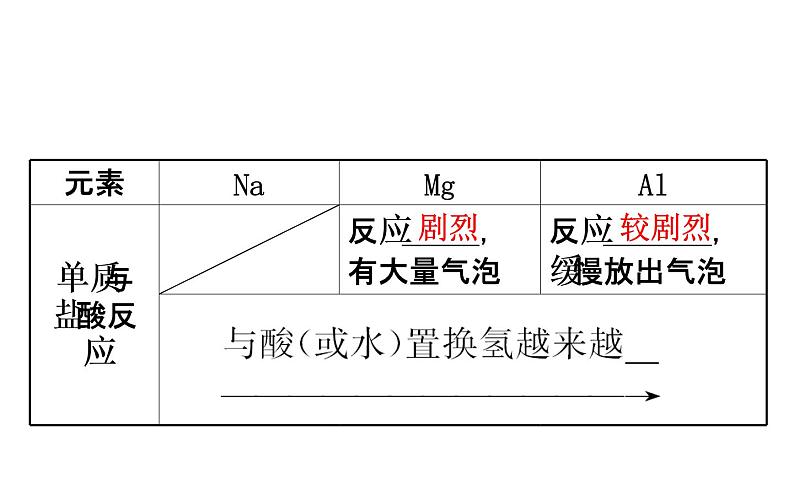
展开一、第3周期元素原子得失电子能力的比较1.钠、镁、铝三种元素失电子能力的比较
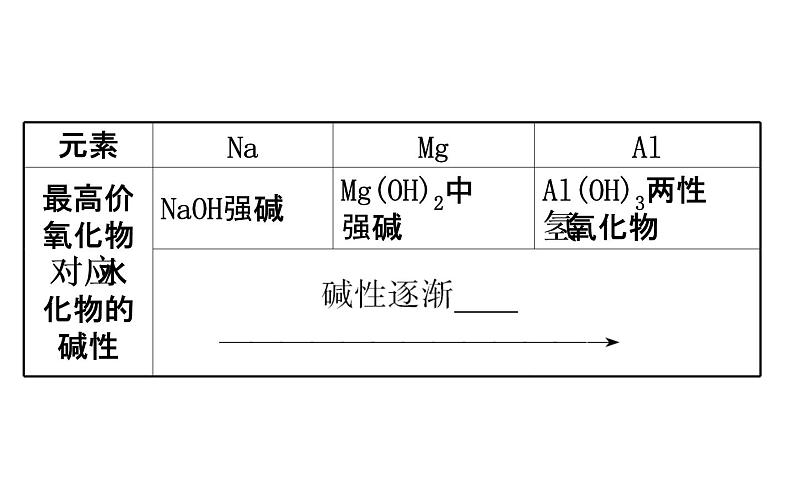
【巧判断】(1)碱性:NaOH>Mg(OH)2>Al(OH)3,故还原性:Na>Mg>Al。( )提示:√。由最高价氧化物的碱性NaOH>Mg(OH)2>Al(OH)3,可以得出失电子能力Na>Mg>Al。
(2)熔点、硬度:Al>Na,故金属性:Na>Al。( )提示:×。熔点、硬度属于物理性质,而金属性属于化学性质,二者没有必然的联系。
(3)同一周期元素的原子,半径越小越容易失去电子。( )提示:×。原子半径越小,原子核对外层电子的吸引力越大,越不容易失去电子。
2.硅、磷、硫、氯单质及化合物性质的比较
【情境·思考】铁在氯气中燃烧生成FeCl3,铁粉与硫粉反应生成FeS,请从原子结构角度解释原因。
提示:由于S和Cl位于同一周期,电子层数相同,原子半径r(Cl)
【巧判断】(1)PH3的稳定性比SiH4强。( )提示:√。P和Si同位于第3周期,P的非金属性比Si强,因此PH3的稳定性比SiH4强。
(2)第3周期非金属元素含氧酸酸性从左到右依次增强。( )提示:×。应该是最高价含氧酸酸性从左到右依次增强。
(3)同周期元素X、Y,若半径:X>Y,则气态氢化物的稳定性HmX一定大于HnY。( )提示:×。同周期元素X、Y,若半径:X>Y,则原子序数X
【易错提醒】同周期元素性质递变的几个易错点(1)相对原子质量随原子序数的递增,不呈周期性变化。(2)根据含氧酸的酸性强弱比较元素非金属性的强弱时,必须是最高价含氧酸。
(3)在元素周期表中,无氧酸的酸性变化规律与元素非金属性的变化规律不一致。其规律是左弱右强,上弱下强。如非金属性:S
(4) 同周期从左到右,金属单质的还原性、非金属阴离子的还原性逐渐减弱;非金属单质的氧化性、金属阳离子的氧化性逐渐增强。
【思考·讨论】(1)难失电子的原子,得电子一定容易吗?提示:不一定,如稀有气体原子难失电子,也难得电子。
(2)“同一周期非金属元素对应氧化物水化物的酸性从左到右依次增强”的说法正确吗?提示:不正确。同一周期,随着原子序数的递增,非金属元素最高价氧化物对应的水化物(即最高价含氧酸)酸性逐渐增强,但低价含氧酸(如HClO)不符合此规律。
(3)同周期元素的离子半径从左到右依次减小吗?以第3周期元素的离子半径说明。提示:不是。如第3周期部分元素的离子半径由大到小的顺序为r(P3-)>r(S2-) >r(Cl-)>r(Na+)>r(Mg2+)>r(Al3+)。
【案例示范】【典例】同周期三种元素X、Y、Z的最高价氧化物对应的水化物分别是HXO4、H2YO4、H3ZO4,下列判断正确的是( )A.含氧酸的酸性:HXO4
【解析】选C。HXO4、H2YO4、H3ZO4,X、Y、Z的最高正价分别为+7、+6、+5,所以X、Y、Z的原子序数依次减小,同周期元素自右向左,酸性:H3ZO4
(2)判断X、Y、Z三种元素单质的氧化性强弱。提示:单质的氧化性为X>Y>Z。根据三种元素的最高价氧化物对应的水化物的化学式可以判断三种元素的非金属性为X>Y>Z,因此单质的氧化性为X>Y>Z。
(3)判断X、Y、Z三种元素气态氢化物的还原性强弱。提示:气态氢化物的还原性同简单阴离子的还原性相同,因此为ZH3>H2Y>HX。
【知识·巩固】1.R、W、X、Y、Z为原子序数依次递增的同一短周期的元素,下列说法一定正确的是(m、n均为正整数)( )A.若最高价氧化物的水化物R(OH)n为强碱,则W(OH)m也为强碱
B.若最高价氧化物的水化物HnXOm为强酸,则Y是活泼非金属元素C.若Y的最低化合价为-2,则Z的最高正化合价为+6D.若X的最高正化合价为+5,则5种元素都是非金属元素
【解析】选B。若R、W分别为Na、Mg,Mg(OH)2不是强碱,A错误;若HnXOm为强酸,即X的非金属性强,可知Y的非金属性更强,B正确;若Y的最低化合价为-2,为第ⅥA族元素,则Z在第ⅦA族,最高化合价为+7(氟除外),C错误;若X的最高正化合价为+5,位于第ⅤA族,则R可能为Al,D错误。
2.(2020·石家庄高一检测)X、Y为同一周期的元素,如果X的原子半径大于Y的原子半径,则下列说法不正确的是( )A.若X、Y均为金属元素,则X的金属性强于Y
B.若X、Y均为金属元素,则X的阳离子的氧化性比Y的阳离子的氧化性强C.若X、Y均为非金属元素,则Y的气态氢化物比X的气态氢化物稳定D.若X、Y均为非金属元素,则Y的最高价含氧酸的酸性强于X的最高价含氧酸
【解析】选B。X、Y为同一周期元素,X的原子半径大于Y的原子半径,则X的原子序数小于Y的原子序数,即Y在X的右边。依据同周期元素的性质递变规律知,若X、Y均为金属元素,从X到Y,金属性逐渐减弱,元素原子的还原性逐渐减弱,其形成的阳离子氧化性增强,A项正确,B项错误;若X、Y均为非金属元素,同周期元素的非金属性逐渐增强,气态氢化物的稳定性也逐渐增强,C、D项均正确。
3.下列说法正确的是( )A.同周期金属元素的化合价越高,其原子失电子能力越强B.同周期元素的离子半径以ⅦA族的为最小
C.C、P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强D.第3周期非金属元素含氧酸的酸性从左到右依次增强
【解析】选C。同周期金属元素,从左到右化合价依次升高,因为原子半径依次减小,核电荷数依次增多,所以原子失电子能力依次减弱。如第3周期元素Na、Mg、Al,化合价:Na(+1)
r(Al3+),B不正确;P、S、Cl在周期表中属于同周期元素,从左到右元素原子的得电子能力和最高价氧化物对应水化物的酸性依次增强,酸性:H3PO4
知识点二 元素原子得失电子能力强弱的判断依据1.元素原子失去电子能力强弱的判断依据(1)金属活动性顺序表中越靠前,金属原子失电子能力越强。(2)同一周期的金属元素,从左往右,原子失电子能力依次减弱。
(3)金属与水或酸置换出氢时,置换反应越容易发生,金属原子失电子能力越强。(4)金属与盐溶液反应,较活泼金属(失电子能力强)置换出较不活泼的金属。(5)最高价氧化物对应的水化物碱性越强,失电子能力越强。
2.元素原子得电子能力强弱的判断依据(1)同周期的非金属元素,从左到右得电子能力依次增强(不包括稀有气体)。(2)非金属元素最高价氧化物对应水化物的酸性越强,得电子能力越强。
(3)非金属元素的单质与氢气化合越容易,得电子能力越强;生成的气态氢化物越稳定,得电子能力越强。(4)不同的非金属单质M和N在溶液中发生置换反应,若M能置换出N,则得电子能力M>N。
【易错提醒】正确理解元素的金属性和非金属性(1)元素金属性、非金属性的强弱与元素原子失去或得到电子的难易程度有关,与失去或得到电子的数目无关。如Na在反应中易失去1个电子,Al在反应中易失去3个电子,但金属性:Na>Al。
(2)不能理解为某元素的金属性越强,则非金属性越弱。例:Na金属性很强,Na没有非金属性;F非金属性强,它没有金属性。
(3)通常根据最高价氧化物对应水化物的酸性或碱性的强弱判断元素非金属性或金属性的强弱,而不是根据其他化合物酸性或碱性的强弱来判断。(4)不能认为失电子难的原子得电子能力一定强。例:He既难失电子,也难得电子。
【方法规律】元素原子得电子能力强弱的三种判断(1)与同一种多价金属反应后金属价态的变化。反应后金属价态越高,其元素得电子能力越强。例如,Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,说明得电子能力Cl>S。
(2)阴离子的还原性越强,说明阴离子越易失电子,则对应的这种非金属原子则越不易得电子,其得电子能力就越弱。例如,Cl-比S2-还原性弱,说明Cl2的氧化性比S的强。
(3)根据元素在元素周期表中的相对位置,在元素周期表右上方的元素原子得电子能力较强。例如,氟元素是元素周期表中最右上角的非金属元素(稀有气体除外),所以氟元素是非金属性最强的元素。
【思考·讨论】(1)元素原子失电子数目越多,失电子能力越强吗?提示:不是。元素原子失电子能力只与失电子难易程度有关,而与失电子的多少无直接关系。
(2)如何根据金属活动性顺序表判断金属单质失电子能力?提示:金属活动性顺序表中从左到右金属的金属性逐渐减弱,失电子能力逐渐减弱。
(3)非金属元素单质与H2反应的条件越难,生成相应的氢化物越稳定?提示:不对。非金属元素单质与H2反应的条件越易,生成相应的氢化物才越稳定。
(4)能否根据HCl的酸性比H2S强的事实推断氯的非金属性比硫强?提示:不能。判断非金属性强弱的依据是气态氢化物的稳定性或者是最高价氧化物对应的水化物的酸性强弱。
【案例示范】【典例】(2020·合肥高一检测)甲、乙两种非金属:①甲比乙容易与H2化合;②甲原子能与乙阴离子发生置换反应;③甲的最高价氧化物对应的水化物的酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时,甲原子得电子数目比乙的多;⑤甲的单质熔、沸点比乙的低。能说明甲比乙的非金属性强的是( )A.④B.只有⑤C.①②③D.①②③④
【解题指南】解答本题,要注意以下两点:(1)“非金属性”就是“得电子的能力”;(2)“强”就是“易得”,不要与得到的多少相混淆。
【解析】选C。非金属元素原子得电子能力越强越容易与H2化合,其最高价氧化物对应的水化物酸性越强,所以①③正确。非金属元素原子得电子能力强的置换非金属元素原子得电子能力弱的,②正确。得电子数目的多少,单质熔、沸点的高低与得电子能力的强弱无关,④⑤错。
【情境·迁移】某兴趣小组同学做了如右实验:实验中能观察到什么现象?能否通过该实验证明氯的非金属性比硫强呢?
提示:试管内有浅黄色沉淀生成;能,由于Cl2置换出了单质硫,说明Cl2的氧化性大于S。
【知识·巩固】1.能证明Al的金属性比Mg弱的实验事实是( )A.Al的导电性比Mg强B.Al的原子半径比Mg小C.Al(OH)3能溶于NaOH溶液,而Mg(OH)2则不能D.Mg(OH)2的溶解度比Al(OH)3的溶解度略大
【解析】选C。元素的金属性是指元素原子的失电子能力。金属的导电性、溶解度与元素的金属性强弱无关;原子半径大小不能作为判断元素金属性强弱的依据。
2.下列事实不能作为实验判断依据的是( )A.钠和镁分别与冷水反应,判断金属活动性强弱B.铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱
C.酸性H2CO3
【补偿训练】1.(2020·莱芜高一检测)能说明Cl的非金属性比S的非金属性强的是( )A.含氧酸的酸性:HClO3强于H2SO4B.Cl的最高正价比S的最高正价要高C.气态氢化物溶于水后的酸性:HCl比H2S强D.Cl2能与Fe反应生成FeCl3而S与Fe反应生成FeS
【解析】选D。比较酸性时,应比较最高价含氧酸,A错误;化合价越高,元素的非金属性不一定越强,如I的最高正价比S的最高正价高,但非金属性S>I,故B错误;氢化物的稳定性能用于比较非金属性的强弱,但其酸性不能,C错误;D项Cl2能使Fe氧化为+3价而S只能氧化Fe为+2价,说明氧化性Cl2>S,故得电子能力Cl>S,D正确。
2.对四种金属G、L、M、R进行如下实验:
根据表中所给实验结果,判断这四种金属活泼性由强到弱的顺序正确的是( )A.L、G、R、M B.G、L、M、RC.L、G、M、RD.L、R、G、M
【解析】选C。G和冷水不反应,L与冷水慢慢反应,可知L的活泼性比G强;G、L与盐酸反应并放出气体,M、R不反应,可知G、L的活泼性比M、R强;G、M与Rn+的水溶液反应,可知G、M的活泼性比R强。综上可知,四种金属活泼性由强到弱的顺序为L、G、M、R。
化学必修 第二册第3节 元素周期表的应用图片课件ppt: 这是一份化学必修 第二册第3节 元素周期表的应用图片课件ppt,共56页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教课内容ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教课内容ppt课件,共40页。PPT课件主要包含了学习目标导航,任务分项突破,学科素养测评,课堂小结提升,不溶解,提示可以,归纳拓展,SiPSCl,活泼的金属,非金属等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用图片ppt课件: 这是一份高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用图片ppt课件,共41页。PPT课件主要包含了[知识梳理],无色气泡冒出,无现象,不反应,注意对比实验现象,不溶解,NaOH,NaMgAl,SiH4,PH3等内容,欢迎下载使用。













