

【化学】内蒙古集宁一中2019-2020学年高二下学期第三次月考 试卷
展开内蒙古集宁一中2019-2020学年高二下学期第三次月考
可能用到的原子相对质量: H:1 C:12 O:16 Na:23 Cl:35.5 Fe:56
第Ⅰ卷(选择题 共42分)
一.选择题(在下列各题的四个选项中,只有一项是最符合题意的。每小题3分,共42分。)
1.化学与人类生产、生活、社会可持续发展密切相关,下列说法正确的是( )
A.医用酒精的浓度为 95%,此浓度杀灭新冠病毒效果最好
B.SO2排放会导致的环境污染是酸雨
C.煤经过气化和液化等物理变化可转化为清洁燃料
D.“水滴石穿,水乳交融”都不涉及化学变化
2.NA是阿伏加德罗常数的值。下列说法正确的是( )
A.常温常压下,11.2 L SO2含有的氧原子数小于NA
B.0. 1 mol Na2O2和Na2O的混合物中含有的离子总数等于0.4NA
C.10 g质量分数为34%的H2O2溶液含有的氢原子数为0.2NA
D.100 mL 0.1 mol/L醋酸中含有的醋酸分子数是0.01NA
- 下列指定反应的离子方程式正确的是( )
A.电解饱和MgCl2溶液:2Cl-+2H2O2OH-+H2↑+Cl2↑
B.向酸性KMnO4溶液通SO2:3SO2+2MnO4-+4OH-===2MnO2↓+3SO42-+2H2O
C.向Fe(NO3)2稀溶液中滴加足量氢碘酸:3Fe2++NO3-+4H+===3Fe3++NO↑+2H2O
D.向NaClO溶液中通入足量CO2:ClO-+CO2+H2O===HClO+HCO3-
4.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.“84”消毒液中,SiO32-、CO32-、Na+、K+
B.的溶液中NH4+、Ca2+、C1-、NO3-
C.0.1mol/LNaA1O2溶液中:HCO3-、NH4+、SO32-、Fe3+
D.pH=1的溶液中:Na+、K+、Cl-、S2O32-
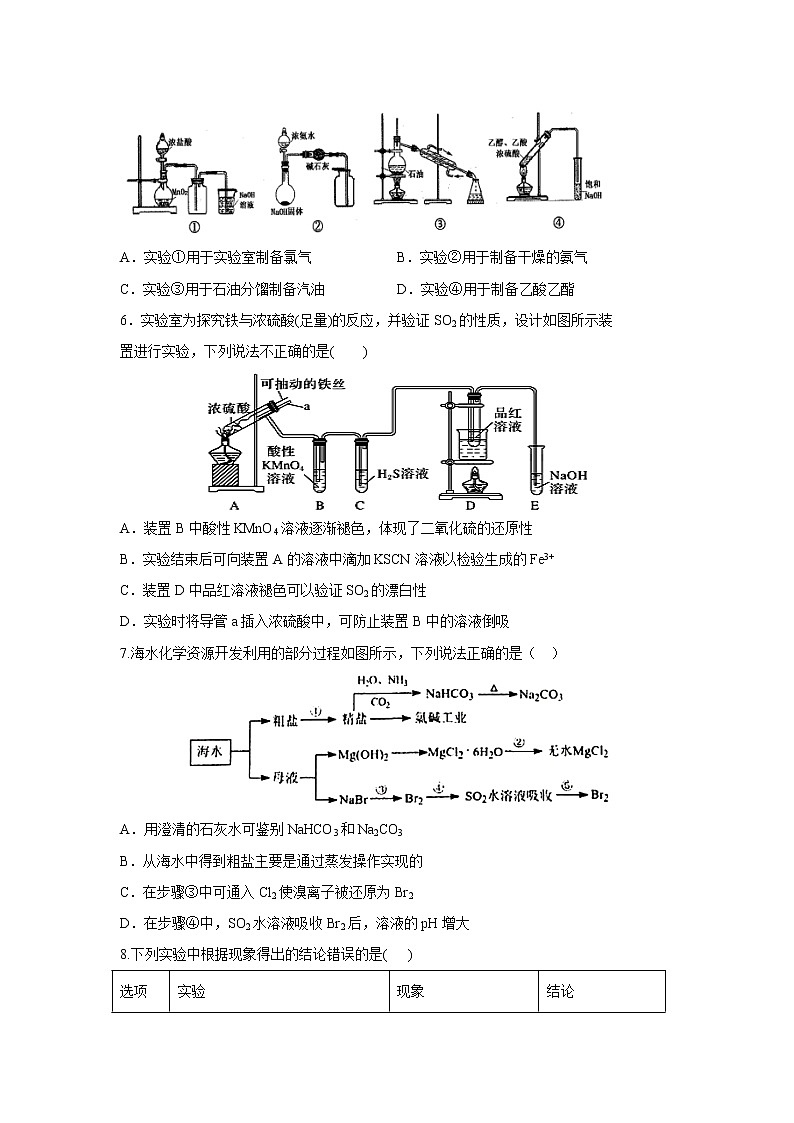
5.下列有关实验能达到相应实验目的的是( )
A.实验①用于实验室制备氯气 B.实验②用于制备干燥的氨气
C.实验③用于石油分馏制备汽油 D.实验④用于制备乙酸乙酯
6.实验室为探究铁与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装
置进行实验,下列说法不正确的是( )
A.装置B中酸性KMnO4溶液逐渐褪色,体现了二氧化硫的还原性
B.实验结束后可向装置A的溶液中滴加KSCN溶液以检验生成的Fe3+
C.装置D中品红溶液褪色可以验证SO2的漂白性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
7.海水化学资源开发利用的部分过程如图所示,下列说法正确的是( )
A.用澄清的石灰水可鉴别NaHCO3和Na2CO3
B.从海水中得到粗盐主要是通过蒸发操作实现的
C.在步骤③中可通入Cl2使溴离子被还原为Br2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH增大
8.下列实验中根据现象得出的结论错误的是( )
选项 | 实验 | 现象 | 结论 |
A | 相同条件下,用1mol/L的CH3COOH和1mol/L的HCl分别做导电性实验 | CH3COOH溶液对应的灯泡较暗 | CH3COOH是弱电解质 |
B | 向某溶液中加铜和浓H2SO4 | 试管口有红棕色气体产生 | 原溶液可能含有NO3- |
C | 向某钠盐中滴加浓盐酸,将产生的气体通入品红溶液 | 品红溶液褪色 | 该钠盐为Na2SO3或NaHSO3 |
D | 向浓度均为0.1 mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 | 先出现蓝色沉淀 | Ksp[Mg(OH)2]> Ksp[Cu(OH)2] |
A.A B.B C.C D.D
9.青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中
受限制的46种化学品之一,青石棉的化学式为:Na2Fe5Si8O22(OH)2,青石棉
用稀硝酸溶液处理时,还原产物只有NO,下列说法中正确的是( )
A.青石棉是一种易燃品,且易溶于水
B.青石棉的化学组成用氧化物的形式可表示为:Na2O·3FeO·Fe2O3·8SiO2·H2O
C.1mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗8.5 L 2 mol/L HNO3溶液
D.Na2Fe5Si8O22(OH)2不能和氢氟酸作用
10.以高硫铝土矿(主要成分为Al2O3、Fe2O3,还含有少量FeS2)为原料,生产氧
化铝并获得Fe3O4的部分工艺流程如下,下列叙述不正确的是( )
A.加入CaO可以减少SO2的排放同时生成建筑材料CaSO4
B.向滤液中通入过量CO2、过滤、洗涤、灼烧沉淀可制得Al2O3
C.隔绝空气焙烧时理论上反应消耗的n(FeS2)∶n(Fe2O3)=1∶5
D.烧渣分离可以选择用磁铁将烧渣中的Fe3O4分离出来
11.有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、AlO2-、Al3+、CO32-、NO3-中的几种,向该溶液中逐滴加入一定量1 mol/L NaOH溶液,开始没有沉淀产生,而后才有沉淀产生。则下列判断正确的是( )
A.溶液中可能含有AlO2-
B.溶液中可能含有NO3-
C.溶液中一定不含Fe2+和Fe3+
D.溶液中可能含有Fe3+,但一定不含Fe2+
12.在一定量铁的氧化物中,加入45 mL4 mol/L硫酸溶液恰好完全反应,所得溶液中Fe2+能恰好被标准状况下672mL氯气氧化。则该固体中铁原子和氧原子的个数之比为( )
A.5:6 B.7:9 C.3:4 D.2:3
13.主族元素X、Y、Z、W、R、T的原子序数依次增大,且均不大于20。其中X-的电子层结构与氦相同,R和Y同族,Y元素的某种单质是一种自来水消毒剂;Z3+和Y2-具有相同的电子层结构;T、W、Y三种元素组成盐T2WY3的溶液通入过量CO2后产生白色沉淀。下列说法不正确的是( )
A.原子半径:T>R>W>Z
B.T和R形成化合物的水溶液呈碱性
C.化合物TX具有很强的还原性,可与水反应
D.T、R、Z三种元素的最高价氧化物对应的水化物两两能发生反应
14.某有机物的结构简式如下图所示,下列有关该有机物的说法正确的是( )
A.该有机物的化学式为C10H14
B.它的一氯代物有6种
C.该有机物分子中所有碳原子一定在同一平面上
D.一定条件下,它可以发生取代、 加成和氧化反应
第II卷(非选择题 每空2分 共58分)
15.(15分)下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。
(1)写出化学式A ,D ,F ;
(2)鉴定G中阳离子的实验方法和现象_____________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式 、
。
(4)常温下,电解B溶液制得pH = 12的烧碱溶液1000mL则反应中转移的电子数目为 。
16.(27分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示为下图所示
(1)氨气的电子式___________,副产品的一种用途为____________ 。
(2)上述流程中 X 物质的结构式________。
(3)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水中,再加
。
(4)如图是在实验室中模拟“氨碱法”制取 NaHCO3 的部分装置。
完成下列填空:
仔细观察两只通气导管内所处的位置,由此推断:
气体 a 为_____,气体 b 为_________;两者的通入次序为 。 为防止尾气污染,c 中可放入蘸_____溶液的脱脂棉。
(5)气体 a 与 b 均可用如图装置进行制备。 当锥形瓶中固体为生石灰时,分液漏斗中应盛放_________。 用该装置制备另一种气体的方法是: (用离子方程式表示)。
(6)反应过程中可以看到装置饱和食盐水中有晶体逐渐析出,写出相关反应的化学方程式: 。
(7)反应过程中采用水浴加热,其优势是 。
水浴温度维持在 42℃左右,温度过低,反应速率太慢,不利于晶体析出;温度过高, ,也不利于晶体析出。
(8)反应结束后,将热水浴换成冰水浴,冷却 15min 左右再进行过滤,目的是:
。
(9)得到的 NaHCO3 晶体中会含有少量 NaCl 杂质,可采用如下方法进行纯度测定:
该试样中 NaHCO3 的质量分数为_____。
17.(16分)以镍黄铁矿为原料制备的工艺流程如下:
已知:①高镍锍的主要成分为、、、的低价硫化物及合金;
②氧化性:;
③,,。
回答下列问题:
(1)“酸浸”时,H2SO4溶液需过量,其目的是 。
(2)“过滤”时滤渣1的主要成分是 。
(3)“氧化”时反应的化学方程式为 ,若用NaClO代替H2O2溶液,使0.2molFe2+转化为Fe3+,则需NaClO至少为________mol。
(4)“除铁”的原理是 。
(5)“除钴”时,发生反应的离子方程式为 。
(6)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是
。若“沉镍”后的滤液中,则滤液的________.
参考答案
一.选择题
BADAC BBCBC DBAD
二.非选择题
15(15分)
(1)N2、Cl2、NH3(每空2分)
(2)取少量D的溶液加人试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色(3分)
(3)2OH-+Cl2=ClO-+Cl-+H2O (2分) 8NH3+3Cl2=N2+6NH4Cl (2分)
(4)0.01NA
16(27分,除要求每空2分)
(1) ,做化肥 (每空1分)
(2)O=C=O(每空1分)
(3) 硝酸酸化的硝酸银溶液,观察产生白色沉淀
(4)氨气, 二氧化碳, 先通 a 再通 b, 硫酸
(5)浓氨水 CaCO3+2H+=Ca2++CO2↑+H2O
(6)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(7) 加热平稳,便于控制温度 产物溶解度高
(8)降低碳酸氢钠溶解度,增加碳酸氢钠的析出率,提高产率、
(9)94%
17(16分,每空2分)
(1)提高镍元素的浸取率
(2) Cu,Cu2S
(3) ; 0.1
(4) 调,使解生成沉淀而除去
(5)
(6) 取最后一次洗涤液少量,向其中滴加盐酸酸化的溶液,若无白色沉淀生成,则沉淀已洗涤干净 ; 9








