

还剩21页未读,
继续阅读
【化学】福建省师范大学附属中学2018-2019学年高二(实验班)上学期期中考试(解析版)
展开
福建省师范大学附属中学2018-2019学年高二(实验班)上学期期中考试
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
一、单选题
1.已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应中,在任何温度下都不自发进行的是
A.2O3(g)=3O2(g) △H<0 B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g ) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0
2.对平衡CO2(g)CO2(aq);△H= -19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
A.升温增压 B.降温减压
C.升温减压 D.降温增压
3.下列对钢铁制品采取的措施不能防止钢铁腐蚀的是
A.保持表面干燥 B.表面镀锌 C.表面形成烤蓝 D.表面镶嵌铜块
4.用铁片与稀硫酸反应制取氢气时,下列措施几乎不影响氢气产生速率的是
A.加少量醋酸钠固体 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.加少量硫酸钠固体
5.一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A.混合气体的密度不再变化 B.反应容器中Y的质量分数不变
C.体系压强不再变化 D.2v逆(X)=v正(Y)
6.下列装置或操作能达到目的是
A.装置①探究H2SO4浓度对反应速率的影响 B.装置②可用于测定中和热
C.装置③测定O2的生成速率 D.装置④保护铁闸门不被腐蚀
7.关于下列电化学装置说法正确的是
A.装置①中,构成电解池时Fe极质量既可增也可减
B.装置②工作一段时间后,a极附近溶液的pH减小
C.用装置③精炼铜时,d极为精铜
D.装置④中电子由Fe经导线流向Zn
8.298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式正确的是
A.Se(s)+H2(g)=H2Se(g) ΔH=-242kJ·mol-1 B.Se(s)+H2(g)=H2Se(g)ΔH=-20kJ·mol-1
C.Se(g)+H2(g)=H2Se(g) ΔH=+81kJ·mol-1 D.Se(s)+H2(g)=H2Se(g) ΔH=+81kJ·mol-1
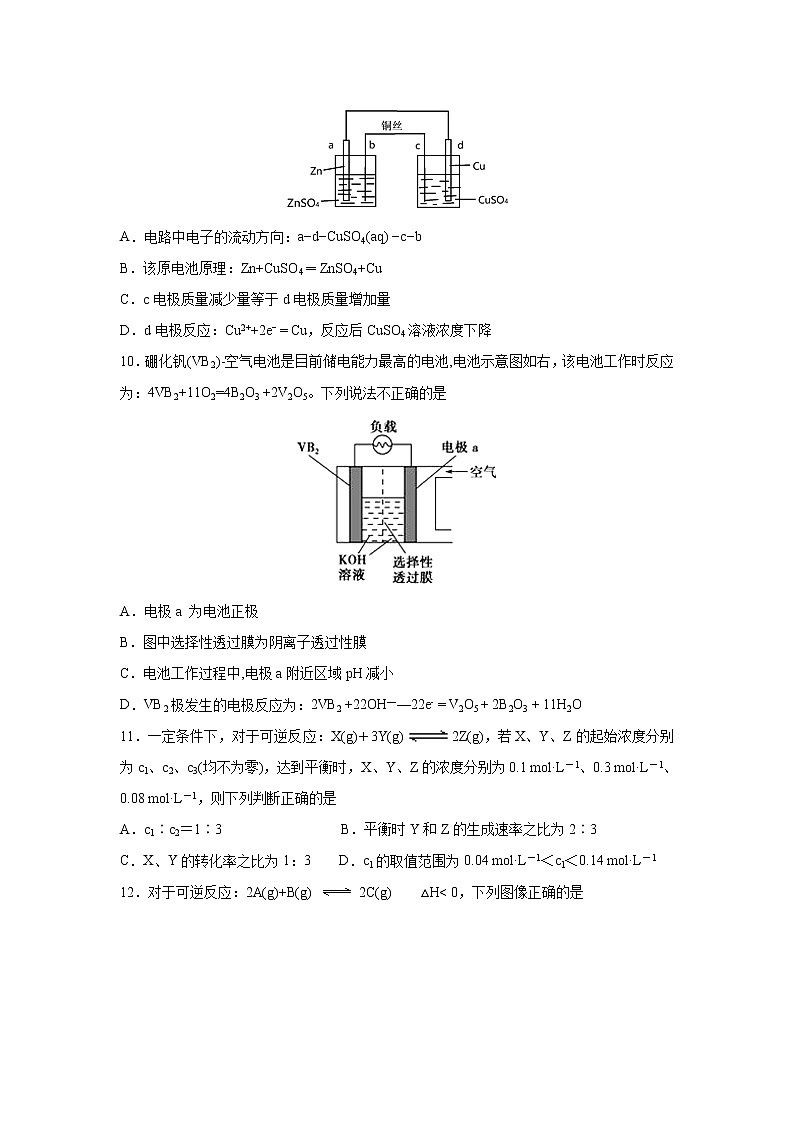
9.根据图,下列判断中正确的是
A.电路中电子的流动方向:a−d−CuSO4(aq) −c−b
B.该原电池原理:Zn+CuSO4 ═ ZnSO4+Cu
C.c电极质量减少量等于d电极质量增加量
D.d电极反应:Cu2++2e− = Cu,反应后CuSO4溶液浓度下降
10.硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如右,该电池工作时反应为:4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是
A.电极a 为电池正极
B.图中选择性透过膜为阴离子透过性膜
C.电池工作过程中,电极a附近区域pH减小
D.VB2极发生的电极反应为:2VB2 +22OH——22e- = V2O5 + 2B2O3 + 11H2O
11.一定条件下,对于可逆反应:X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=1∶3 B.平衡时Y和Z的生成速率之比为2∶3
C.X、Y的转化率之比为1:3 D.c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1
12.对于可逆反应:2A(g)+B(g) 2C(g) △H< 0,下列图像正确的是
13.下列有关图像,其中说法正确的是
A.由图Ⅰ知,反应在 T1、T3 处达到平衡
B.由图Ⅰ知,该反应的△H<0
C.由图Ⅱ知,t3时采取降低反应温度的措施
D.由图Ⅱ知,反应在 t6时,NH3 体积分数最大
14.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4的沸点为 42.2℃,固体杂质不参与反应。第一阶段:将粗镍与 CO 反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是
A.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
B.增大c(CO),平衡正向移动,反应的平衡常数增大
C.第二阶段,Ni(CO)4分解率较低
D.增加Ni的含量,CO的转化率增大
15.清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是
A.X电极连接电源负极
B.N为阳离子交换膜
C.Y电极反应式为 O2+2H2O+4e-=4OH-
D.制备2.4g LiOH产生的H2在标准状况下为2.24 L
16.某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小 为:c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
17.在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表,下列说法不正确的是
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.10
0.10
0.09
②
800
0.20
0.20
0.10
③
900
0.10
0.15
a
A.正反应为放热反应
B.实验①中,若5min时测得n(M)=0.05mol,则0~5min时间内,用N表示的平均反应速率v(N)= 0.01mol/(L•min)
C.实验②中,该反应的平衡常数K=1.0
D.实验③中,达到平衡时,a大于0.06
18.如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)2Z(g) ΔH=-192kJ·mol-1。向M、N中都通入amolX和bmolY的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变。下列说法一定正确的是
A.平衡时,X的体积分数:M
C.若a∶b=1∶3,当M中放出172.8kJ热量时,X的转化率为90%
D.若a=1.2,b=1,并且N中达到平衡时体积为2L,此时含有0.4molZ,则再通入0.36molX时,υ(正)<υ(逆)
二、实验题
19.(1)化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的________来实现;在KMnO4与H2C2O4反应中,可通过观察单位时间内_________变化来测定该反应的速率;在Na2S2O3+H2SO4==Na2SO4+S↓+SO2+H2O反应中,该反应速率的快慢可通过_______来判断。
(2)已知:Na2S2O3 + H2SO4 == Na2SO4 + SO2↑+ S↓+ H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号
反应温度
Na2S2O3浓度
稀硫酸
H2O
V/mL
c/(mol/L)
V/mL
c/(mol/L)
V/mL
①
20
10.0
0.10
10.0
0.50
0
②
40
V1
0.10
V2
0.50
V3
③
20
V4
0.10
4.0
0.50
V5
该实验①、②可探究___________对反应速率的影响,因此V1、V2和V3分别是________、________、________。实验①、③可探究__________对反应速率的影响,因此V4、V5分别是_________、_________。
三、填空题
20.(1)下图中甲池的总反应式为N2H4+O2===N2+2H2O。甲池中负极上的电极反应式为_________,乙池中石墨电极上发生的反应为_______________。甲池中每消耗0.1 mol N2H4,乙池电极上则会析出_________ g固体。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的_______极(填“正”或“负”)。F电极上的电极反应式为______________。
(3)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。S(g)在负极生成SO3的电极反应式为____________________。已知S(g)在负极发生的反应为可逆反应,为提高硫蒸气的转化率,该工艺采取的措施有____________(任写一条)。
21.氨是重要的氮肥,合成原理为: N2(g)+3H2(g)2NH3(g) △H= —92.4 kJ/mol。在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图,回答下列问题:
(1)10 min内以NH3表示的平均反应速率:______;
(2)在10 ~20 min内:NH3浓度变化的原因可能是______________
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的平衡常数K1 = _________________(带数据的表达式),第2次平衡时NH3的体积分数=___________(小数点后保留一位);
(4)在反应进行至25 min时:①曲线发生变化的原因______________,② 达第二次平衡时,新平衡的平衡常数K2 ____ K1(填“大于”“等于”或“小于”)。
22.(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式
平衡常数
①
2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) ΔH1=a kJ∙mol-1
K1
②
4NO2(g)+2NaCl(s)2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ∙mol-1
K2
③
2NO(g)+Cl2(g)2NOCl(g) ΔH3
K3
则该温度下,ΔH3=_______________kJ∙mol-1;K3=_____________(用K1和K2表示)。
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
23.恒温、恒压下,在一个可变容积的容器中发生反应:A(g)+B(g) C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时n(A)为________mol。
(2)若开始时放入3molA和3molB,达到平衡后,生成n(C)为________mol。
(3)若开始时放入x mol A、2mol B和1mol C,达到平衡后,A和C的物质的量分别是ymol和3amol,则x=________,y=________。平衡时,n(B)________(填序号)。
A.大于2mol B.等于2mol C.小于2mol D.可能大于、等于或小于2mol
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是________。
(5)若保持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。开始时放入1molA和1molB,达到平衡后,生成b molC,将b与a进行比较,则________(填序号)。
A.ab C.a=b D.不能比较
参考答案
1.B
【解析】
A.△H<0,△S>0,根据△G=△H-T△S可知,一般温度下都能满足△H-T?△S<0,反应可自发进行,选项A不选;B.△H>0,△S<0,一般情况下都满足△G=△H-T△S>0,反应不能自发进行,选项B选;C.△H<0,△S<0,在较高温度下,可满足△H-T△S<0,反应可自发进行,选项C不选;D.△H>0,△S>0,在较高温度下,可满足△H-T△S<0,反应可自发进行,选项D不选。答案选B。
点睛:本题考查反应热与焓变,题目难度不大,注意反应能否自发进行,反应能否自发进行取决于△G=△H-T△S,当△G=△H-T△S<0时,反应可自发进行,否则不能。
2.D
【解析】
气体在水中的溶解度随着温度的升高而降低,所以要使CO2在水中的溶解度增大,可以降低温度,同时还可增大压强。
3.D
【解析】
【详解】
A.将钢铁制品放置在干燥处,使金属不具备生锈的条件:和水接触,所以能防止或减缓钢铁腐蚀,故A不选;B.在钢铁制品表面镀一层金属锌,采用的是牺牲阳极的阴极保护法,所以能防止或减缓钢铁腐蚀,故B不选;C.烤蓝能使铁制品与氧气和水隔绝,可以防止钢铁制品生锈,故C不选;D.在表面镶嵌铜块,形成的原电池中,金属铁做负极,可以加快腐蚀速率,此法不能防止或减缓钢铁腐蚀,故D选;故选D。
【点睛】
本题考查金属的腐蚀与防护,明确金属被腐蚀的原因是解本题关键。解答本题需要知道常见的防止金属腐蚀的方法。本题的易错点为C,要注意烤蓝主要指利用化学反应使铁器表面生成四氧化三铁。
4.D
【解析】
【详解】
A.加入少量CH3COONa固体,稀硫酸和CH3COONa反应生成弱酸CH3COOH,氢离子浓度减小,反应速率减慢,故A不选;B.浓硫酸和Fe发生钝化,且浓硫酸和Fe反应生成二氧化硫而不是氢气,故B不选;C.滴加少量CuSO4溶液,置换出铜,形成原电池反应,反应速率增大,故C不选;D.加入少量的硫酸钠,氢离子浓度不变,反应速率不变,故D选;故选D。
【点睛】
本题考查影响化学反应速率因素,明确温度、压强、浓度、催化剂等因素对化学反应速率影响原理是解本题关键。本题的易错点为BC,B中要注意浓硫酸的特殊性,C中要注意能够形成锌铜原电池。
5.D
【解析】
分析:A.该反应为气体的质量减小的反应,恒容条件下当混合气体的密度不再变化,说明气体的质量不变;B. 反应容器中Y的质量分数不变,说明各物质的质量不变;C.该反应为气体总量减小的反应,体系压强不再变化,说明气体的物质的量不变;D.达到平衡状态,满足v逆(X)=2v正(Y)。
详解:恒容容器中,混合气体的密度不再变化,说明气体的质量不变,反应达平衡状态,A错误;反应容器中Y的质量分数不变,说明各物质的质量不变,则反应达平衡状态,B错误;体系压强不再变化,说明气体的物质的量不变,反应达平衡状态,C错误;不满足速率之比和系数成正比关系,D正确;正确答案:D。
6.D
【解析】
【详解】
A.溶液总体积不同,硫酸浓度和硫代硫酸钠的浓度都不同,则装置①不能探究H2SO4浓度对反应速率的影响,故A错误;B.泡沫隔热,温度计测定反应温度,但缺少环形玻璃搅拌棒,装置②不能用于测定中和热,故B错误;C.可由刻度读出生成的气体的体积,但缺少秒表,无法记录需要的时间,不能测定O2的反应速率,故C错误;D.铁闸门与电源负极相连,为阴极,则能保护铁闸门不被腐蚀,故D正确;故选D。
7.A
【解析】
分析:A.铁做阳极时,质量减轻,铁做阴极时,铜离子在此极析出,质量增加;B.氢离子在阴极得电子,生成氢气,氢离子浓度减小,pH增大;C. 精炼铜时,粗铜做阳极;D.电子由负极经过导线流向正极。
详解:如果铁连在电源的正极,做电解池阳极时,失电子,不断溶解,铁极质量减轻,如果铁连在电源的负极,做电解池阴极时,不发生反应,溶液中的铜离子在此极析出,Fe极质量增加,A正确;a极与电源负极相连,作阴极,氢离子在阴极得电子,发生还原反应2H++2e-=H2↑,则a极附近溶液的pH增大,B错误;精炼铜时,粗铜作阳极,与电源正极相连,则d极为粗铜,C错误;装置④为原电池,活泼性:Zn>Fe,则Zn 失电子作负极,电子由Zn流向Fe ,D错误;正确选项A。
8.D
【解析】
能量越低越稳定,H2O、H2S、H2Se、H2Te稳定性减弱,所以b表示Te与H2化合的反应热数据,故AB错误;Se是固体,所以Se与H2化合的热化学反应方程式是Se(s)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1,故C错误、D正确;
9.C
【解析】
【分析】
根据图示,左边为锌-铜-硫酸锌原电池,锌做负极,铜做正极,锌发生吸氧腐蚀;右边为电解池,电极都是铜,电解质为硫酸铜溶液,是电镀池,据此分析解答。
【详解】
A.电路中电子只能通过外电路,不能通过电解质溶液,溶液是通过自由移动的离子导电的,故A错误;B.装置中左边为原电池,锌做负极,铜做正极,右边为电解池,原电池反应是吸氧腐蚀,故B错误;C.右边为电解池,是电镀装置,c电极为阳极,铜逐渐溶解,d电极为阴极,析出铜,c电极质量减少量等于d电极质量增加量,故C正确;D.右边为电解池,是电镀装置,d电极反应:Cu2++2e-=Cu,反应后CuSO4溶液浓度基本不变,故D错误;故选C。
10.C
【解析】
A、电极a通入空气,则电极a为正极,故A说法正确;B、电极a的反应式为:O2+2H2O+4e-=4OH-,负极反应式为:2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O,OH-需要向负极移动,因此选择性透过膜为阴离子透过性膜,故B说法正确;C、根据B选项分析,电极a产生OH-,pH增大,故C说法错误;D、根据电池总反应,负极反应式为2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O,故D说法正确。
点睛:本题的难点是负极反应式的书写,一般写出还原剂和氧化产物,VB2→V2O5+2B2O3,根据化合价的变化写出失去电子物质的量,即2VB2-22e-→V2O5+2B2O3,因为环境是碱性,因此OH-在负极上参与反应,生成H2O,根据电荷守恒,原子守恒,配平其他,即负极反应式为2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O。
11.A
【解析】
由于X和Y的化学计量数之比使1∶3的,而平衡时X和Y的浓度之比也是1∶3的,所以起始时X和Y的浓度之比就是1∶3的,A正确。平衡时Y和Z的生成速率之比为3∶2,B不正确。X、Y的转化率之比为1:1,C不正确。如果开始向正反应方向进行,则2(c1-0.1)=0.08-c3,解得c1=0.14-c3/2,所以c1的最大值是0.14,所以范围是c1<0.14 mol·L-1,所以D不正确,答案选A。
12.A
【解析】
【详解】
A、该反应为放热反应,温度升高,平衡向逆反应方向移动,B的质量分数增大,故A正确;B、根据反应前后的化学计量数的大小可以看出,增大压强,平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;C、该反应为放热反应,温度升高,平衡向逆反应方向移动,正逆反应速率都增大,且V逆>V正,故C错误;D、该反应为放热反应,温度升高,平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强,平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误;故选A。
【点睛】
本题为化学平衡图像题。本题的易错点为BC,要注意V正、V逆的相对大小与平衡移动方向的关系的判断。
13.B
【解析】
【详解】
A、由图Ⅰ知,反应在T1、T3处反应物和生成物的体积分数相等,但反应不一定达到平衡,故A错误;B、T2-T3升高温度,平衡向着吸热方向进行,反应物体积分数增大,生成物体积分数减小,所以反应正向进行,正反应是放热反应,△H<0,故B正确;C、合成氨的反应属于放热反应,降低温度,反应速率减慢,化学平衡向着放热方向进行,即向正向移动,正反应速率大于逆反应速率,故C错误;D、由图Ⅱ知,t2时刻正逆反应速率都增大且相等,改变的条件是加入催化剂,平衡不移动;t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强,平衡向逆反应方向移动;t5时刻正逆反应速率都增大,且逆反应速率大于正反应速率,改变的条件是升高温度,平衡向逆反应方向移动,所以反应在t1时,NH3体积分数最大,故D错误;故选B。
14.A
【解析】
【分析】
本题主要考查化学平衡,化学平衡常数。A. 将固体杂质分离出去,反应温度大于其沸点;B. 化学平衡常数仅与反应温度有关;C. 第二阶段为第一阶段反应的逆过程,由此计算平衡常数;D. Ni为固体,增加Ni的含量,CO的转化率不变。
【详解】
A.由题干可知,Ni(CO)4的沸点为42.2℃,要想将固体杂质分离出去,应使反应温度大于Ni(CO)4的沸点,此时反应生成的Ni(CO)4为气态,便于分离,因此选50℃,故A项正确;B. 化学平衡常数仅与反应温度有关,与反应物的浓度无直接关系,因此增加c(CO),反应的平衡常数应不变,故B项错误;C. 由题干可知,230℃时,第一阶段反应的平衡常数较小,K=2×10-5,而第二阶段为第一阶段反应的逆过程,因此可判断第二阶段的反应较彻底,即第二阶段Ni(CO)4分解率较高,故C项错误;D. Ni为固体,增加Ni的含量,CO的转化率不变。综上,本题选A。
15.B
【解析】
A.根据以上分析,X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,应与电源正极相连,故A错误;B.由图可知LiOH从最右侧导出,则Li+需通过N进入最右侧,故N为阳离子交换膜,故B正确;C.Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,故C错误;D.制备2.4 g LiOH,n(OH-)==0.1mol,阴极电极反应式为2H2O+2e-=2OH-+H2↑,则n(H2)=0.05mol,为0.05mol×22.4L/mol=1.12L,故D错误;故选B。
点睛:明确各个电极上发生的反应、各个区域电解质溶液成分是解本题的关键,该电解池实质是电解水,根据图知,Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,氢氧根浓度增大,故Y为电解池的阴极;X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,阳极反应式为2H2O-4e-=4H++O2↑。
16.D
【解析】
试题分析:温度越高速率越快,温度T2>T1,达到平衡时b、d点的反应速率为vd<vb,A错误;若T2>T1,由图象可知温度升高AB3的物质的量增大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,B错误;由图可知,横坐标为B2的物质的量,增大一种反应物的量会促进另一种反应物的转化率增大,则B2越大达到平衡时A2的转化率越大,即达到平衡时A2的转化率大小为c>b>a,C错误;由图可知,横坐标为B2的物质的量,增大一种反应物的量必然会促进另一种反应物的转化,则B2越大达到平衡时A2的转化率越大,生成物的物质的量越大,则平衡时AB3的物质的量大小为:c>b>a,D正确;选D。
考点:考查化学平衡移动图像。
17.D
【解析】
【详解】
A.根据表格数据①②知,增大压强平衡不移动,升高温度,后②中M的物质的量小于①的2倍,说明平衡逆向移动,则正反应为放热反应,故A正确;B.实验①中,若5min时测得n(M)=0.05mol,则0至5min时间内,v(M)= =0.01 mol/( L•min),化学反应速率与化学计量数成正比,则用N表示的平均反应速率v(N)=v(M)=0.01 mol/( L•min),故B正确;
C. X(g)+Y(g)⇌M(g)+N(g)
反应前(mol)0.2 0.2 0 0
转化 (mol) 0.1 0.1 0.1 0.1
平衡时(mol) 0.1 0.1 0.1 0.1
则实验②中,该反应的平衡常数K= =1.0,故C正确;D.反应X(g)+Y(g)⇌M(g)+N(g)为气体体积不变的反应,压强不影响化学平衡,若实验①②温度相同,实验②平衡时M的物质的量应该为0.18mol>0.10mol,说明升高温度后平衡向着逆向移动,则该反应为放热反应;若实验④③的温度相同,则平衡时实验④中a=0.06,由于实验④温度较高,且该反应为放热反应,则a<0.06mol,故D错误;故选D。
18.D
【解析】
【分析】
A.N中为恒压,M中随反应进行压强减小,反应过程中N中压强大于M中压强,增大压强,平衡向正反应方向移动;B.向N中再充入a mol X和b mol Y后达到平衡时的状态与未充入X、Y前相同,即互为等效平衡,根据A的分析可以知道N中转化率较大;C.反应初始时X的物质的量未知,故转化率未知;D. 反应温度不变,故通入X前后平衡常数不变,将通入X后反应的浓度商与平衡常数比较,即可知道正逆反应速率的大小;
【详解】
A.N中为恒压,M中随反应进行压强减小,反应过程中N中压强大于M中压强,增大压强,平衡向正反应方向移动,故平衡时,X的体积分数:M>N,故A项错误;B.向N中再充入a mol X和b mol Y后达到平衡时的状态与未充入X、Y前相同,即互为等效平衡,根据A的分析可以知道,平衡时X的转化率:M<N,故B项错误;C.反应初始时X的物质的量未知,故转化率未知,故C项错误;D.若a=1.2,b=1,并且N中达到平衡时体积为2 L,此时含有0.4 mol Z,则:
X(g)+3Y(g)⇌2Z(g)
n0 1.2mol 1mol 0mol
Δn 0.2mol 0.6mol 0.4mol
n平 1mol 0.4mol 0.4mol
则平衡常数K=(0.4/2)2/(1/2)×(0.4/2) 3=10L2/mol2,反应温度不变,故通入X前后平衡常数不变,未再通入X前,平衡时气体总物质的量为1.8 mol,通入0.36 mol X后,气体总物质的量为2.16 mol,由体积比与物质的量比成正比可以知道:1.8/2.16=2/V,计算得出通入X后的体积V=2.4 L,浓度商Qc=(0.4/2.4)2/(1.36/2.4)×(0.4/2.4) 3=10.59>K,故反应应向逆反应方向进行,则通入0.36 mol X时,υ(正)<υ(逆),故D项正确。综上,本题选D。
【点睛】
本题的易错项是C、D,C项中a:b=1:3错误的以X、Y起始物质的量依次为1mol、3mol进行计算;D项中忽略向平衡后的N中通入0.36molX的瞬间引起容器体积的变化。
19.时间 溶液颜色 出现浑浊所需要的时间 温度 10.0 10.0 0 浓度 10.0 6.0
【解析】
【分析】
(1)通过实验测定和谐反应速率,需要借助于某种数据的变化来判断,根据锌粒与不同浓度硫酸反应时有气体生成;KMnO4与H2C2O4反应中有颜色的变化;硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,据此分析解答;
(2)实验①、②的温度不同,故可探究温度对反应速率的影响,而要探究温度对反应速率的影响,则必须保持其他影响因素一致;实验①、③加入的硫酸的量不同,故可探究浓度对反应速率的影响,而要探究硫酸的浓度不同对反应速率的影响,则必须保持其他影响因素一致,据此分析解答。
【详解】
(1)化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的时间长短,来比较锌粒与不同浓度硫酸反应时的速率;在KMnO4与H2C2O4反应中,高锰酸钾溶液是有色溶液,可通过观察单位时间内溶液颜色变化来测定该反应的速率;在Na2S2O3+H2SO4==Na2SO4+S↓+SO2↑+H2O反应中,硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,可以判断反应速率快慢,反应速率越快,出现浑浊时间越短,故答案为:时间;溶液颜色;出现浑浊需要的时间;
(2)实验①、②的温度不同,故可探究温度对反应速率的影响;而要探究温度对反应速率的影响,则必须保持其他影响因素一致:即加入的Na2S2O3溶液的量相同,故V1=10.0mL,加入的硫酸的量相同,故V2=10.0mL,加入水的体积相等,故V3=0;实验①、③加入的硫酸的量不同,故可探究浓度对反应速率的影响;而要探究硫酸的浓度不同对反应速率的影响,则必须保持其他影响因素一致,即加入的Na2S2O3溶液的量相同,故V4=10.0mL,溶液总体积也须相同,故加入的水的体积V5=6.0mL,故答案为:温度;10.0;10.0;0;浓度;10.0;6.0。
【点睛】
本题考查了测定化学反应速率的方法。本题的易错点为(2),要注意探究某种因素对和谐反应速率的影响时,需要保持其他影响因素相同。
20.N2H4+4OH--4e-===N2+4H2O 2H2O-4e-===O2↑+4H+或4OH--4e-===2H2O+O2↑ 12.8 负 ClO- + 2e- + H2O = Cl-+ 2OH- S- 6e- +3O2- = SO3 硫磺(二氧化硫)循环使用;用稀硫酸吸收SO3(减小生成物浓度,有利于提高S转化率)
【解析】
【分析】
(1)甲池为燃料电池,N2H4失电子生成氮气;乙池为电解池,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应;根据电路中每个电极得失电子守恒计算;
(2)原电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,据此图示判断正负极,并书写电极反应式;
(3)根据图示,S转化为SO2和SO3,发生氧化反应,结合电解质为固体金属氧化物书写电极反应式;结合平衡移动原理分析提高转化率的方法。
【详解】
(1)甲池为燃料电池,负极上发生氧化反应,电极反应式为N2H4-4e-+4OH-=N2+4H2O;乙池为电解池,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应,反应式为4OH--4e-=2H2O+O2↑;甲池中每消耗0.1mol N2H4,则根据负极N2H4-4e-+4OH-=N2+4H2O,转移0.4mol电子,所以乙池电极上则会析出×64g/mol=12.8g铜,故答案为:N2H4-4e-+4OH-=N2+4H2O;4OH--4e-=2H2O+O2;12.8。
(2)①燃料电池中,负极上燃料失电子发生氧化反应,化合价升高,正极上氧化剂得电子发生还原反应,化合价降低,根据图知,Mg元素化合价由0价变为+2价、Cl元素化合价由+1价变为-1价,所以E是负极、F是正极,正极上次氯酸根离子得电子和水反应生成氯离子和氢氧根离子,电极反应式为ClO-+2e-+H2O═Cl-+2OH-,故答案为:负;ClO-+2e-+H2O═Cl-+2OH-;
(3)根据图示,S转化为SO2和SO3,S元素的化合价升高,发生氧化反应,则S为负极,通氧气一端为正极,S(g)在负极生成SO2和SO3的电极反应式为S-4e-+2O2-=SO2、S-6e-+3O2-=SO3;若提高转化率,则平衡正向移动,所以可采取硫磺(二氧化硫)循环使用或用稀硫酸吸收三氧化硫,故答案为:S-6e-+3O2-=SO3;硫磺(二氧化硫)循环使用;用稀硫酸吸收三氧化硫。
21.0.005 mol/(L·min) A 45.5 % 移走0.1 mol NH3 等于
【解析】
【分析】
(1)根据反应速率= 计算;
(2)根据图像知,反应速率加快,且10min时各气体的物质的量是连续的,根据三种气体的变化量判断平衡施肥发生移动,再结合影响平衡的因素分析解答;
(3)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;第2次平衡时,根据NH3的体积分数等于氨气的物质的量分数计算;
(4)25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;根据平衡常数的影响因素分析判断。
【详解】
(1)反应速率v(NH3)= = =0.005mol/(L·min),故答案为:0.005mol/(L·min);
(2)由图像可知,各组分物质的量变化增加,即反应速率加快,且10min时变化是连续的,20min达平衡时,△n(N2)=0.35mol-0.25mol =0.1mol,△n(H2)=0.45mol-0.15mol=0.3mol,△n(NH3)=0.3mol-0.1mol =0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小体积相当于增大压强,应该反应物的速率增加倍数大;降低温度,应该反应速率减小;增加NH3物质的量,逆反应速率增加的倍数大;故只有使用催化剂符合,故选A;
(3)由图像可以看出,当反应进行到时20-25min,各物质的量不变,说明反应达到平衡状态,化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,由图象可知,20min达平衡时,n(N2)=0.025mol×10=0.25mol,n(H2)=0.025mol×6=0.15mol,n(NH3)=0.025mol×12=0.3mol,所以所以其平衡常数K= = =;35min时达到第2次平衡,NH3的体积分数= ×100%=45.5%,故答案为:;45.5%;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;由图像可以看出,当反应进行到时35-40min,各物质的量不变,说明反应达到第二次平衡状态,平衡常数只受温度影响,温度不变,平衡常数不变,所以抽去0.1mol氨,此时平衡常数K将不变,故答案为:分离出0.1molNH3;等于。
22.2a-b < 加入催化剂 增大 乙 2 > (MPa)-2
【解析】
【分析】
(1)根据盖斯定律将①×2-②可得:2NO(g)+Cl2(g)⇌2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的;由图Ⅰ虚线知:化学反应速率加快,但平衡不移动,判断改变的条件;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,根据平衡的移动对物质的量的影响,分析判断平均相对分子质量的变化;根据反应③的平衡常数的对数值(lgK)与温度的变化关系图,由于△H3<0,因此升高温度,平衡逆向移动,结合K的变化分析判断正确的曲线;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x,根据三段式计算出25℃时的平衡常数K,再计算lgK,确定a值;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,根据Qc与K的相对大小,判断反应进行的方向,确定v正与v逆的大小;
(3)依据三段式列式计算平衡时气体物质的量,压强之比等于气体物质的量之比,计算得到各气体的分压,结合平衡常数概念计算。
【详解】
(1)已知:①2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g),②4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g),将①×2-②可得:2NO(g)+Cl2(g)⇌2ClNO(g),该反应△H3=2△H1-△H2=2a-b,则平衡常数K3= ,故答案为:2a-b;;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随着反应的进行,温度逐渐升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变△H<0;根据图Ⅰ虚线知:化学反应速率加快,但平衡不移动,因此改变的条件为加入催化剂;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生上述反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,平衡正向进行,气体物质的量减小,气体质量不变,则混合气体的平均相对分子质量将增大;反应③2NO(g)+Cl2(g)2NOCl(g) ΔH3,由于△H3<0,因此升高温度,平衡逆向移动,K减小,则lgK减小,正确的曲线为乙;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x
2NO(g)+Cl2(g)⇌2NOCl(g)
起始量(mol/L) 0.08 0.04 0
变化量(mol/L) 2x x 2x
平衡量(mol/L)0.08-2x 0.04-x 2x
(0.08-2x+0.04-x+2x):(0.08+0.04)=5:6,解得:x=0.02mol,平衡常数K3= =100,lgK= lg100=2,即a=2;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,此时Qc==1.4<K=100,反应向正反应方向进行,v正>v逆,故答案为:<;加入催化剂; 增大;乙;2;>;
(3)若反应条件为压强8MPa,300℃的反应温度下二氧化碳和氢气按1∶3的比例通入,测得二氧化碳的平衡转化率为50%,结合三段式列式计算,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.5 1.5 0.5 0.5
平衡量(mol) 0.5 1.5 0.5 0.5
分压=总压×物质的量分数,则P(CO2)=8× = ,P(H2)=8×=4,P(CH3OH)=8×= ,P(H2O)=8×= ,Kp= =(MPa)-2,故答案为:(MPa)-2。
23.1-a 3a 2 3-3a D a/(2-a) B
【解析】
【分析】
(1)根据化学平衡三段式列式计算;
(2)此时投料是(1)的3倍,生成的n(C) 也为(1)的3倍;
(3)恒温、恒压下到达平衡后,C的物质的量为3amol,说明和(2)所达到的平衡是相同的平衡,由此入手,根据等效平衡的规律分析;
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,此时与(1)中的平衡为等效平衡,且是成比例等效。
(5)后者相当于减小压强,可以分析平衡移动的方向;
【详解】
(1)根据化学平衡三段式列式计算
A(g) + B(g) ⇌ C(g)
n0 1mol 1mol 0mol
Δn a mol a mol a mol
n平 (1-a) mol (1-a) mol a mol
A的物质的量为(1-a)mol。故本题正确答案是为1-a;
(2)若开始时放入3molA和3molB,恒温恒压下最后达到的平衡状态与(1)互为等效平衡,所以到达平衡后,根据(1)中的计算,平衡时A、B、C的物质的量依次为3(1-a)mol、3(1-a)mol、3amol。故本题正确答案是:3a;
(3)恒温、恒压下到达平衡后,C的物质的量为3amol,说明和(2)所达到的平衡是完全等同的等效平衡,根据等效平衡规律,“极限法一边倒”满足A、B起始量分为3mol、3mol,则xmol+1mol=3mol,解得x=2,y=3(1-a);平衡时n(B)=3(1-a)mol,因为01/3,则平衡时B的物质的量小于2mol。因此,本题正确答案是: 3a ;2;3-3a;D;
(4)再加3molC折算成A和B,相当于3molA和3molB,因为是恒温恒压过程,此时与(1)中的平衡为等效平衡,且是成比例等效,
A(g) + B(g) ⇌ C(g)
起始量1 1 mol 1mol 0mol
平衡量1 (1-a) mol (1-a) mol amol
起始量2 6mol 6 mol 0mol
平衡量2 (6-6a) mol (6-6a) mol 6a mol
C的物质的量分数为6a /(6-6a +6-6a +6a) ×100%= a/(2-a)。因此,本题正确答案是: a/(2-a)
(5)恒温、恒压下,放入1molA和1molB,A(g)+B(g)⇌C(g)达到平衡后,生成amolC。恒温、恒容下,放入1molA和1molB,达到平衡后,生成b molC。后者相当于减压,平衡向逆向移动,故a>b,选B。
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
一、单选题
1.已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应中,在任何温度下都不自发进行的是
A.2O3(g)=3O2(g) △H<0 B.2CO(g)=2C(s)+O2(g) △H>0
C.N2(g)+3H2(g)=2NH3(g ) △H<0 D.CaCO3(s)=CaO(s)+CO2(g) △H>0
2.对平衡CO2(g)CO2(aq);△H= -19.75kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
A.升温增压 B.降温减压
C.升温减压 D.降温增压
3.下列对钢铁制品采取的措施不能防止钢铁腐蚀的是
A.保持表面干燥 B.表面镀锌 C.表面形成烤蓝 D.表面镶嵌铜块
4.用铁片与稀硫酸反应制取氢气时,下列措施几乎不影响氢气产生速率的是
A.加少量醋酸钠固体 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.加少量硫酸钠固体
5.一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是
A.混合气体的密度不再变化 B.反应容器中Y的质量分数不变
C.体系压强不再变化 D.2v逆(X)=v正(Y)
6.下列装置或操作能达到目的是
A.装置①探究H2SO4浓度对反应速率的影响 B.装置②可用于测定中和热
C.装置③测定O2的生成速率 D.装置④保护铁闸门不被腐蚀
7.关于下列电化学装置说法正确的是
A.装置①中,构成电解池时Fe极质量既可增也可减
B.装置②工作一段时间后,a极附近溶液的pH减小
C.用装置③精炼铜时,d极为精铜
D.装置④中电子由Fe经导线流向Zn
8.298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式正确的是
A.Se(s)+H2(g)=H2Se(g) ΔH=-242kJ·mol-1 B.Se(s)+H2(g)=H2Se(g)ΔH=-20kJ·mol-1
C.Se(g)+H2(g)=H2Se(g) ΔH=+81kJ·mol-1 D.Se(s)+H2(g)=H2Se(g) ΔH=+81kJ·mol-1
9.根据图,下列判断中正确的是
A.电路中电子的流动方向:a−d−CuSO4(aq) −c−b
B.该原电池原理:Zn+CuSO4 ═ ZnSO4+Cu
C.c电极质量减少量等于d电极质量增加量
D.d电极反应:Cu2++2e− = Cu,反应后CuSO4溶液浓度下降
10.硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如右,该电池工作时反应为:4VB2+11O2=4B2O3 +2V2O5。下列说法不正确的是
A.电极a 为电池正极
B.图中选择性透过膜为阴离子透过性膜
C.电池工作过程中,电极a附近区域pH减小
D.VB2极发生的电极反应为:2VB2 +22OH——22e- = V2O5 + 2B2O3 + 11H2O
11.一定条件下,对于可逆反应:X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol·L-1,则下列判断正确的是
A.c1∶c2=1∶3 B.平衡时Y和Z的生成速率之比为2∶3
C.X、Y的转化率之比为1:3 D.c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1
12.对于可逆反应:2A(g)+B(g) 2C(g) △H< 0,下列图像正确的是
13.下列有关图像,其中说法正确的是
A.由图Ⅰ知,反应在 T1、T3 处达到平衡
B.由图Ⅰ知,该反应的△H<0
C.由图Ⅱ知,t3时采取降低反应温度的措施
D.由图Ⅱ知,反应在 t6时,NH3 体积分数最大
14.常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)Ni(CO)4(g)。230℃时,该反应的平衡常数 K=2×10-5。已知:Ni(CO)4的沸点为 42.2℃,固体杂质不参与反应。第一阶段:将粗镍与 CO 反应转化成气态Ni(CO)4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。下列判断正确的是
A.第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
B.增大c(CO),平衡正向移动,反应的平衡常数增大
C.第二阶段,Ni(CO)4分解率较低
D.增加Ni的含量,CO的转化率增大
15.清华大学王晓琳教授首创三室膜电解法制备LiOH,其工作原理如图所示,下列有关说法正确的是
A.X电极连接电源负极
B.N为阳离子交换膜
C.Y电极反应式为 O2+2H2O+4e-=4OH-
D.制备2.4g LiOH产生的H2在标准状况下为2.24 L
16.某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是
A.在T2和n(A2)不变时达到平衡,AB3的物质的量大小 为:c>b>a
B.若T2>T1,则正反应一定是放热反应
C.达到平衡时A2的转化率大小为:b>a>c
D.若T2>T1,达到平衡时b、d点的反应速率为vd>vb
17.在1L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表,下列说法不正确的是
实验编号
温度/℃
起始时物质的量/mol
平衡时物质的量/mol
n(X)
n(Y)
n(M)
①
700
0.10
0.10
0.09
②
800
0.20
0.20
0.10
③
900
0.10
0.15
a
A.正反应为放热反应
B.实验①中,若5min时测得n(M)=0.05mol,则0~5min时间内,用N表示的平均反应速率v(N)= 0.01mol/(L•min)
C.实验②中,该反应的平衡常数K=1.0
D.实验③中,达到平衡时,a大于0.06
18.如图所示,隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:X(g)+3Y(g)2Z(g) ΔH=-192kJ·mol-1。向M、N中都通入amolX和bmolY的混合气体,初始时M、N两容器的容积相同,保持两容器的温度相同且恒定不变。下列说法一定正确的是
A.平衡时,X的体积分数:M
C.若a∶b=1∶3,当M中放出172.8kJ热量时,X的转化率为90%
D.若a=1.2,b=1,并且N中达到平衡时体积为2L,此时含有0.4molZ,则再通入0.36molX时,υ(正)<υ(逆)
二、实验题
19.(1)化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的________来实现;在KMnO4与H2C2O4反应中,可通过观察单位时间内_________变化来测定该反应的速率;在Na2S2O3+H2SO4==Na2SO4+S↓+SO2+H2O反应中,该反应速率的快慢可通过_______来判断。
(2)已知:Na2S2O3 + H2SO4 == Na2SO4 + SO2↑+ S↓+ H2O。某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号
反应温度
Na2S2O3浓度
稀硫酸
H2O
V/mL
c/(mol/L)
V/mL
c/(mol/L)
V/mL
①
20
10.0
0.10
10.0
0.50
0
②
40
V1
0.10
V2
0.50
V3
③
20
V4
0.10
4.0
0.50
V5
该实验①、②可探究___________对反应速率的影响,因此V1、V2和V3分别是________、________、________。实验①、③可探究__________对反应速率的影响,因此V4、V5分别是_________、_________。
三、填空题
20.(1)下图中甲池的总反应式为N2H4+O2===N2+2H2O。甲池中负极上的电极反应式为_________,乙池中石墨电极上发生的反应为_______________。甲池中每消耗0.1 mol N2H4,乙池电极上则会析出_________ g固体。
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的_______极(填“正”或“负”)。F电极上的电极反应式为______________。
(3)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。S(g)在负极生成SO3的电极反应式为____________________。已知S(g)在负极发生的反应为可逆反应,为提高硫蒸气的转化率,该工艺采取的措施有____________(任写一条)。
21.氨是重要的氮肥,合成原理为: N2(g)+3H2(g)2NH3(g) △H= —92.4 kJ/mol。在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各种物质的量变化如图,回答下列问题:
(1)10 min内以NH3表示的平均反应速率:______;
(2)在10 ~20 min内:NH3浓度变化的原因可能是______________
A.加了催化剂 B.缩小容器体积 C.降低温度 D.增加NH3物质的量
(3)第1次平衡的平衡常数K1 = _________________(带数据的表达式),第2次平衡时NH3的体积分数=___________(小数点后保留一位);
(4)在反应进行至25 min时:①曲线发生变化的原因______________,② 达第二次平衡时,新平衡的平衡常数K2 ____ K1(填“大于”“等于”或“小于”)。
22.(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式
平衡常数
①
2NO2(g)+NaCl(s)NaNO3(s)+NOCl(g) ΔH1=a kJ∙mol-1
K1
②
4NO2(g)+2NaCl(s)2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ∙mol-1
K2
③
2NO(g)+Cl2(g)2NOCl(g) ΔH3
K3
则该温度下,ΔH3=_______________kJ∙mol-1;K3=_____________(用K1和K2表示)。
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)
(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
23.恒温、恒压下,在一个可变容积的容器中发生反应:A(g)+B(g) C(g)
(1)若开始时放入1molA和1molB,达到平衡后,生成amolC,这时n(A)为________mol。
(2)若开始时放入3molA和3molB,达到平衡后,生成n(C)为________mol。
(3)若开始时放入x mol A、2mol B和1mol C,达到平衡后,A和C的物质的量分别是ymol和3amol,则x=________,y=________。平衡时,n(B)________(填序号)。
A.大于2mol B.等于2mol C.小于2mol D.可能大于、等于或小于2mol
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是________。
(5)若保持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。开始时放入1molA和1molB,达到平衡后,生成b molC,将b与a进行比较,则________(填序号)。
A.a
参考答案
1.B
【解析】
A.△H<0,△S>0,根据△G=△H-T△S可知,一般温度下都能满足△H-T?△S<0,反应可自发进行,选项A不选;B.△H>0,△S<0,一般情况下都满足△G=△H-T△S>0,反应不能自发进行,选项B选;C.△H<0,△S<0,在较高温度下,可满足△H-T△S<0,反应可自发进行,选项C不选;D.△H>0,△S>0,在较高温度下,可满足△H-T△S<0,反应可自发进行,选项D不选。答案选B。
点睛:本题考查反应热与焓变,题目难度不大,注意反应能否自发进行,反应能否自发进行取决于△G=△H-T△S,当△G=△H-T△S<0时,反应可自发进行,否则不能。
2.D
【解析】
气体在水中的溶解度随着温度的升高而降低,所以要使CO2在水中的溶解度增大,可以降低温度,同时还可增大压强。
3.D
【解析】
【详解】
A.将钢铁制品放置在干燥处,使金属不具备生锈的条件:和水接触,所以能防止或减缓钢铁腐蚀,故A不选;B.在钢铁制品表面镀一层金属锌,采用的是牺牲阳极的阴极保护法,所以能防止或减缓钢铁腐蚀,故B不选;C.烤蓝能使铁制品与氧气和水隔绝,可以防止钢铁制品生锈,故C不选;D.在表面镶嵌铜块,形成的原电池中,金属铁做负极,可以加快腐蚀速率,此法不能防止或减缓钢铁腐蚀,故D选;故选D。
【点睛】
本题考查金属的腐蚀与防护,明确金属被腐蚀的原因是解本题关键。解答本题需要知道常见的防止金属腐蚀的方法。本题的易错点为C,要注意烤蓝主要指利用化学反应使铁器表面生成四氧化三铁。
4.D
【解析】
【详解】
A.加入少量CH3COONa固体,稀硫酸和CH3COONa反应生成弱酸CH3COOH,氢离子浓度减小,反应速率减慢,故A不选;B.浓硫酸和Fe发生钝化,且浓硫酸和Fe反应生成二氧化硫而不是氢气,故B不选;C.滴加少量CuSO4溶液,置换出铜,形成原电池反应,反应速率增大,故C不选;D.加入少量的硫酸钠,氢离子浓度不变,反应速率不变,故D选;故选D。
【点睛】
本题考查影响化学反应速率因素,明确温度、压强、浓度、催化剂等因素对化学反应速率影响原理是解本题关键。本题的易错点为BC,B中要注意浓硫酸的特殊性,C中要注意能够形成锌铜原电池。
5.D
【解析】
分析:A.该反应为气体的质量减小的反应,恒容条件下当混合气体的密度不再变化,说明气体的质量不变;B. 反应容器中Y的质量分数不变,说明各物质的质量不变;C.该反应为气体总量减小的反应,体系压强不再变化,说明气体的物质的量不变;D.达到平衡状态,满足v逆(X)=2v正(Y)。
详解:恒容容器中,混合气体的密度不再变化,说明气体的质量不变,反应达平衡状态,A错误;反应容器中Y的质量分数不变,说明各物质的质量不变,则反应达平衡状态,B错误;体系压强不再变化,说明气体的物质的量不变,反应达平衡状态,C错误;不满足速率之比和系数成正比关系,D正确;正确答案:D。
6.D
【解析】
【详解】
A.溶液总体积不同,硫酸浓度和硫代硫酸钠的浓度都不同,则装置①不能探究H2SO4浓度对反应速率的影响,故A错误;B.泡沫隔热,温度计测定反应温度,但缺少环形玻璃搅拌棒,装置②不能用于测定中和热,故B错误;C.可由刻度读出生成的气体的体积,但缺少秒表,无法记录需要的时间,不能测定O2的反应速率,故C错误;D.铁闸门与电源负极相连,为阴极,则能保护铁闸门不被腐蚀,故D正确;故选D。
7.A
【解析】
分析:A.铁做阳极时,质量减轻,铁做阴极时,铜离子在此极析出,质量增加;B.氢离子在阴极得电子,生成氢气,氢离子浓度减小,pH增大;C. 精炼铜时,粗铜做阳极;D.电子由负极经过导线流向正极。
详解:如果铁连在电源的正极,做电解池阳极时,失电子,不断溶解,铁极质量减轻,如果铁连在电源的负极,做电解池阴极时,不发生反应,溶液中的铜离子在此极析出,Fe极质量增加,A正确;a极与电源负极相连,作阴极,氢离子在阴极得电子,发生还原反应2H++2e-=H2↑,则a极附近溶液的pH增大,B错误;精炼铜时,粗铜作阳极,与电源正极相连,则d极为粗铜,C错误;装置④为原电池,活泼性:Zn>Fe,则Zn 失电子作负极,电子由Zn流向Fe ,D错误;正确选项A。
8.D
【解析】
能量越低越稳定,H2O、H2S、H2Se、H2Te稳定性减弱,所以b表示Te与H2化合的反应热数据,故AB错误;Se是固体,所以Se与H2化合的热化学反应方程式是Se(s)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1,故C错误、D正确;
9.C
【解析】
【分析】
根据图示,左边为锌-铜-硫酸锌原电池,锌做负极,铜做正极,锌发生吸氧腐蚀;右边为电解池,电极都是铜,电解质为硫酸铜溶液,是电镀池,据此分析解答。
【详解】
A.电路中电子只能通过外电路,不能通过电解质溶液,溶液是通过自由移动的离子导电的,故A错误;B.装置中左边为原电池,锌做负极,铜做正极,右边为电解池,原电池反应是吸氧腐蚀,故B错误;C.右边为电解池,是电镀装置,c电极为阳极,铜逐渐溶解,d电极为阴极,析出铜,c电极质量减少量等于d电极质量增加量,故C正确;D.右边为电解池,是电镀装置,d电极反应:Cu2++2e-=Cu,反应后CuSO4溶液浓度基本不变,故D错误;故选C。
10.C
【解析】
A、电极a通入空气,则电极a为正极,故A说法正确;B、电极a的反应式为:O2+2H2O+4e-=4OH-,负极反应式为:2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O,OH-需要向负极移动,因此选择性透过膜为阴离子透过性膜,故B说法正确;C、根据B选项分析,电极a产生OH-,pH增大,故C说法错误;D、根据电池总反应,负极反应式为2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O,故D说法正确。
点睛:本题的难点是负极反应式的书写,一般写出还原剂和氧化产物,VB2→V2O5+2B2O3,根据化合价的变化写出失去电子物质的量,即2VB2-22e-→V2O5+2B2O3,因为环境是碱性,因此OH-在负极上参与反应,生成H2O,根据电荷守恒,原子守恒,配平其他,即负极反应式为2VB2 +22OH--22e- = V2O5+2B2O3 + 11H2O。
11.A
【解析】
由于X和Y的化学计量数之比使1∶3的,而平衡时X和Y的浓度之比也是1∶3的,所以起始时X和Y的浓度之比就是1∶3的,A正确。平衡时Y和Z的生成速率之比为3∶2,B不正确。X、Y的转化率之比为1:1,C不正确。如果开始向正反应方向进行,则2(c1-0.1)=0.08-c3,解得c1=0.14-c3/2,所以c1的最大值是0.14,所以范围是c1<0.14 mol·L-1,所以D不正确,答案选A。
12.A
【解析】
【详解】
A、该反应为放热反应,温度升高,平衡向逆反应方向移动,B的质量分数增大,故A正确;B、根据反应前后的化学计量数的大小可以看出,增大压强,平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;C、该反应为放热反应,温度升高,平衡向逆反应方向移动,正逆反应速率都增大,且V逆>V正,故C错误;D、该反应为放热反应,温度升高,平衡向逆反应方向移动,A的转化率降低,根据反应前后的化学计量数的大小可以看出,增大压强,平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误;故选A。
【点睛】
本题为化学平衡图像题。本题的易错点为BC,要注意V正、V逆的相对大小与平衡移动方向的关系的判断。
13.B
【解析】
【详解】
A、由图Ⅰ知,反应在T1、T3处反应物和生成物的体积分数相等,但反应不一定达到平衡,故A错误;B、T2-T3升高温度,平衡向着吸热方向进行,反应物体积分数增大,生成物体积分数减小,所以反应正向进行,正反应是放热反应,△H<0,故B正确;C、合成氨的反应属于放热反应,降低温度,反应速率减慢,化学平衡向着放热方向进行,即向正向移动,正反应速率大于逆反应速率,故C错误;D、由图Ⅱ知,t2时刻正逆反应速率都增大且相等,改变的条件是加入催化剂,平衡不移动;t3时刻正逆反应速率都减小,且逆反应速率大于正反应速率,改变的条件是减小压强,平衡向逆反应方向移动;t5时刻正逆反应速率都增大,且逆反应速率大于正反应速率,改变的条件是升高温度,平衡向逆反应方向移动,所以反应在t1时,NH3体积分数最大,故D错误;故选B。
14.A
【解析】
【分析】
本题主要考查化学平衡,化学平衡常数。A. 将固体杂质分离出去,反应温度大于其沸点;B. 化学平衡常数仅与反应温度有关;C. 第二阶段为第一阶段反应的逆过程,由此计算平衡常数;D. Ni为固体,增加Ni的含量,CO的转化率不变。
【详解】
A.由题干可知,Ni(CO)4的沸点为42.2℃,要想将固体杂质分离出去,应使反应温度大于Ni(CO)4的沸点,此时反应生成的Ni(CO)4为气态,便于分离,因此选50℃,故A项正确;B. 化学平衡常数仅与反应温度有关,与反应物的浓度无直接关系,因此增加c(CO),反应的平衡常数应不变,故B项错误;C. 由题干可知,230℃时,第一阶段反应的平衡常数较小,K=2×10-5,而第二阶段为第一阶段反应的逆过程,因此可判断第二阶段的反应较彻底,即第二阶段Ni(CO)4分解率较高,故C项错误;D. Ni为固体,增加Ni的含量,CO的转化率不变。综上,本题选A。
15.B
【解析】
A.根据以上分析,X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,应与电源正极相连,故A错误;B.由图可知LiOH从最右侧导出,则Li+需通过N进入最右侧,故N为阳离子交换膜,故B正确;C.Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,故C错误;D.制备2.4 g LiOH,n(OH-)==0.1mol,阴极电极反应式为2H2O+2e-=2OH-+H2↑,则n(H2)=0.05mol,为0.05mol×22.4L/mol=1.12L,故D错误;故选B。
点睛:明确各个电极上发生的反应、各个区域电解质溶液成分是解本题的关键,该电解池实质是电解水,根据图知,Y极导出的LiOH,则Y极是水电离出的氢离子放电生成氢气,阴极电极反应式为2H2O+2e-=2OH-+H2↑,氢氧根浓度增大,故Y为电解池的阴极;X极导出的是硫酸,则X极应为水电离出的氢氧根放电,则X极为阳极,阳极反应式为2H2O-4e-=4H++O2↑。
16.D
【解析】
试题分析:温度越高速率越快,温度T2>T1,达到平衡时b、d点的反应速率为vd<vb,A错误;若T2>T1,由图象可知温度升高AB3的物质的量增大,说明升高温度平衡向正反应方向移动,则正反应为吸热反应,B错误;由图可知,横坐标为B2的物质的量,增大一种反应物的量会促进另一种反应物的转化率增大,则B2越大达到平衡时A2的转化率越大,即达到平衡时A2的转化率大小为c>b>a,C错误;由图可知,横坐标为B2的物质的量,增大一种反应物的量必然会促进另一种反应物的转化,则B2越大达到平衡时A2的转化率越大,生成物的物质的量越大,则平衡时AB3的物质的量大小为:c>b>a,D正确;选D。
考点:考查化学平衡移动图像。
17.D
【解析】
【详解】
A.根据表格数据①②知,增大压强平衡不移动,升高温度,后②中M的物质的量小于①的2倍,说明平衡逆向移动,则正反应为放热反应,故A正确;B.实验①中,若5min时测得n(M)=0.05mol,则0至5min时间内,v(M)= =0.01 mol/( L•min),化学反应速率与化学计量数成正比,则用N表示的平均反应速率v(N)=v(M)=0.01 mol/( L•min),故B正确;
C. X(g)+Y(g)⇌M(g)+N(g)
反应前(mol)0.2 0.2 0 0
转化 (mol) 0.1 0.1 0.1 0.1
平衡时(mol) 0.1 0.1 0.1 0.1
则实验②中,该反应的平衡常数K= =1.0,故C正确;D.反应X(g)+Y(g)⇌M(g)+N(g)为气体体积不变的反应,压强不影响化学平衡,若实验①②温度相同,实验②平衡时M的物质的量应该为0.18mol>0.10mol,说明升高温度后平衡向着逆向移动,则该反应为放热反应;若实验④③的温度相同,则平衡时实验④中a=0.06,由于实验④温度较高,且该反应为放热反应,则a<0.06mol,故D错误;故选D。
18.D
【解析】
【分析】
A.N中为恒压,M中随反应进行压强减小,反应过程中N中压强大于M中压强,增大压强,平衡向正反应方向移动;B.向N中再充入a mol X和b mol Y后达到平衡时的状态与未充入X、Y前相同,即互为等效平衡,根据A的分析可以知道N中转化率较大;C.反应初始时X的物质的量未知,故转化率未知;D. 反应温度不变,故通入X前后平衡常数不变,将通入X后反应的浓度商与平衡常数比较,即可知道正逆反应速率的大小;
【详解】
A.N中为恒压,M中随反应进行压强减小,反应过程中N中压强大于M中压强,增大压强,平衡向正反应方向移动,故平衡时,X的体积分数:M>N,故A项错误;B.向N中再充入a mol X和b mol Y后达到平衡时的状态与未充入X、Y前相同,即互为等效平衡,根据A的分析可以知道,平衡时X的转化率:M<N,故B项错误;C.反应初始时X的物质的量未知,故转化率未知,故C项错误;D.若a=1.2,b=1,并且N中达到平衡时体积为2 L,此时含有0.4 mol Z,则:
X(g)+3Y(g)⇌2Z(g)
n0 1.2mol 1mol 0mol
Δn 0.2mol 0.6mol 0.4mol
n平 1mol 0.4mol 0.4mol
则平衡常数K=(0.4/2)2/(1/2)×(0.4/2) 3=10L2/mol2,反应温度不变,故通入X前后平衡常数不变,未再通入X前,平衡时气体总物质的量为1.8 mol,通入0.36 mol X后,气体总物质的量为2.16 mol,由体积比与物质的量比成正比可以知道:1.8/2.16=2/V,计算得出通入X后的体积V=2.4 L,浓度商Qc=(0.4/2.4)2/(1.36/2.4)×(0.4/2.4) 3=10.59>K,故反应应向逆反应方向进行,则通入0.36 mol X时,υ(正)<υ(逆),故D项正确。综上,本题选D。
【点睛】
本题的易错项是C、D,C项中a:b=1:3错误的以X、Y起始物质的量依次为1mol、3mol进行计算;D项中忽略向平衡后的N中通入0.36molX的瞬间引起容器体积的变化。
19.时间 溶液颜色 出现浑浊所需要的时间 温度 10.0 10.0 0 浓度 10.0 6.0
【解析】
【分析】
(1)通过实验测定和谐反应速率,需要借助于某种数据的变化来判断,根据锌粒与不同浓度硫酸反应时有气体生成;KMnO4与H2C2O4反应中有颜色的变化;硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,据此分析解答;
(2)实验①、②的温度不同,故可探究温度对反应速率的影响,而要探究温度对反应速率的影响,则必须保持其他影响因素一致;实验①、③加入的硫酸的量不同,故可探究浓度对反应速率的影响,而要探究硫酸的浓度不同对反应速率的影响,则必须保持其他影响因素一致,据此分析解答。
【详解】
(1)化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的时间长短,来比较锌粒与不同浓度硫酸反应时的速率;在KMnO4与H2C2O4反应中,高锰酸钾溶液是有色溶液,可通过观察单位时间内溶液颜色变化来测定该反应的速率;在Na2S2O3+H2SO4==Na2SO4+S↓+SO2↑+H2O反应中,硫代硫酸钠与稀硫酸反应生成了单质硫,溶液变浑浊,可以判断反应速率快慢,反应速率越快,出现浑浊时间越短,故答案为:时间;溶液颜色;出现浑浊需要的时间;
(2)实验①、②的温度不同,故可探究温度对反应速率的影响;而要探究温度对反应速率的影响,则必须保持其他影响因素一致:即加入的Na2S2O3溶液的量相同,故V1=10.0mL,加入的硫酸的量相同,故V2=10.0mL,加入水的体积相等,故V3=0;实验①、③加入的硫酸的量不同,故可探究浓度对反应速率的影响;而要探究硫酸的浓度不同对反应速率的影响,则必须保持其他影响因素一致,即加入的Na2S2O3溶液的量相同,故V4=10.0mL,溶液总体积也须相同,故加入的水的体积V5=6.0mL,故答案为:温度;10.0;10.0;0;浓度;10.0;6.0。
【点睛】
本题考查了测定化学反应速率的方法。本题的易错点为(2),要注意探究某种因素对和谐反应速率的影响时,需要保持其他影响因素相同。
20.N2H4+4OH--4e-===N2+4H2O 2H2O-4e-===O2↑+4H+或4OH--4e-===2H2O+O2↑ 12.8 负 ClO- + 2e- + H2O = Cl-+ 2OH- S- 6e- +3O2- = SO3 硫磺(二氧化硫)循环使用;用稀硫酸吸收SO3(减小生成物浓度,有利于提高S转化率)
【解析】
【分析】
(1)甲池为燃料电池,N2H4失电子生成氮气;乙池为电解池,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应;根据电路中每个电极得失电子守恒计算;
(2)原电池中,负极上失电子发生氧化反应,化合价升高,正极上得电子发生还原反应,化合价降低,据此图示判断正负极,并书写电极反应式;
(3)根据图示,S转化为SO2和SO3,发生氧化反应,结合电解质为固体金属氧化物书写电极反应式;结合平衡移动原理分析提高转化率的方法。
【详解】
(1)甲池为燃料电池,负极上发生氧化反应,电极反应式为N2H4-4e-+4OH-=N2+4H2O;乙池为电解池,石墨电极与正极相连为阳极,氢氧根在阳极失电子发生氧化反应,反应式为4OH--4e-=2H2O+O2↑;甲池中每消耗0.1mol N2H4,则根据负极N2H4-4e-+4OH-=N2+4H2O,转移0.4mol电子,所以乙池电极上则会析出×64g/mol=12.8g铜,故答案为:N2H4-4e-+4OH-=N2+4H2O;4OH--4e-=2H2O+O2;12.8。
(2)①燃料电池中,负极上燃料失电子发生氧化反应,化合价升高,正极上氧化剂得电子发生还原反应,化合价降低,根据图知,Mg元素化合价由0价变为+2价、Cl元素化合价由+1价变为-1价,所以E是负极、F是正极,正极上次氯酸根离子得电子和水反应生成氯离子和氢氧根离子,电极反应式为ClO-+2e-+H2O═Cl-+2OH-,故答案为:负;ClO-+2e-+H2O═Cl-+2OH-;
(3)根据图示,S转化为SO2和SO3,S元素的化合价升高,发生氧化反应,则S为负极,通氧气一端为正极,S(g)在负极生成SO2和SO3的电极反应式为S-4e-+2O2-=SO2、S-6e-+3O2-=SO3;若提高转化率,则平衡正向移动,所以可采取硫磺(二氧化硫)循环使用或用稀硫酸吸收三氧化硫,故答案为:S-6e-+3O2-=SO3;硫磺(二氧化硫)循环使用;用稀硫酸吸收三氧化硫。
21.0.005 mol/(L·min) A 45.5 % 移走0.1 mol NH3 等于
【解析】
【分析】
(1)根据反应速率= 计算;
(2)根据图像知,反应速率加快,且10min时各气体的物质的量是连续的,根据三种气体的变化量判断平衡施肥发生移动,再结合影响平衡的因素分析解答;
(3)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;第2次平衡时,根据NH3的体积分数等于氨气的物质的量分数计算;
(4)25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;根据平衡常数的影响因素分析判断。
【详解】
(1)反应速率v(NH3)= = =0.005mol/(L·min),故答案为:0.005mol/(L·min);
(2)由图像可知,各组分物质的量变化增加,即反应速率加快,且10min时变化是连续的,20min达平衡时,△n(N2)=0.35mol-0.25mol =0.1mol,△n(H2)=0.45mol-0.15mol=0.3mol,△n(NH3)=0.3mol-0.1mol =0.2mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,缩小体积相当于增大压强,应该反应物的速率增加倍数大;降低温度,应该反应速率减小;增加NH3物质的量,逆反应速率增加的倍数大;故只有使用催化剂符合,故选A;
(3)由图像可以看出,当反应进行到时20-25min,各物质的量不变,说明反应达到平衡状态,化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,由图象可知,20min达平衡时,n(N2)=0.025mol×10=0.25mol,n(H2)=0.025mol×6=0.15mol,n(NH3)=0.025mol×12=0.3mol,所以所以其平衡常数K= = =;35min时达到第2次平衡,NH3的体积分数= ×100%=45.5%,故答案为:;45.5%;
(4)第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3;由图像可以看出,当反应进行到时35-40min,各物质的量不变,说明反应达到第二次平衡状态,平衡常数只受温度影响,温度不变,平衡常数不变,所以抽去0.1mol氨,此时平衡常数K将不变,故答案为:分离出0.1molNH3;等于。
22.2a-b < 加入催化剂 增大 乙 2 > (MPa)-2
【解析】
【分析】
(1)根据盖斯定律将①×2-②可得:2NO(g)+Cl2(g)⇌2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的;由图Ⅰ虚线知:化学反应速率加快,但平衡不移动,判断改变的条件;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,根据平衡的移动对物质的量的影响,分析判断平均相对分子质量的变化;根据反应③的平衡常数的对数值(lgK)与温度的变化关系图,由于△H3<0,因此升高温度,平衡逆向移动,结合K的变化分析判断正确的曲线;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x,根据三段式计算出25℃时的平衡常数K,再计算lgK,确定a值;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,根据Qc与K的相对大小,判断反应进行的方向,确定v正与v逆的大小;
(3)依据三段式列式计算平衡时气体物质的量,压强之比等于气体物质的量之比,计算得到各气体的分压,结合平衡常数概念计算。
【详解】
(1)已知:①2NO2(g)+NaCl(s)⇌NaNO3(s)+ClNO(g),②4NO2(g)+2NaCl(s)⇌2NaNO3(s)+2NO(g)+Cl2(g),将①×2-②可得:2NO(g)+Cl2(g)⇌2ClNO(g),该反应△H3=2△H1-△H2=2a-b,则平衡常数K3= ,故答案为:2a-b;;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随着反应的进行,温度逐渐升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变△H<0;根据图Ⅰ虚线知:化学反应速率加快,但平衡不移动,因此改变的条件为加入催化剂;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生上述反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,平衡正向进行,气体物质的量减小,气体质量不变,则混合气体的平均相对分子质量将增大;反应③2NO(g)+Cl2(g)2NOCl(g) ΔH3,由于△H3<0,因此升高温度,平衡逆向移动,K减小,则lgK减小,正确的曲线为乙;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x
2NO(g)+Cl2(g)⇌2NOCl(g)
起始量(mol/L) 0.08 0.04 0
变化量(mol/L) 2x x 2x
平衡量(mol/L)0.08-2x 0.04-x 2x
(0.08-2x+0.04-x+2x):(0.08+0.04)=5:6,解得:x=0.02mol,平衡常数K3= =100,lgK= lg100=2,即a=2;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,此时Qc==1.4<K=100,反应向正反应方向进行,v正>v逆,故答案为:<;加入催化剂; 增大;乙;2;>;
(3)若反应条件为压强8MPa,300℃的反应温度下二氧化碳和氢气按1∶3的比例通入,测得二氧化碳的平衡转化率为50%,结合三段式列式计算,
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.5 1.5 0.5 0.5
平衡量(mol) 0.5 1.5 0.5 0.5
分压=总压×物质的量分数,则P(CO2)=8× = ,P(H2)=8×=4,P(CH3OH)=8×= ,P(H2O)=8×= ,Kp= =(MPa)-2,故答案为:(MPa)-2。
23.1-a 3a 2 3-3a D a/(2-a) B
【解析】
【分析】
(1)根据化学平衡三段式列式计算;
(2)此时投料是(1)的3倍,生成的n(C) 也为(1)的3倍;
(3)恒温、恒压下到达平衡后,C的物质的量为3amol,说明和(2)所达到的平衡是相同的平衡,由此入手,根据等效平衡的规律分析;
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,此时与(1)中的平衡为等效平衡,且是成比例等效。
(5)后者相当于减小压强,可以分析平衡移动的方向;
【详解】
(1)根据化学平衡三段式列式计算
A(g) + B(g) ⇌ C(g)
n0 1mol 1mol 0mol
Δn a mol a mol a mol
n平 (1-a) mol (1-a) mol a mol
A的物质的量为(1-a)mol。故本题正确答案是为1-a;
(2)若开始时放入3molA和3molB,恒温恒压下最后达到的平衡状态与(1)互为等效平衡,所以到达平衡后,根据(1)中的计算,平衡时A、B、C的物质的量依次为3(1-a)mol、3(1-a)mol、3amol。故本题正确答案是:3a;
(3)恒温、恒压下到达平衡后,C的物质的量为3amol,说明和(2)所达到的平衡是完全等同的等效平衡,根据等效平衡规律,“极限法一边倒”满足A、B起始量分为3mol、3mol,则xmol+1mol=3mol,解得x=2,y=3(1-a);平衡时n(B)=3(1-a)mol,因为0
(4)再加3molC折算成A和B,相当于3molA和3molB,因为是恒温恒压过程,此时与(1)中的平衡为等效平衡,且是成比例等效,
A(g) + B(g) ⇌ C(g)
起始量1 1 mol 1mol 0mol
平衡量1 (1-a) mol (1-a) mol amol
起始量2 6mol 6 mol 0mol
平衡量2 (6-6a) mol (6-6a) mol 6a mol
C的物质的量分数为6a /(6-6a +6-6a +6a) ×100%= a/(2-a)。因此,本题正确答案是: a/(2-a)
(5)恒温、恒压下,放入1molA和1molB,A(g)+B(g)⇌C(g)达到平衡后,生成amolC。恒温、恒容下,放入1molA和1molB,达到平衡后,生成b molC。后者相当于减压,平衡向逆向移动,故a>b,选B。
相关资料
更多








