
2020版高考一轮复习化学新课改省份专用学案:第七章第2课时 点点突破——水的电离与溶液的酸碱性
展开第2课时 点点突破——水的电离与溶液的酸碱性
知识点一 水的电离
1.水的电离
(1)水是极弱的电解质,其电离方程式为H2O+H2OH3O++OH-,可简写为H2OH++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7 mol·L-1;任何水溶液中,由水电离出的c(H+)与c(OH-)都相等。
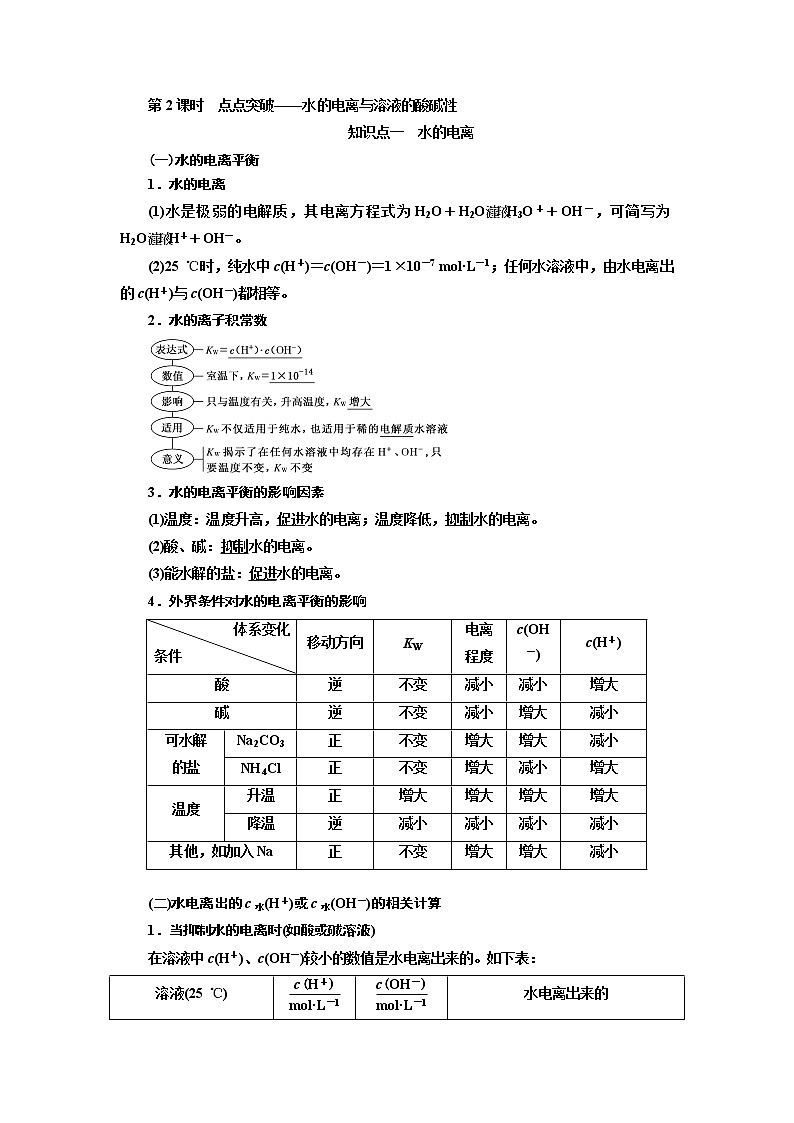
2.水的离子积常数
3.水的电离平衡的影响因素
(1)温度:温度升高,促进水的电离;温度降低,抑制水的电离。
(2)酸、碱:抑制水的电离。
(3)能水解的盐:促进水的电离。
4.外界条件对水的电离平衡的影响
体系变化 条件 | 移动方向 | KW | 电离程度 | c(OH-) | c(H+) | |
酸 | 逆 | 不变 | 减小 | 减小 | 增大 | |
碱 | 逆 | 不变 | 减小 | 增大 | 减小 | |
可水解 的盐 | Na2CO3 | 正 | 不变 | 增大 | 增大 | 减小 |
NH4Cl | 正 | 不变 | 增大 | 减小 | 增大 | |
温度 | 升温 | 正 | 增大 | 增大 | 增大 | 增大 |
降温 | 逆 | 减小 | 减小 | 减小 | 减小 | |
其他,如加入Na | 正 | 不变 | 增大 | 增大 | 减小 | |
(二)水电离出的c水(H+)或c水(OH-)的相关计算
1.当抑制水的电离时(如酸或碱溶液)
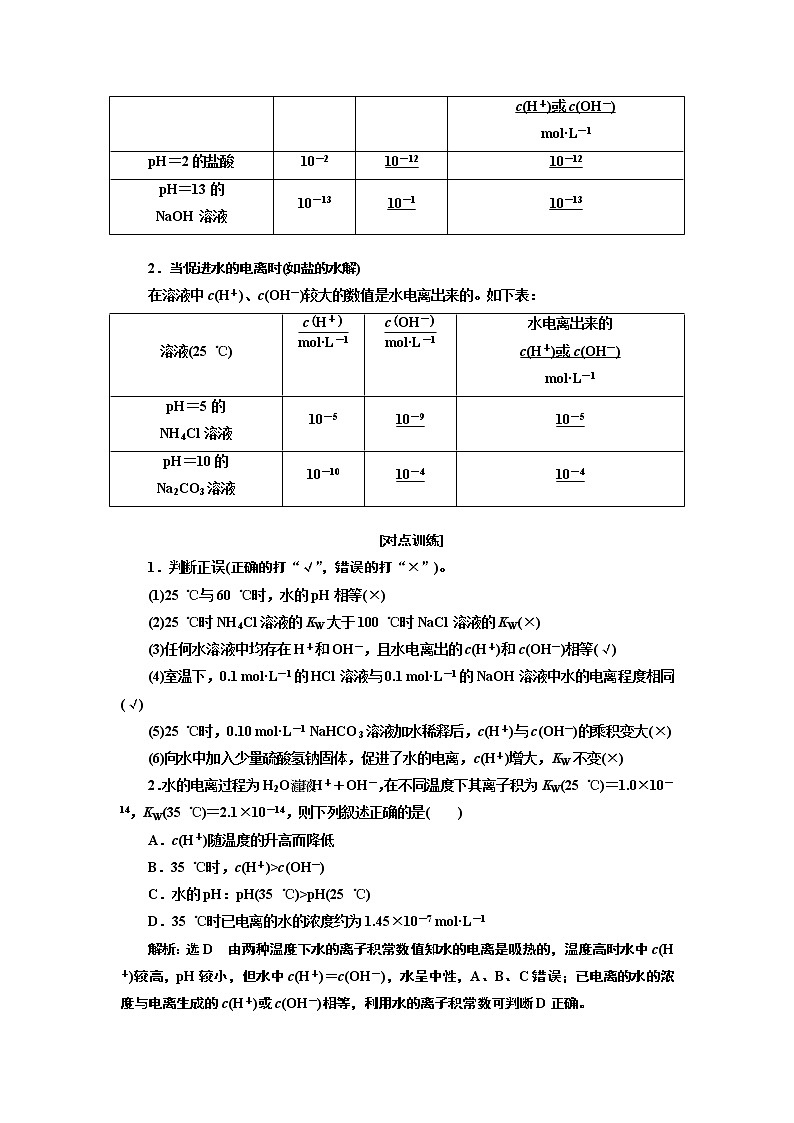
在溶液中c(H+)、c(OH-)较小的数值是水电离出来的。如下表:
溶液(25 ℃) | 水电离出来的 c(H+)或c(OH-) mol·L-1 | ||
pH=2的盐酸 | 10-2 | 10-12 | 10-12 |
pH=13的 NaOH溶液 | 10-13 | 10-1 | 10-13 |
2.当促进水的电离时(如盐的水解)
在溶液中c(H+)、c(OH-)较大的数值是水电离出来的。如下表:
溶液(25 ℃) | 水电离出来的 c(H+)或c(OH-) mol·L-1 | ||
pH=5的 NH4Cl溶液 | 10-5 | 10-9 | 10-5 |
pH=10的 Na2CO3溶液 | 10-10 | 10-4 | 10-4 |
[对点训练]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)25 ℃与60 ℃时,水的pH相等(×)
(2)25 ℃时NH4Cl溶液的KW大于100 ℃时NaCl溶液的KW(×)
(3)任何水溶液中均存在H+和OH-,且水电离出的c(H+)和c(OH-)相等(√)
(4)室温下,0.1 mol·L-1的HCl溶液与0.1 mol·L-1的NaOH溶液中水的电离程度相同(√)
(5)25 ℃时,0.10 mol·L-1 NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积变大(×)
(6)向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,KW不变(×)
2.水的电离过程为H2OH++OH-,在不同温度下其离子积为KW(25 ℃)=1.0×10-14,KW(35 ℃)=2.1×10-14,则下列叙述正确的是( )
A.c(H+)随温度的升高而降低
B.35 ℃时,c(H+)>c(OH-)
C.水的pH:pH(35 ℃)>pH(25 ℃)
D.35 ℃时已电离的水的浓度约为1.45×10-7 mol·L-1
解析:选D 由两种温度下水的离子积常数值知水的电离是吸热的,温度高时水中c(H+)较高,pH较小,但水中c(H+)=c(OH-),水呈中性,A、B、C错误;已电离的水的浓度与电离生成的c(H+)或c(OH-)相等,利用水的离子积常数可判断D正确。
3.25 ℃时,0.1 mol·L-1的下列溶液:①NaCl ②NaOH ③H2SO4 ④(NH4)2SO4,其中水的电离程度按由大到小顺序排列的一组是( )
A.④>③>②>① B.②>③>①>④
C.④>①>②>③ D.③>②>①>④
解析:选C ②③分别为碱、酸,抑制水的电离;④中NH水解促进水的电离,①NaCl不影响水的电离。
4.室温下,pH=11的某溶液中水电离出的c(OH-)为( )
①1.0×10-7 mol·L-1 ②1.0×10-6 mol·L-1
③1.0×10-3 mol·L-1 ④1.0×10-11 mol·L-1
A.③ B.④
C.①或③ D.③或④
解析:选D 该溶液中c(OH-)=10-3 mol·L-1,c(H+)=10-11 mol·L-1,若是碱溶液,则H+是由H2O电离出的,水电离出的OH-与H+浓度均为10-11 mol·L-1;若是盐溶液(如Na2CO3),则OH-是由H2O电离出的,即水电离出的c(OH-)=10-3 mol·L-1。
知识点二 溶液的酸碱性和pH
1.溶液的酸碱性的判断
(1)判断标准
溶液的酸碱性取决于溶液中c(H+)和c(OH-)的相对大小。
c(H+)c(OH-) | 溶液呈酸性,常温下pH7 |
c(H+)c(OH-) | 溶液呈中性,常温下pH7 |
c(H+)c(OH-) | 溶液呈碱性,常温下pH7 |
(2)注意事项
①溶液中c(H+)越大,c(OH-)越小,溶液的酸性越强,碱性越弱;溶液中c(H+)越小,c(OH-)越大,溶液的碱性越强,酸性越弱。
②pH=7或c(H+)=10-7 mol·L-1的溶液不一定呈中性,因水的电离与温度有关,常温时,pH=7的溶液呈中性,100 ℃ 时pH=6的溶液呈中性。
2.pH及其测量
(1)定义式:pH=-lg c(H+)。
(2)溶液的酸碱性与pH的关系(常温下)
(3)测量方法
①pH试纸法:把小片试纸放在一洁净的玻璃片或表面皿上,用玻璃棒蘸取待测溶液点在干燥的pH试纸的中央,试纸变色后,与标准比色卡对照即可确定溶液的pH。
②pH计测量法。
1.计算类型
(1)单一溶液的pH计算
强酸溶液:如HnA,设浓度为c mol·L-1,c(H+)=nc mol·L-1,pH=-lg c(H+)=-lg (nc)。
强碱溶液(25 ℃):如B(OH)n,设浓度为c mol·L-1,c(H+)= mol·L-1,pH=-lg c(H+)=14+lg (nc)。
(2)混合溶液的pH计算
①两种强酸混合:直接求出c混(H+),再据此求pH。
c混(H+)=。
②两种强碱混合:先求出c混(OH-),再据KW求出c混(H+),最后求pH。
c混(OH-)=。
③强酸、强碱混合:先判断哪种物质过量,再由下式求出溶液中H+或OH-的浓度,最后求pH。
c混(H+)或c混(OH-)=。
(3)酸、碱溶液稀释时pH的变化(25 ℃)
| 酸(pH=a) | 碱(pH=b) | ||
弱酸 | 强酸 | 弱碱 | 强碱 | |
稀释10n倍 | <a+n | a+n | >b-n | b-n |
无限稀释 | pH趋向于7 | |||
2.计算溶液pH的解题思路
[对点训练]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)某溶液的pH=7,该溶液一定显中性(×)
(2)某溶液的c(H+)>10-7 mol·L-1,则该溶液呈酸性(×)
(3)用湿润的pH试纸测稀碱液的pH,测定值偏小(√)
(4)用广泛pH试纸测得0.10 mol·L-1NH4Cl溶液的pH=5.2(×)
(5)用pH试纸测定氯水的pH为3(×)
(6)一定温度下,pH=a的氨水,稀释10倍后,其pH=b,则a=b+1(×)
2.(2018·浙江4月选考)下列物质溶于水后溶液显酸性的是( )
A.KCl B.Na2O
C.NH4Cl D.CH3COONa
解析:选C KCl为强酸强碱盐,溶于水溶液显中性,A项不符合题意;Na2O溶于水生成NaOH,使溶液显碱性,B项不符合题意;NH4Cl为强酸弱碱盐,溶于水因NH水解:NH+H2ONH3·H2O+H+而显酸性,C项符合题意;CH3COONa为强碱弱酸盐,溶于水因CH3COO-水解:CH3COO-+H2OCH3COOH+OH-而显碱性,D项不符合题意。
3.(2018·浙江11月选考)下列说法不正确的是( )
A.测得0.1 mol·L-1的一元酸HA溶液pH=3.0,则HA一定为弱电解质
B.25 ℃时,将0.1 mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0
C.25 ℃时,将0.1 mol·L-1的HA溶液加水稀释至pH=4.0,所得溶液c(OH-)=1×10-10 mol·L-1
D.0.1 mol·L-1的HA溶液与0.1 mol·L-1的NaOH溶液等体积混合,所得溶液pH一定等于7.0
解析:选D A选项,0.1 mol·L-1一元酸HA溶液pH=3.0,说明HA部分电离,为弱电解质,正确;B选项,0.1 mol·L-1NaOH溶液pH=13.0,加水稀释100倍,pH=11.0,正确;C选项,25 ℃时,pH=4.0,c(H+)=1×10-4 mol·L-1,c(OH-)=1×10-10 mol·L-1,正确;D选项,若HA为弱酸,与NaOH溶液恰好反应生成NaA,为强碱弱酸盐,常温下溶液呈碱性,错误。
4.计算常温时下列溶液的pH(忽略溶液混合时体积的变化):
(1)pH=2的盐酸与等体积的水混合;____________
(2)pH=2的盐酸加水稀释到1 000倍;____________
(3)0.1 mol·L-1的CH3COOH溶液(已知CH3COOH的电离常数K=1.8×10-5);____________
(4)0.1 mol·L-1 NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度=×100%);____________
(5)常温下,将0.1 mol·L-1氢氧化钠溶液与0.06 mol·L-1硫酸溶液等体积混合。____________
解析:(1)c(H+)= mol·L-1,pH=-lg=2+lg 2=2.3。
(2)c(H+)= mol·L-1=10-5 mol·L-1,pH=5。
(3) CH3COOHCH3COO- + H+
c(初始)/mol·L-1 0.1 0 0
c(电离)/mol·L-1 c(H+) c(H+) c(H+)
c(平衡)/mol·L-1 0.1-c(H+) c(H+) c(H+)
则K==1.8×10-5,
解得c(H+)=1.3×10-3 mol·L-1,
所以pH=-lg c(H+)=-lg (1.3×10-3)=2.9。
(4) NH3·H2OOH- + NH
c(初始)/mol·L-1 0.1 0 0
c(电离)/mol·L-1 0.1×1% 0.1×1% 0.1×1%
则c(OH-)=0.1×1% mol·L-1=10-3 mol·L-1,
c(H+)=10-11 mol·L-1,所以pH=11。
(5)c(H+)=
=0.01 mol·L-1,所以pH=2。
答案: (1)2.3 (2)5 (3)2.9 (4)11 (5)2








