苏教版必修一第三单元 含硅矿物与信息材料教学设计
展开专题三 从矿物质到基础材料
第三单元 含硅矿物与信息材料
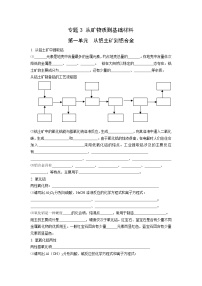
一、硅
1. 硅的存在、结构、物理性质
硅在地壳中含量仅次于___,居第___位;无 硅,化合态主要存在形式是__________和___________;硅是 色有金属光泽,硬度 ,熔沸点 的固体。导电性介于导体和绝缘体之间,是良好的 材料。硅有 硅和 硅两种同素异形体。硅晶体的结构类似 ,是 的空间网状结构。
2. 硅的化学性质
(1)常温下化学性质较稳定,只与 、 和 反应。
方程式: , ,
;
(2)加热或高温可与氧气、氯气、碳等非金属反应:
方程式: , ,
;
(3)工业生产、提纯硅:生产(方程式): (粗硅)。
提纯(方程式): , (纯硅)。
3. 硅的应用
硅晶体是一种 材料,广泛用于 工业。(1)用于制造硅芯片、集成电路、晶体管、硅整流器等半导体器件;(2)制造太阳能电池;(3)制造合金,如含硅4%(质量分数)的钢导磁性好制造变压器的铁芯和含硅15%(质量分数)的钢有良好的耐酸性等。
二、二氧化硅
1. 天然二氧化硅也叫 ,较纯的二氧化硅称 ,常见的以是二氧化硅为主要成分的有: 、 、 、 等。天然的二氧化硅分为
和 两大类。SiO2是 的空间网状结构
2. 纯SiO2是 色透明的晶体,硬度 ,熔点 , 溶于水。
3. 二氧化硅的化学性质
(1)属于 氧化物,具有酸性氧化物的某些通性:
①能与碱反应生成盐和水:
凡是盛强碱以及其它碱性物质的玻璃试剂瓶均不能用 塞,而应用 塞
②能与碱性氧化物反应生成盐 :
③能与碳酸盐反应(不挥发性的氧化物代替挥发性的氧化物)
,
④二氧化硅 与水反应生成硅酸。
(2)与氢氟酸的反应 :
(3)与焦炭反应: ,
4. 二氧化硅的用途:制___________,_____________,___________等
5. SiC(金刚砂)结构类似于 ,是 的空间网状结构。
用途
三、硅酸
(1)硅酸( )是一种酸性很弱的酸(比 还弱),在水中溶解度 。原硅酸化学式为 。
(2)硅酸不稳定,受热易分解,方程式为 。 (3)由SiO2制硅酸: , (方程式)
(4)硅胶的用途:
四、硅酸盐:
1. 硅酸盐的结构复杂可用氧化物的形式表示,将硅酸盐改写成氧化物的形式的方法及顺序: 。如:Na2SiO3 (硅酸钠): ,
MgSiO3 (镁橄榄石): ,ZrSiO4 (锆石): ,
Al2SiO5 (红柱石): , KAl2Si3O9(OH):
Ca3Al2Si3O12 (钙铝石榴子石) 。
2. 硅酸钠的性质:硅酸钠是极少数 的硅酸盐中的一种,硅酸钠的水溶液俗称 ,建筑行业用作 ,用其浸泡的木材,纺织品既耐 又不易 。能与酸反应:通CO2(碳酸)或者加入盐酸有白色沉淀:(方程式)
( 酸性比H2CO3 ),
3.分子筛:利用 内部结构的空隙,可用于 、 气体或液体混合物;还可以作 、 、 、催化剂载体、净化水、净化空气、防毒器械、食品保鲜、电子产品处理、石油化工等方面。
五、硅酸盐工业:
、 、 是三大重要的硅酸盐产品
(1)水泥
①原料: (主要成分是 )、
②主要设备:
③生产条件:
④加入石膏的目的:
(2)玻璃
①原料: 、 、
②主要设备:
③生产条件:
④反应原理 、
、
⑤主要成分:
高中苏教版第三单元 人类对原子结构的认识教案: 这是一份高中苏教版第三单元 人类对原子结构的认识教案,共3页。
高中化学苏教版必修一第一单元 氯、溴、碘及其化合物教案及反思: 这是一份高中化学苏教版必修一第一单元 氯、溴、碘及其化合物教案及反思,共3页。
高中苏教版第二单元 钠、镁及其化合物教学设计: 这是一份高中苏教版第二单元 钠、镁及其化合物教学设计,共3页。