






化学选择性必修1第一章 化学反应的热效应第一节 反应热一等奖ppt课件
展开第1课时 反应热 焓变
1.从化学键变化的角度分析,化学反应的本质是反应物中化学键的 和生成物中化学键的 。 2.一个确定的化学反应是吸热反应还是放热反应,决定于反应物的总能量与生成物的总能量的 。
一、反应热及其测定1.反应热在 条件下,化学反应体系向环境释放或从环境吸收的 ,称为化学反应的 ,简称反应热。 2.反应热测定(1)仪器: 。 (2)原理:根据体系的 和有关物质的 来计算反应热。
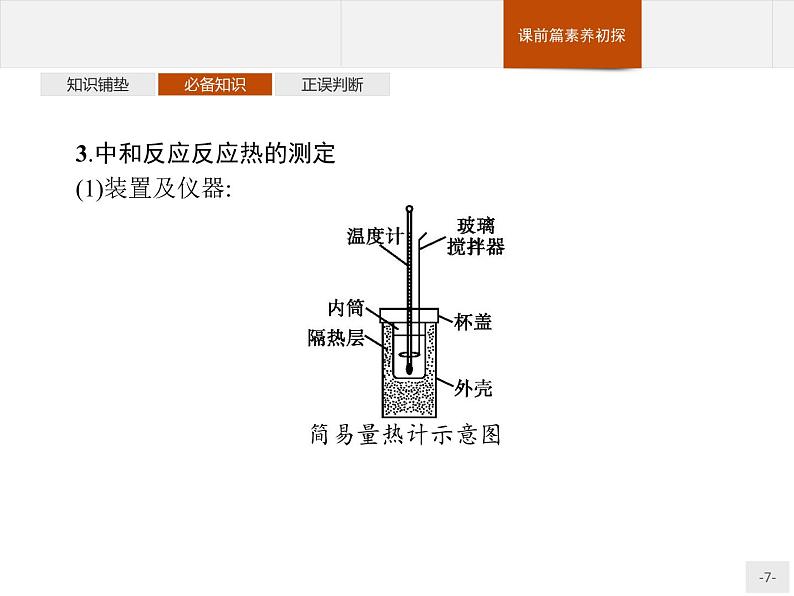
3.中和反应反应热的测定(1)装置及仪器:
(3)注意事项:①为了保证酸完全中和,常采用 稍过量的方法。 ②密切关注温度变化,记录 温度作为反应后体系的温度。 4.25 ℃和101 kPa下,强酸的稀溶液与强碱稀溶液发生中和反应生成1 ml H2O时,放出 的热量。 【微思考】25 ℃和101 kPa下,浓硫酸与强碱稀溶液发生中和反应生成1 ml H2O时,放出的热量还是57.3 kJ吗?
提示:不是。放出的热量大于57.3 kJ,因浓硫酸稀释过程中吸水放热。
二、反应热与焓变1.化学反应产生反应热的原因:化学反应前后体系的 发生了变化。内能受 、 和物质的 等影响。 2.反应热: 条件下进行的化学反应,其反应热等于反应的焓变。符号为 ,单位是 (或 )。 3.ΔH的正、负规定(1)放热反应:其焓 ,ΔH为 ,即ΔH 0。 (2)吸热反应:其焓 ,ΔH为 ,即ΔH 0。
4.从微观角度认识反应热的实质(1)实例反应H2(g)+Cl2(g)=2HCl(g)的能量变化如图所示:
由图可知,1 ml H2分子中的化学键断裂吸收的能量是 ,1 ml Cl2分子中的化学键断裂吸收的能量是 ,2 ml HCl分子中的化学键形成时释放的能量是 ,则反应H2(g)+Cl2(g)=2HCl(g)放出的能量为 。 (2)结论: 时的能量变化是化学反应中能量变化的主要原因。
(1)化学变化过程是原子的重新组合过程。 ( )(2)化学反应可分为吸热反应和放热反应。 ( )(3)化学反应中的能量变化都是以热能形式表现出来的。 ( )(4)吸热反应过程是化学能转变为热能的过程。 ( )(5)生成物总能量高于反应物总能量的反应是吸热反应。 ( )(6)测定中和反应反应热的实验中,应将稀碱溶液逐渐滴加到稀酸溶液中。 ( )
答案:(1)√ (2)√ (3)× (4)× (5)√ (6)×
反应热与焓变问题探究1.化学反应一定伴随能量的变化吗?为什么?
2.若反应物的总能量高于生成物的总能量,该反应是放热反应还是吸热反应?
答案:一定。化学反应的本质是化学键的断裂和形成,旧键断裂要吸收能量,新键形成要放出能量。一个化学反应中断裂化学键吸收的能量和生成化学键放出的能量不相等,因此化学反应都伴有能量变化。
深化拓展1.反应热与焓变的关系
2.焓变与物质化学键断裂与形成的关系ΔH=反应物总键能-生成物总键能。3.焓变与反应物、生成物能量的关系ΔH=生成物的总能量-反应物的总能量。
素能应用 典例1已知断裂1 ml H—H需吸收的能量为436 kJ,形成1 ml N—H放出的能量为391 kJ,根据化学方程式N2+3H2
2NH3,1 ml N2完全反应放出92.4 kJ能量。则断裂1 ml N≡N所需吸收的能量为( )A.431 kJB.945.6 kJC.649 kJD.896 kJ
答案:B 解析:根据ΔH=E总(断键)-E总(成键),设断裂1 ml N≡N所需吸收的能量为E,则有E+3×436 kJ-6×391 kJ=-92.4 kJ,E=945.6 kJ。
根据化学键断裂和形成时的能量变化计算反应热化学键的断裂要吸收能量,形成新化学键要释放能量,若反应物断键所吸收的总能量大于生成物成键所释放的总能量,则为吸热反应,反之,则为放热反应。即E总(断键)>E总(成键),为吸热反应;E总(断键)
(1)1 ml H2在2 ml Cl2中燃烧,放出的热量为 kJ。 (2)在一定条件下,1 ml H2分别与足量的Cl2、Br2、I2反应,放出热量由多到少的顺序是 (填字母)。 A.Cl2>Br2>I2B.I2>Br2>Cl2
答案:(1)183 (2)A解析:(1)1 ml H2在2 ml Cl2中燃烧,参加反应的H2和Cl2的物质的量都是1 ml,生成2 ml HCl,则放出的热量为431 kJ·ml-1×2 ml-436 kJ·ml-1×1 ml+243 kJ·ml-1×1 ml=183 kJ。(2)反应H2+X2=2HX中,若1 ml H2和1 ml X2反应生成2 ml HX,就有1 ml H—H和1 ml X—X断裂,有2 ml H—X形成。放出的热量Q(HX)=2E(H—X)-E(H—H)-E(X—X),将题中数据代入计算可得:Q(HCl)>Q(HBr)>Q(HI)。故A正确。
吸热反应与放热反应的比较问题探究1.氨气液化会放出热量,是放热反应吗?
2.需要加热的反应一定是吸热反应吗?不需要加热的反应一定是放热反应吗?
答案:不是。因为氨气液化是物理变化。
深化拓展1.放热反应与吸热反应的比较(1)形成原因。放热反应:反应物具有的总能量大于生成物具有的总能量;吸热反应:反应物具有的总能量小于生成物具有的总能量。(2)与化学键强弱的关系。放热反应:生成物成键时释放出的总能量大于反应物断键时吸收的总能量。吸热反应:生成物成键时释放出的总能量小于反应物断键时吸收的总能量。
(3)图示。放热反应:
2.常见的放热反应和吸热反应(1)常见的放热反应有:①活泼金属与H2O或酸的反应,如
(2)常见的吸热反应有:
素能应用典例2下列说法中正确的是( )①放热反应在常温下一定很容易发生 ②反应是吸热还是放热可以看反应物和生成物所具有的总能量的相对大小 ③某些吸热反应在一定条件下也能发生A.①②③B.只有②③C.只有①②D.只有①③
答案:B 解析:反应是吸热还是放热主要取决于反应物和生成物所具有的总能量的相对大小。某些放热反应和某些吸热反应在不加热条件下也能发生。反应开始需加热的反应可能是吸热反应,也可能是放热反应,例如C+O2 CO2的反应为放热反应,但反应开始也需要加热,即需要向反应体系先提供一定的能量。
(1)需要加热才能进行的反应不一定都是吸热反应,如木炭的燃烧。(2)常温下就能进行的反应不一定都是放热反应,如氢氧化钡晶体和氯化铵固体的反应。(3)任何化学反应都伴随着能量变化,但能量变化不一定都表现为热量变化,还可能以声、光、电等形式表现出来。(4)放出热量(或吸收热量)的物质变化过程不一定是放热反应(或吸热反应),如水蒸气冷凝为液态水放热,干冰升华吸热,它们不是放热反应或吸热反应,而是物理变化过程。
变式训练2下列说法正确的是( )A.物质发生化学反应都伴随着能量变化B.伴有能量变化的物质变化都是化学变化C.凡是经过加热而发生的反应都是吸热反应D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
中和反应反应热的测定问题探究1.用含0.5 ml H2SO4的浓硫酸和含1 ml HCl的稀盐酸分别与含1 ml NaOH的稀溶液发生反应,所测得的反应热相等吗?
2.测定中和反应反应热的实验中引起误差的因素有哪些?
3.测定中和反应反应热的实验中为什么碱要稍过量?
答案:不相等;因为浓硫酸稀释时会放热。
答案:量热计的隔热效果差;量取溶液的体积不准确;配制的溶液浓度不准确;温度未到达最高点就读数;实验操作动作较慢等。
答案:碱过量是为了保证酸完全反应。
深化拓展测定中和反应反应热的实验中需要注意的问题(1)所用装置要尽可能做到保温、隔热;实验操作时动作要快,尽量减少热量的损失。(2)所用溶液的配制必须准确,且浓度要小;为保证盐酸完全被氢氧化钠中和,要使氢氧化钠稍过量。(3)实验中所用的盐酸和氢氧化钠溶液配好后要充分冷却至室温,才能使用。(4)要使用同一支温度计,温度计读数要尽可能准确;水银球部位一定要完全浸没在溶液中,且要稳定一段时间后再读数,以提高测量的精度;两次读数的时间间隔要短,这样才能读到最高温度,即最终温度。(5)实验中若用弱酸代替强酸,或用弱碱代替强碱,因中和过程中弱酸或弱碱的电离吸热,会使测得的反应热数值的绝对值偏小。(6)可采用多次测量取平均值的方法,减小实验误差。
素能应用典例350 mL 0.50 ml·L-1盐酸与50 mL 0.55 ml·L-1 NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热(101 kPa下,强酸稀溶液与强碱稀溶液反应生成1 ml H2O时放出的热量叫中和热)。回答下列问题:
(1)烧杯间填满碎泡沫塑料的作用是 。 (2)大烧杯上如不盖硬纸板,求得中和热的绝对值 (填“偏大”“偏小”或“无影响”)。 (3)实验中改用60 mL 0.50 ml·L-1盐酸与50 mL 0.55 ml·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由: 。
答案:(1)减少实验过程中的热量损失 (2)偏小(3)不相等 相等 因为中和热是指在稀溶液中强酸与强碱发生中和反应生成1 ml H2O时的反应热,与酸和碱的用量无关解析:(1)碎泡沫塑料的作用是减少实验过程中的热量损失。(2)不盖硬纸板会损失部分热量,故所测结果偏小。(3)由中和热的定义可知,中和热是以生成1 ml水为标准的,与酸和碱的用量无关。
变式训练3在做中和反应反应热的测定实验时,关键是要比较准确地配制一定物质的量浓度的溶液,量热计要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:(1)该实验常用0.50 ml·L-1盐酸和0.55 ml·L-1的NaOH溶液各50 mL。NaOH溶液的浓度大于盐酸的浓度的目的是 。当室温低于10 ℃时进行,对实验结果会造成较大误差的原因是 。 (2)若上述盐酸、NaOH溶液的密度都近似为1 g·cm-3,中和后生成的溶液的比热容c=4.18 J·g-1·℃-1,实验前后的温度差为(t2-t1) ℃。则该中和反应放出热量为 kJ(填表达式)。
答案:(1)保证盐酸完全被中和 散热太快(2)0.418(t2-t1)
1.下列说法中正确的是( )A.反应热就是反应放出的热量B.当反应放热时ΔH>0,反应吸热时ΔH<0C.一个化学反应中,当反应物的总能量大于生成物的总能量时,反应放热,ΔH符号为“-”D.反应过程中,旧键断裂吸收的总能量小于新键生成时放出的总能量,反应吸热,ΔH符号为“+”
2.关于化学反应与能量的说法正确的是( )A.中和反应是吸热反应B.燃烧属于放热反应C.化学键断裂放出能量D.反应物总能量与生成物总能量一定相等
A.2 ml H2O所具有的总能量大于2 ml H2和1 ml O2所具有的总能量,反应开始时不需要加热B.2 ml H2和1 ml O2所具有的总能量大于2 ml H2O所具有的总能量,反应开始时需要加热C.2 ml H2和1 ml O2所具有的总能量等于2 ml H2O所具有的总能量,反应开始时不需要加热D.反应物H2和O2所具有的总能量与产物H2O所具有的总能量之间没有任何关系
4.(双选)测定中和反应反应热的实验中,下列操作一定会降低实验准确性的是( )A.用滴定管取所用药品B.将盐酸倒入量热计内筒时,有少量溅出C.量热计内缺少隔热层D.测量HCl溶液的温度计用水洗净后再用来测NaOH溶液的温度
高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热课前预习课件ppt,共35页。PPT课件主要包含了学习目标,课前导入,知识点一,反应热及其测定,体系与环境之间,1定义,2分类,敞开体系系统,封闭体系系统,孤立体系系统等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 反应热公开课课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 反应热公开课课件ppt,共34页。PPT课件主要包含了火箭推进剂,液氢-液氧,煤油-液氧,放热反应,吸热反应,反应热及其测定,学习任务一,中和反应热的测定,-kJ·mol-1,反应热焓变等内容,欢迎下载使用。
2020-2021学年第一章 化学反应的热效应第一节 反应热课文课件ppt: 这是一份2020-2021学年第一章 化学反应的热效应第一节 反应热课文课件ppt,共30页。PPT课件主要包含了课程目标,反应热,反应热及其测定,基础•初探,☂名师点拨,课堂•练习等内容,欢迎下载使用。













