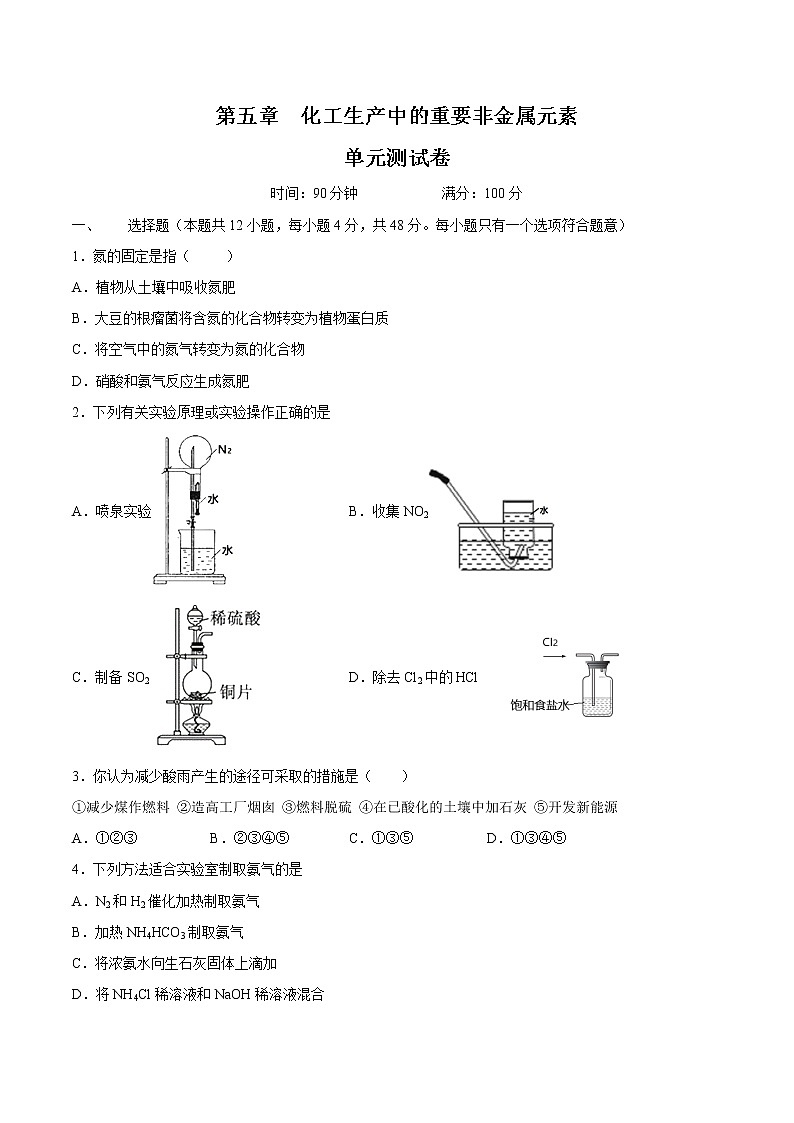




人教版 (2019)必修 第二册第五章 化工生产中的重要非金属元素精品测试题
展开单元测试卷
时间:90分钟 满分:100分
选择题(本题共12小题,每小题4分,共48分。每小题只有一个选项符合题意)
1.氮的固定是指( )
A.植物从土壤中吸收氮肥
B.大豆的根瘤菌将含氮的化合物转变为植物蛋白质
C.将空气中的氮气转变为氮的化合物
D.硝酸和氨气反应生成氮肥
2.下列有关实验原理或实验操作正确的是
A.喷泉实验B.收集NO2
C.制备SO2 D.除去Cl2中的HCl
3.你认为减少酸雨产生的途径可采取的措施是( )
①减少煤作燃料 ②造高工厂烟囱 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③B.②③④⑤C.①③⑤D.①③④⑤
4.下列方法适合实验室制取氨气的是
A.N2和H2催化加热制取氨气
B.加热NH4HCO3制取氨气
C.将浓氨水向生石灰固体上滴加
D.将NH4Cl稀溶液和NaOH稀溶液混合
5.用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①②B.③④C.①③D.②④
6.下列关于化学与生产、生活的认识错误的是
A.CO2、SO2、N2等均是造成温室效应的气体
B.节能减排符合低碳经济的要求
C.使用清洁能源是防止酸雨发生的重要措施之一
D.大量焚烧田间秸秆会污染空气
7.下列离子的检验方法中,正确的是
A.先用盐酸酸化,再加AgNO3溶液产生白色沉淀,则原溶液中存在Cl-离子
B.先加过氧化氢溶液,再加硫氰化钾溶液,产生血红色,则原溶液中存在Fe2+离子
C.加入足量的盐酸溶液,产生无色无味的气体,且能使澄清石灰水变浑浊,则原溶液中存在CO32-离子
D.加入过量盐酸酸化,无沉淀产生,再加入BaCl2溶液,产生白色沉淀,则说明原溶液中存在SO42-离子
8.氨水显弱碱性的主要原因是( )
A.通常状况下,氨的溶解度不大
B.氨水中的一水合氨少量电离
C.溶于水的氨分子只有少量发生电离
D.氨本身的碱性弱
9.下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
A.AB.BC.CD.D
10.下列物质都具有漂白性,漂白原理与其它几种不同的是( )
A.氯水B.SO2C.H2O2D.HClO
11.下图是进行气体性质实验的常用装置,液体一定不能充满试管的是
A.若a为水,b是HClB.若a为水,b是NO2
C.若a为水(滴有酚酞),b是NH3D.若a为NaOH溶液,b是Cl2
12.如图是某硫酸试剂瓶标签上的部分文字。据此,下列说法正确的是( )
A.该硫酸的物质的量浓度为9.2 ml/L
B.1 ml Zn与足量的该硫酸反应生成2 g氢气
C.该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2 ml/L
D.向50 mL该硫酸溶液中加入足量的铜片,加热充分反应后,被还原的硫酸的物质的量小于0.46 ml
二、非选择题
13.(12分)我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有________(写化学式)。
(2)图中物质溶于水溶液呈碱性的是________。
(3)写出SO2转化为SO3的化学方程式________________________。
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为________________。
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________(用化学方程式表示)。
(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为________________。
14.(13分)某课外活动小组在实验室用如下图所示的装置进行实验,验证氨的某些性质并收集少量纯净的N2。
请回答:
(1)实验前先将仪器按图示连接好,然后检查装置的气密性。怎样检查该装置的气密性?________________。
(2)烧瓶内装有生石灰,随浓氨水的滴入,产生氨气。氨气产生的原因是________________。
(3)实验进行一段时间后,观察到加热的硬质玻璃管内的黑色氧化铜粉末变为红色,盛无水CuSO4的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的N2。根据这些现象,写出硬质玻璃管内发生反应的化学方程式:______________________。这个反应说明氨气具有________。
A.碱性 B.还原性 C.氧化性 D.不稳定性
(4)洗气瓶中浓硫酸的主要作用是________________________。
(5)在最后出气管的导管口收集干燥、纯净的氮气,收集方法是___________________。
15.(14分)某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为__(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=___ml·L-1。
(2)煤燃烧排放的烟气中含有SO2和NOx,易形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
(____)ClO2-+(____)NO+(____)OH-=(____)Cl-+(____)NO3-+______
(3)为减少SO2对环境的污染,常将煤炭转化为清洁的气体燃料,并将烟气进行处理,吸收其中的SO2。
①写出焦炭与水蒸气反应的化学方程式:__。
②以下物质可以用来吸收烟气中SO2的是__(填字母代号)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动时汽缸温度高,汽缸中会生成NO,化学方程式为___。
②汽车燃油不完全燃烧时产生CO。在汽车尾气系统中装上催化转化器可使CO和NO反应转化为无污染、无毒性的两种气体,其化学反应方程式为___。
16.(15分)硫酸型酸雨的形成原理可简化表示如下:
回答下列问题:
(1)A物质的化学式_________,B物质的化学式_________。
(2)根据SO2的性质,可让工厂的烟道气通过________除去SO2,达到减少污染的目的。
(3)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
注 溶液的pH越大,H+的物质的量浓度就越小。
①雨水样品的pH变化的原因是____________(用化学方程式表示)。
②如果将刚取样的上述雨水和用氯气消毒的自来水相混合,pH将_________(填“增大”“减小”或“不变”),原因是(用化学方程式表示):_____________。
(4)你认为减少酸雨产生可采用的措施是_________(填序号)。
①少用煤做燃料;②把工厂烟囱造高;③燃料脱硫;④在已酸化的土壤中加石灰;⑤开发新能源
选项
陈述Ⅰ
陈述Ⅱ
A
S有可燃性
S在纯氧中燃烧生成SO3
B
SiO2有导电性
SiO2可用于制备光导纤维
C
浓硫酸有强氧化性
浓硫酸可用于干燥H2和CO
D
Fe3+有氧化性
FeCl3溶液可用于回收废旧电路板中的铜
离子
K+
Na+
NH4+
SO42-
NO3-
Cl-
浓度/ml·L-1
4×10-6
6×10-6
2×10-5
4×10-5
3×10-5
2×10-5
高中化学人教版 (2019)必修 第二册第六章 化学反应与能量优秀习题: 这是一份高中化学人教版 (2019)必修 第二册第六章 化学反应与能量优秀习题,文件包含新教材精创第六章章末测试2原卷版docx、新教材精创第六章章末测试2解析版docx等2份试卷配套教学资源,其中试卷共26页, 欢迎下载使用。
化学必修 第二册第七章 有机化合物精品当堂达标检测题: 这是一份化学必修 第二册第七章 有机化合物精品当堂达标检测题,文件包含新教材精创第七章章末测试1原卷版docx、新教材精创第七章章末测试1解析版docx等2份试卷配套教学资源,其中试卷共20页, 欢迎下载使用。
化学人教版 (2019)第六章 化学反应与能量优秀课时练习: 这是一份化学人教版 (2019)第六章 化学反应与能量优秀课时练习,文件包含新教材精创第六章章末测试1原卷版docx、新教材精创第六章章末测试1解析版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。













