

还剩9页未读,
继续阅读
北京市大兴区2020届高三第一次综合练习考试化学试题
展开
大兴区2019~2020学年度第二学期一模检测
高三化学 2020.4
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Fe 56 Cl 35.5
第Ⅰ卷(选择题 共42分)
本部分共14小题,每小题只有一个选项符合题意,每小题3分
1.2020年春天,为了抗击新型冠状病毒传播,人们采取了多种消毒方法,下列物质不是常用的消毒剂的是
A
B
C
D
2.以下化学用语表述正确的是
A.氯乙烷的比例模型: B.核素18O的电子数为10
C. 乙烯的结构简式:CH2CH2 D.二氧化碳的电子式:
3.下列物质的用途不正确的是
A.二氧化硅可用作半导体材料 B.氯化铁可作净化水的混凝剂
C.亚硝酸钠可用作食品防腐剂 D.碳酸氢钠可用作食品膨松剂
4. 短周期元素X、Y、Z、W原子序数依次增大,XY是无色气体,在空气中很快变成红棕色,Z所在族中无非金属元素,W的最外层电子数比次外层电子数少1,下列说法正确的是
A.原子半径:X < Y < Z B.Y、W均可与Z形成离子化合物
C.最高正价:Z < X < Y < W D.气态氢化物的稳定性:Y < X < W
5. 下列对事实的解释或推断不合理的是
选项
事 实
解释或推断
A
H2SO4是强酸,H3PO4是中强酸
非金属性:S > P
B
钠遇水反应剧烈,钾遇水反应更剧烈
原子半径:K > Na
C
乙醇溶液呈中性,苯酚溶液呈酸性
苯环对羟基的活性有影响
D
甲烷和苯不能使酸性KMnO4溶液褪色
甲基苯也不能使酸性KMnO4溶液褪色
6.下列解释事实的化学用语不正确的是
A.铝制餐具不宜长期存放酸性食物:2Al3+ + 6H+ === 2 Al3+ + 3H2↑
B.用NaHCO3溶液除去CO2中的HCl气体: HCO3-+ H+ === CO2↑ + H2O
C.口罩中无纺布纤维聚丙烯的合成:
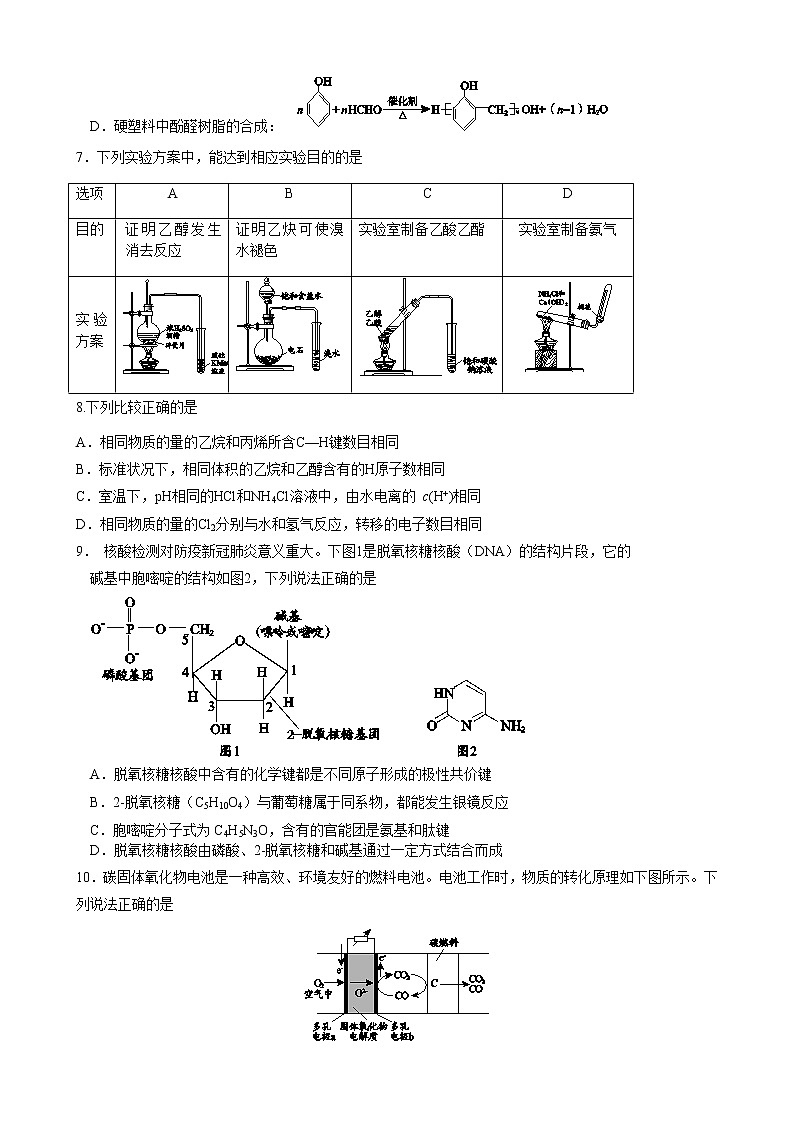
D.硬塑料中酚醛树脂的合成:
7.下列实验方案中,能达到相应实验目的的是
选项
A
B
C
D
目的
证明乙醇发生消去反应
证明乙炔可使溴水褪色
实验室制备乙酸乙酯
实验室制备氨气
实验方案
8.下列比较正确的是
A.相同物质的量的乙烷和丙烯所含C—H键数目相同
B.标准状况下,相同体积的乙烷和乙醇含有的H原子数相同
C.室温下,pH相同的HCl和NH4Cl溶液中,由水电离的 c(H+)相同
D.相同物质的量的Cl2分别与水和氢气反应,转移的电子数目相同
9. 核酸检测对防疫新冠肺炎意义重大。下图1是脱氧核糖核酸(DNA)的结构片段,它的
碱基中胞嘧啶的结构如图2,下列说法正确的是
A.脱氧核糖核酸中含有的化学键都是不同原子形成的极性共价键
B.2-脱氧核糖(C5H10O4)与葡萄糖属于同系物,都能发生银镜反应
C.胞嘧啶分子式为C4H5N3O,含有的官能团是氨基和肽键
D.脱氧核糖核酸由磷酸、2-脱氧核糖和碱基通过一定方式结合而成
10.碳固体氧化物电池是一种高效、环境友好的燃料电池。电池工作时,物质的转化原理如下图所示。下列说法正确的是
A.多孔电极a上,氧气发生氧化反应
B.多孔电极b的反应: CO - 2e - + O2- = CO2
C.整个装置的总反应:CO2 + C = 2CO
D.该电池能将碳燃料产生的能量能100%转化为电能
11. 2020年2月,科学家报道了利用磁性纳米Fe3O4颗粒除去水体草甘膦污染物的方法,其原理如下图所示:(Fe3O4颗粒在水中表面会带 -OH,在水体pH≈4时除污效果最好)。下列说法不正确的是
A. 草甘膦既可以和盐酸反应,又可以和氢氧化钠溶液反应
B. Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂
C. Fe3O4纳米颗粒粒径越小、水体pH越大除污效果越好
D. 处理完成后,Fe3O4纳米颗粒可利用磁铁回收,经加热活化重复使用
12. 乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图,下列说法正确的是
已知:①室温下,0.1mol· L—1H2C2O4的pH=1.3 ;0.1mol· L—1NaHC2O4的pH=2.8
②草酸钙(Ca C2O4)难溶于水;
A. pH=4.5的草酸溶液中含有的大量微粒有: H2C2O4 、HC2O4–、C2O42–
B. 0.1 mol·L−1 NaHC2O4溶液中:c(Na+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4)
C.向H2C2O4溶液中加入酸性高锰酸钾溶液,紫色褪去:
2MnO4 -+ 5C2O42-+16 H +== 2Mn 2+ + 10CO2↑ + 8 H2O
D.向NaHC2O4溶液中加入足量澄清石灰水,产生白色沉淀:
2HC2O4- + Ca2 ++ 2OH - == Ca C2O4↓ + 2H2O + C2O42–
13.煤燃烧排放的烟气含有SO2和NOx,是大气的重要污染源之一。用Ca(ClO)2溶液对烟气[n(SO2) ∶n(NO) =3∶2]同时脱硫脱硝(分别生成SO42- 、NO3-),得到NO、SO2脱除率如下图,下列说法不正确的是
A.脱除NO的反应:2NO + 3ClO- + H2O = 2H+ + 2NO3- + 3Cl-
B.SO2脱除率高于NO的原因可能是SO2在水中的溶解度大于NO
C.依据图中信息,在80min时,吸收液中n(NO3−)∶n(Cl−) = 2∶3
D.随着脱除反应的进行,吸收剂溶液的pH逐渐减小
14.用CO2和H2合成甲醇的化学方程式为CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) ∆H,按相同的物质的量投料,测得CO2在不同温度下(T1< T2)的平衡转化率与压强的关系如下图所示。下列说法正确的是
A.该反应的ΔH > 0 B.正反应速率:υ(a) > υ(c)
C. CH3OH的体积分数:φ(b) < φ(a) D.平衡常数: K(b) > K( c)
第II卷 非选择题(共58分)
15.(8分)某同学设计下图装置进行电解饱和食盐水自制“84”消毒液。回答下列问题
(1)电解饱和食盐水时,a连接电源的_________极(填“正”或“负”)。
(2) 利用该装置自制消毒液的化学反应方程式是_________。
(3)①“84”消毒液不用时需要密封保存,否则会与空气中_________发生反应,生成不稳
定的物质。
②该同学利用传感技术进行某溶液中次氯酸的稳定性实验。用强光照射盛有该溶液的广口瓶,过程中溶液的pH、Cl-的浓度、瓶中氧气的体积分数变化如下图:
该同学分析数据得出的结论是_________(用化学方程式表示)。
(4)“84”消毒液不能与洁厕灵混用,也不能与消毒酒精混用,请从物质性质的角度解释“84”消毒液不能与消毒酒精混用的原因________。
16.(10分)化学小组通过下列步骤测定某工厂废液中铜离子的浓度(已知废水中Fe3+对测定有干扰作用)。
i. 经检验废液中含有Fe3+ 离子,取v1 mL上述废液,加入NH4HF2 ,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+ 离子;
ii. 在上述溶液中,加入过量KI溶液,放置3min,有沉淀CuI生成,立即用0.1000 mol·L−1 Na2S2O3标准溶液滴定至浅黄色,加3mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10mL,继续滴定至终点,共消耗Na2S2O3溶液v2mL.
已知:① CuI、CuSCN均为白色难溶物,CuI 能吸附少量I2,CuSCN不吸附I2
② I2在水溶液中溶解度较小,I- + I2 ⇌ I3- 、 I-、I2、I3-的平衡体系溶液呈黄色
③ I2 + 2S2O32- == 2I- + S4O62- S2O32- 和 S4O62- 无色 ;
(1)①步骤i中检验含Fe3+ 离子操作和现象 。
②已知 Fe3++ 6F-⇌ [FeF6]3-,如果省略步骤i,则导致实验结果 ( 填“偏大”或 “偏小” ) 。
(2)① 步骤ii.中生成沉淀的离子方程式 。
② 步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+ 充分反应;
二是 。
(3)① 步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是 。
② 步骤iii中判定滴定终点的现象是 。
(4)经小组测定,废液中c(Cu2+)= 。
17.(14分)碘海醇是一种临床中应用广泛的非离子型造影剂,具有耐受性好,毒性低等优点,利用碘海醇做造影剂进行肺部CT检查,能为新冠肺炎确诊及治疗提供重要参考,碘海醇的一种合成路线如下:
(1)已知A是苯的同系物,则A的结构简式为________。
(2)C中所含官能团的名称为_________。
(3)写出C→D的化学反应方程式_________。
(4)E的结构简式为_______。
(5)M与B互为同分异构体,M是含有苯环的酯类物质,能发生银镜反应,且苯环上一氯取代物有两种。写出任意一种符合上述条件的M的结构简式________。
(6)上述合成路线中,由合成碘海醇过程如下,下列说法正确的是________。
a. 步骤1中1mol N需消耗3mol ICl,并且有副产物HCl生成
b. 步骤2和步骤3中的反应类型相同
c. 碘海醇极易溶于水与其结构中存在较多的羟基有关
(7)有机物Q(C3H8O3)可由油脂水解制得,已知合成路线中的物质B可与Q形成交联聚合物P,P的结构片段如下:
① 其中的结构简式为_______。
② 写出一定条件下相同物质的量的B与Q反应,
形成线型高分子的化学方程式_______。
18.(12分)某小组探究从印刷电路板回收液(pH=1,含Fe2+、Cu2+、Cl-及少量Fe3+)制取磁性氧化铁,并测定其中Fe3+和Fe2+的物质的量比。过程如下:
已知: 25oC时:Ksp[Fe(OH)2]=8.0×10–16 ; 溶解度S( FeCl2 ) = 64g
(1)过程Ⅰ中除铜反应的离子方程式为_______。
(2)过程Ⅱ用H2O2调Fe3+ / Fe2+比为1.6:1。该过程中有少量无色气体生成,主要原因
是______。
(3)过程Ⅲ:调pH、加热
1)甲同学将溶液迅速调至pH≈4,产生沉淀,通过下列①和②推断沉淀的成分。
①取静置后的上层清液,___________,证明清液中含Fe2+;
②甲同学通过已知条件计算,推断沉淀中一定不含Fe(OH)2,其推断过程是______。
2)乙同学探究不同反应条件对产品质量的影响
①若调节pH过程太慢,在pH≈5时,Fe2+ 容易在空气中发生副反应,生成FeO(OH)固体影响产品质量。写出该反应的离子方程式________。
②若其它条件不变,调节pH过高( pH >9 )、温度高于95oC,产品会参杂较多红棕色杂质,试分析可能的原因__________。
3)丙同学迅速将溶液调节pH =9,在80~90oC下搅拌2小时。过滤、洗涤、干燥得到晶体产品。写出制得晶体产品的离子方程式________。(反应条件略)
(4)Ⅳ测定
取产品样品ag,加过量硫酸溶解,得到样品溶液。用c mol·L−1 KMnO4标准液滴定。(已知:MnO4- + 5Fe2++ 8H+ = Mn2++ 5Fe3+ + 4H2O ,杂质不与KMnO4反应,且数据为多次测量平均值)。
i. 取v0 mL样品溶液,用标准液滴定至终点,消耗标准液v1 mL。
ii.另取v0 mL样品溶液,加入适量锌粉充分反应(将Fe3+ 完全转化为Fe2+),过滤,再用标准液滴定滤液至终点,消耗标准液v2 mL。
(6)晶体中Fe3+和Fe2+的物质的量比是_________(用含v1、v2的计算式表示)。
19.(14分)某学习小组对SO2使溶液褪色的机理进行探究。
I.SO2气体的制备和性质初探
(1) 装置A中发生反应的化学方程式 。
(2) 装置B中的试剂x是 。
(3) 小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是 。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置
序号
试剂a
实验现象
i
0.1 mol/L SO2溶液 ( pH = 2 )
红色逐渐变浅,之后完全褪色
ii
0.1 mol/L NaHSO3溶液 ( Ph = 5 )
红色立即变浅,之后完全褪色
iii
0.1 mol/L Na2SO3溶液 ( pH = 10 )
红色立即褪色
iv
pH = 2 H2SO4溶液
红色无明显变化
v
试剂a ________
红色无明显变化
①实验 iii中Na2SO3溶液显碱性的原因 (结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH- 对品红褪色的影响,则试剂a可能
是 溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
③ 通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆
① 甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因 。
② 乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式 。
③ 丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是 。
2019~2020学年度北京市大兴区高三第一次综合练习
高三化学参考答案及评分标准
第Ⅰ卷 选择题(共42分)
每题3分,共42分
题号
1
2
3
4
5
6
7
8
9
10
答案
B
A
A
B
D
C
D
A
D
B
题号
11
12
13
14
答案
C
B
C
D
第II卷 非选择题(共58分)
说明:(1)分值为2分的化学方程式或离子方程式,配平1分,各物质化学式1分;
除特殊要求外,反应条件、气体符号↑、沉淀符号↓不占分;要求写离子方程式写成化学方程式且正确得1分,化学方程写成离子方程式且正确得满分。
(2)答案合理酌情给分
15.(8分)
电解
(1)负 (1分)
电解
(2)NaCl + H2O ==== NaClO + H2↑ (2分)
(或 2NaCl + 2H2O ==== 2NaOH + H2↑、 2NaOH + Cl2 ====NaCl + NaClO + H2O )
光照
(3)①CO2 (1分)
②2HClO ==== 2 H Cl + O2↑ (2分)
(4)酒精有一定的还原性,次氯酸钠具有强氧化性,二者发生氧化还原反应(可能生成乙醛、乙酸、二氧化碳等产物),从而失去杀菌消毒的能力。 (2分)
16.(10分)
(1)①从废液中取出少许放入试管中,滴加几滴KSCN溶液,溶液显红色,证明溶液中含有Fe3+ (其他答案合理给分) (2分)
②偏大 (1分)
(2)① 2Cu2++ 4I-=2CuI+ I2或2Cu2++ 5I-=2CuI+ I3- (2分)
② 使 I2转化成易溶于水的I3- (1分)
(3)①释放CuI沉淀吸附的少量I2。 (1分)
② 溶液由浅蓝色恰好变成无色,且半分钟不变色 (2分)
(4)(0.1000v2)/v1 (1分)
17.(14分)
(1) (1分)
(2)硝基、羧基 (2分)
(3) (2分)
(4) (2分)
(5) (其他正确可得分) (2分)
(6)ac (2分)
(7)① (1分)
② (2分)
18.(12分)
Fe3+
(1) Fe + Cu2+ == Fe2+ + Cu (2分)
(2) Fe3+催化,使H2O2分解放出氧气。(或2H2O2=== 2H2O +O2↑) (1分)
(3) 1) ①加入铁氰化钾溶液,出现蓝色沉淀 (1分)
②Ksp[Fe(OH)2]=8.0×10–16,pH=4时,生成Fe(OH)2沉淀所需c(Fe2+)>8×104,根据氯化亚铁溶解度,溶液中亚铁离子浓度不可能达到。 (1分)
2)① 4Fe2+ + O2 + 6H2O = 4FeO(OH) + 8H+ (2分)(反应物写出氧气1分)
② pH过高(pH>9)、温度高于95oC,Fe(OH)2还原性增强,与空气中氧气反应速率加快,使Fe(OH)3增加过多,最后分解成红棕色Fe2O3。 (2分)
3)Fe2+ + 2Fe3+ + 8OH- == Fe3O4 + 4H2O (2分)
(4) (v2-v1)/v1 (1分)
加热
19.(14分)
(1)Cu + 2H2SO4(浓) === CuSO4 + SO2↑ + 2H2O (2分)
(2)饱和NaHSO3 (1分)
(3)SO2具有还原性,与I2发生氧化还原反应。(SO2+I2+2H2O=H2SO4+2HI),使碘水的黄色褪去。
(1分)
(4)① SO32–在溶液发生水解, SO32-+ H2OHSO3- + OH-,SO32-结合 H2O电离的H+,从而使c(OH–) > c(H+),溶液呈碱性。 (2分)
② pH=10的NaOH溶液(或pH=10的Na2CO3溶液) (1分)
③ SO32–、HSO3–、H2SO3
共轭 (双键或对醌式结构) (2分,各1分)
(5)① SO2+H2O H2SO3,加热使溶液中SO2逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,品红浓度增大,恢复红色。 (2分)
② SO2 + 2OH- + Ba2+ = BaSO3↓ + H2O (2分)
③ 碘水 (1分)
高三化学 2020.4
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Fe 56 Cl 35.5
第Ⅰ卷(选择题 共42分)
本部分共14小题,每小题只有一个选项符合题意,每小题3分
1.2020年春天,为了抗击新型冠状病毒传播,人们采取了多种消毒方法,下列物质不是常用的消毒剂的是
A
B
C
D
2.以下化学用语表述正确的是
A.氯乙烷的比例模型: B.核素18O的电子数为10
C. 乙烯的结构简式:CH2CH2 D.二氧化碳的电子式:
3.下列物质的用途不正确的是
A.二氧化硅可用作半导体材料 B.氯化铁可作净化水的混凝剂
C.亚硝酸钠可用作食品防腐剂 D.碳酸氢钠可用作食品膨松剂
4. 短周期元素X、Y、Z、W原子序数依次增大,XY是无色气体,在空气中很快变成红棕色,Z所在族中无非金属元素,W的最外层电子数比次外层电子数少1,下列说法正确的是
A.原子半径:X < Y < Z B.Y、W均可与Z形成离子化合物
C.最高正价:Z < X < Y < W D.气态氢化物的稳定性:Y < X < W
5. 下列对事实的解释或推断不合理的是
选项
事 实
解释或推断
A
H2SO4是强酸,H3PO4是中强酸
非金属性:S > P
B
钠遇水反应剧烈,钾遇水反应更剧烈
原子半径:K > Na
C
乙醇溶液呈中性,苯酚溶液呈酸性
苯环对羟基的活性有影响
D
甲烷和苯不能使酸性KMnO4溶液褪色
甲基苯也不能使酸性KMnO4溶液褪色
6.下列解释事实的化学用语不正确的是
A.铝制餐具不宜长期存放酸性食物:2Al3+ + 6H+ === 2 Al3+ + 3H2↑
B.用NaHCO3溶液除去CO2中的HCl气体: HCO3-+ H+ === CO2↑ + H2O
C.口罩中无纺布纤维聚丙烯的合成:
D.硬塑料中酚醛树脂的合成:
7.下列实验方案中,能达到相应实验目的的是
选项
A
B
C
D
目的
证明乙醇发生消去反应
证明乙炔可使溴水褪色
实验室制备乙酸乙酯
实验室制备氨气
实验方案
8.下列比较正确的是
A.相同物质的量的乙烷和丙烯所含C—H键数目相同
B.标准状况下,相同体积的乙烷和乙醇含有的H原子数相同
C.室温下,pH相同的HCl和NH4Cl溶液中,由水电离的 c(H+)相同
D.相同物质的量的Cl2分别与水和氢气反应,转移的电子数目相同
9. 核酸检测对防疫新冠肺炎意义重大。下图1是脱氧核糖核酸(DNA)的结构片段,它的
碱基中胞嘧啶的结构如图2,下列说法正确的是
A.脱氧核糖核酸中含有的化学键都是不同原子形成的极性共价键
B.2-脱氧核糖(C5H10O4)与葡萄糖属于同系物,都能发生银镜反应
C.胞嘧啶分子式为C4H5N3O,含有的官能团是氨基和肽键
D.脱氧核糖核酸由磷酸、2-脱氧核糖和碱基通过一定方式结合而成
10.碳固体氧化物电池是一种高效、环境友好的燃料电池。电池工作时,物质的转化原理如下图所示。下列说法正确的是
A.多孔电极a上,氧气发生氧化反应
B.多孔电极b的反应: CO - 2e - + O2- = CO2
C.整个装置的总反应:CO2 + C = 2CO
D.该电池能将碳燃料产生的能量能100%转化为电能
11. 2020年2月,科学家报道了利用磁性纳米Fe3O4颗粒除去水体草甘膦污染物的方法,其原理如下图所示:(Fe3O4颗粒在水中表面会带 -OH,在水体pH≈4时除污效果最好)。下列说法不正确的是
A. 草甘膦既可以和盐酸反应,又可以和氢氧化钠溶液反应
B. Fe3O4纳米颗粒除去草甘膦的过程有化学键的形成和断裂
C. Fe3O4纳米颗粒粒径越小、水体pH越大除污效果越好
D. 处理完成后,Fe3O4纳米颗粒可利用磁铁回收,经加热活化重复使用
12. 乙二酸(H2C2O4)俗称草酸,在实验研究和化学工业中应用广泛。草酸溶液中各粒子的物质的量分数随溶液pH变化关系如下图,下列说法正确的是
已知:①室温下,0.1mol· L—1H2C2O4的pH=1.3 ;0.1mol· L—1NaHC2O4的pH=2.8
②草酸钙(Ca C2O4)难溶于水;
A. pH=4.5的草酸溶液中含有的大量微粒有: H2C2O4 、HC2O4–、C2O42–
B. 0.1 mol·L−1 NaHC2O4溶液中:c(Na+) > c(HC2O4–) > c(C2O42–) > c(H2C2O4)
C.向H2C2O4溶液中加入酸性高锰酸钾溶液,紫色褪去:
2MnO4 -+ 5C2O42-+16 H +== 2Mn 2+ + 10CO2↑ + 8 H2O
D.向NaHC2O4溶液中加入足量澄清石灰水,产生白色沉淀:
2HC2O4- + Ca2 ++ 2OH - == Ca C2O4↓ + 2H2O + C2O42–
13.煤燃烧排放的烟气含有SO2和NOx,是大气的重要污染源之一。用Ca(ClO)2溶液对烟气[n(SO2) ∶n(NO) =3∶2]同时脱硫脱硝(分别生成SO42- 、NO3-),得到NO、SO2脱除率如下图,下列说法不正确的是
A.脱除NO的反应:2NO + 3ClO- + H2O = 2H+ + 2NO3- + 3Cl-
B.SO2脱除率高于NO的原因可能是SO2在水中的溶解度大于NO
C.依据图中信息,在80min时,吸收液中n(NO3−)∶n(Cl−) = 2∶3
D.随着脱除反应的进行,吸收剂溶液的pH逐渐减小
14.用CO2和H2合成甲醇的化学方程式为CO2(g) + 3H2(g) ⇌ CH3OH(g) + H2O(g) ∆H,按相同的物质的量投料,测得CO2在不同温度下(T1< T2)的平衡转化率与压强的关系如下图所示。下列说法正确的是
A.该反应的ΔH > 0 B.正反应速率:υ(a) > υ(c)
C. CH3OH的体积分数:φ(b) < φ(a) D.平衡常数: K(b) > K( c)
第II卷 非选择题(共58分)
15.(8分)某同学设计下图装置进行电解饱和食盐水自制“84”消毒液。回答下列问题
(1)电解饱和食盐水时,a连接电源的_________极(填“正”或“负”)。
(2) 利用该装置自制消毒液的化学反应方程式是_________。
(3)①“84”消毒液不用时需要密封保存,否则会与空气中_________发生反应,生成不稳
定的物质。
②该同学利用传感技术进行某溶液中次氯酸的稳定性实验。用强光照射盛有该溶液的广口瓶,过程中溶液的pH、Cl-的浓度、瓶中氧气的体积分数变化如下图:
该同学分析数据得出的结论是_________(用化学方程式表示)。
(4)“84”消毒液不能与洁厕灵混用,也不能与消毒酒精混用,请从物质性质的角度解释“84”消毒液不能与消毒酒精混用的原因________。
16.(10分)化学小组通过下列步骤测定某工厂废液中铜离子的浓度(已知废水中Fe3+对测定有干扰作用)。
i. 经检验废液中含有Fe3+ 离子,取v1 mL上述废液,加入NH4HF2 ,再加H2SO4酸化至pH<4,再次检测,未检验出Fe3+ 离子;
ii. 在上述溶液中,加入过量KI溶液,放置3min,有沉淀CuI生成,立即用0.1000 mol·L−1 Na2S2O3标准溶液滴定至浅黄色,加3mL淀粉指示剂,继续滴定,至溶液变为浅蓝色;
iii. 再向上述溶液中加入10% KSCN溶液10mL,继续滴定至终点,共消耗Na2S2O3溶液v2mL.
已知:① CuI、CuSCN均为白色难溶物,CuI 能吸附少量I2,CuSCN不吸附I2
② I2在水溶液中溶解度较小,I- + I2 ⇌ I3- 、 I-、I2、I3-的平衡体系溶液呈黄色
③ I2 + 2S2O32- == 2I- + S4O62- S2O32- 和 S4O62- 无色 ;
(1)①步骤i中检验含Fe3+ 离子操作和现象 。
②已知 Fe3++ 6F-⇌ [FeF6]3-,如果省略步骤i,则导致实验结果 ( 填“偏大”或 “偏小” ) 。
(2)① 步骤ii.中生成沉淀的离子方程式 。
② 步骤ii中加入的KI的量是理论值的2至3倍,其目的一是使Cu2+ 充分反应;
二是 。
(3)① 步骤iii中加入KSCN溶液使ii中的沉淀转化为CuSCN沉淀,其目的是 。
② 步骤iii中判定滴定终点的现象是 。
(4)经小组测定,废液中c(Cu2+)= 。
17.(14分)碘海醇是一种临床中应用广泛的非离子型造影剂,具有耐受性好,毒性低等优点,利用碘海醇做造影剂进行肺部CT检查,能为新冠肺炎确诊及治疗提供重要参考,碘海醇的一种合成路线如下:
(1)已知A是苯的同系物,则A的结构简式为________。
(2)C中所含官能团的名称为_________。
(3)写出C→D的化学反应方程式_________。
(4)E的结构简式为_______。
(5)M与B互为同分异构体,M是含有苯环的酯类物质,能发生银镜反应,且苯环上一氯取代物有两种。写出任意一种符合上述条件的M的结构简式________。
(6)上述合成路线中,由合成碘海醇过程如下,下列说法正确的是________。
a. 步骤1中1mol N需消耗3mol ICl,并且有副产物HCl生成
b. 步骤2和步骤3中的反应类型相同
c. 碘海醇极易溶于水与其结构中存在较多的羟基有关
(7)有机物Q(C3H8O3)可由油脂水解制得,已知合成路线中的物质B可与Q形成交联聚合物P,P的结构片段如下:
① 其中的结构简式为_______。
② 写出一定条件下相同物质的量的B与Q反应,
形成线型高分子的化学方程式_______。
18.(12分)某小组探究从印刷电路板回收液(pH=1,含Fe2+、Cu2+、Cl-及少量Fe3+)制取磁性氧化铁,并测定其中Fe3+和Fe2+的物质的量比。过程如下:
已知: 25oC时:Ksp[Fe(OH)2]=8.0×10–16 ; 溶解度S( FeCl2 ) = 64g
(1)过程Ⅰ中除铜反应的离子方程式为_______。
(2)过程Ⅱ用H2O2调Fe3+ / Fe2+比为1.6:1。该过程中有少量无色气体生成,主要原因
是______。
(3)过程Ⅲ:调pH、加热
1)甲同学将溶液迅速调至pH≈4,产生沉淀,通过下列①和②推断沉淀的成分。
①取静置后的上层清液,___________,证明清液中含Fe2+;
②甲同学通过已知条件计算,推断沉淀中一定不含Fe(OH)2,其推断过程是______。
2)乙同学探究不同反应条件对产品质量的影响
①若调节pH过程太慢,在pH≈5时,Fe2+ 容易在空气中发生副反应,生成FeO(OH)固体影响产品质量。写出该反应的离子方程式________。
②若其它条件不变,调节pH过高( pH >9 )、温度高于95oC,产品会参杂较多红棕色杂质,试分析可能的原因__________。
3)丙同学迅速将溶液调节pH =9,在80~90oC下搅拌2小时。过滤、洗涤、干燥得到晶体产品。写出制得晶体产品的离子方程式________。(反应条件略)
(4)Ⅳ测定
取产品样品ag,加过量硫酸溶解,得到样品溶液。用c mol·L−1 KMnO4标准液滴定。(已知:MnO4- + 5Fe2++ 8H+ = Mn2++ 5Fe3+ + 4H2O ,杂质不与KMnO4反应,且数据为多次测量平均值)。
i. 取v0 mL样品溶液,用标准液滴定至终点,消耗标准液v1 mL。
ii.另取v0 mL样品溶液,加入适量锌粉充分反应(将Fe3+ 完全转化为Fe2+),过滤,再用标准液滴定滤液至终点,消耗标准液v2 mL。
(6)晶体中Fe3+和Fe2+的物质的量比是_________(用含v1、v2的计算式表示)。
19.(14分)某学习小组对SO2使溶液褪色的机理进行探究。
I.SO2气体的制备和性质初探
(1) 装置A中发生反应的化学方程式 。
(2) 装置B中的试剂x是 。
(3) 小组同学观察到C、D中溶液均褪色,通过检验C溶液中有SO42-,得出C中溶液褪色的原因是 。
II.小组同学通过实验继续对D中品红溶液褪色进行探究。
(4)探究使品红褪色的主要主要微粒(分别取2 mL试剂a,滴加2滴品红溶液)
装置
序号
试剂a
实验现象
i
0.1 mol/L SO2溶液 ( pH = 2 )
红色逐渐变浅,之后完全褪色
ii
0.1 mol/L NaHSO3溶液 ( Ph = 5 )
红色立即变浅,之后完全褪色
iii
0.1 mol/L Na2SO3溶液 ( pH = 10 )
红色立即褪色
iv
pH = 2 H2SO4溶液
红色无明显变化
v
试剂a ________
红色无明显变化
①实验 iii中Na2SO3溶液显碱性的原因 (结合化学用语分析解释)。
②对比实验iii 和v,可以排除在该实验条件下OH- 对品红褪色的影响,则试剂a可能
是 溶液。
查阅资料:品红与SO2水溶液、NaHSO3溶液、Na2SO3溶液反应前后物质如下:
③ 通过上述实验探究并结合资料,小组同学得出结论:一是使品红溶液褪色的主要微粒是________;二是品红溶液中颜色变化主要与其分子中的________结构有关。
(5)验证SO2使品红褪色反应的可逆
① 甲同学加热实验i褪色后的溶液,产生刺激性气味气体,红色恢复,从化学平衡移动角度解释红色恢复的原因 。
② 乙同学向实验i褪色后的溶液中滴入Ba(OH)2溶液至pH=10,生成白色沉淀,溶液变红。写出生成白色沉淀的离子方程式 。
③ 丙同学利用SO2的还原性,运用本题所用试剂,设计了如下实验,证实了SO2使品红褪色反应的可逆:则试剂Y是 。
2019~2020学年度北京市大兴区高三第一次综合练习
高三化学参考答案及评分标准
第Ⅰ卷 选择题(共42分)
每题3分,共42分
题号
1
2
3
4
5
6
7
8
9
10
答案
B
A
A
B
D
C
D
A
D
B
题号
11
12
13
14
答案
C
B
C
D
第II卷 非选择题(共58分)
说明:(1)分值为2分的化学方程式或离子方程式,配平1分,各物质化学式1分;
除特殊要求外,反应条件、气体符号↑、沉淀符号↓不占分;要求写离子方程式写成化学方程式且正确得1分,化学方程写成离子方程式且正确得满分。
(2)答案合理酌情给分
15.(8分)
电解
(1)负 (1分)
电解
(2)NaCl + H2O ==== NaClO + H2↑ (2分)
(或 2NaCl + 2H2O ==== 2NaOH + H2↑、 2NaOH + Cl2 ====NaCl + NaClO + H2O )
光照
(3)①CO2 (1分)
②2HClO ==== 2 H Cl + O2↑ (2分)
(4)酒精有一定的还原性,次氯酸钠具有强氧化性,二者发生氧化还原反应(可能生成乙醛、乙酸、二氧化碳等产物),从而失去杀菌消毒的能力。 (2分)
16.(10分)
(1)①从废液中取出少许放入试管中,滴加几滴KSCN溶液,溶液显红色,证明溶液中含有Fe3+ (其他答案合理给分) (2分)
②偏大 (1分)
(2)① 2Cu2++ 4I-=2CuI+ I2或2Cu2++ 5I-=2CuI+ I3- (2分)
② 使 I2转化成易溶于水的I3- (1分)
(3)①释放CuI沉淀吸附的少量I2。 (1分)
② 溶液由浅蓝色恰好变成无色,且半分钟不变色 (2分)
(4)(0.1000v2)/v1 (1分)
17.(14分)
(1) (1分)
(2)硝基、羧基 (2分)
(3) (2分)
(4) (2分)
(5) (其他正确可得分) (2分)
(6)ac (2分)
(7)① (1分)
② (2分)
18.(12分)
Fe3+
(1) Fe + Cu2+ == Fe2+ + Cu (2分)
(2) Fe3+催化,使H2O2分解放出氧气。(或2H2O2=== 2H2O +O2↑) (1分)
(3) 1) ①加入铁氰化钾溶液,出现蓝色沉淀 (1分)
②Ksp[Fe(OH)2]=8.0×10–16,pH=4时,生成Fe(OH)2沉淀所需c(Fe2+)>8×104,根据氯化亚铁溶解度,溶液中亚铁离子浓度不可能达到。 (1分)
2)① 4Fe2+ + O2 + 6H2O = 4FeO(OH) + 8H+ (2分)(反应物写出氧气1分)
② pH过高(pH>9)、温度高于95oC,Fe(OH)2还原性增强,与空气中氧气反应速率加快,使Fe(OH)3增加过多,最后分解成红棕色Fe2O3。 (2分)
3)Fe2+ + 2Fe3+ + 8OH- == Fe3O4 + 4H2O (2分)
(4) (v2-v1)/v1 (1分)
加热
19.(14分)
(1)Cu + 2H2SO4(浓) === CuSO4 + SO2↑ + 2H2O (2分)
(2)饱和NaHSO3 (1分)
(3)SO2具有还原性,与I2发生氧化还原反应。(SO2+I2+2H2O=H2SO4+2HI),使碘水的黄色褪去。
(1分)
(4)① SO32–在溶液发生水解, SO32-+ H2OHSO3- + OH-,SO32-结合 H2O电离的H+,从而使c(OH–) > c(H+),溶液呈碱性。 (2分)
② pH=10的NaOH溶液(或pH=10的Na2CO3溶液) (1分)
③ SO32–、HSO3–、H2SO3
共轭 (双键或对醌式结构) (2分,各1分)
(5)① SO2+H2O H2SO3,加热使溶液中SO2逸出,溶液中H2SO3和SO2浓度均降低,使SO2与品红反应逆向移动,品红浓度增大,恢复红色。 (2分)
② SO2 + 2OH- + Ba2+ = BaSO3↓ + H2O (2分)
③ 碘水 (1分)
相关资料
更多








