

2018-2019学年吉林省延边第二中学高二下学期第二次月考化学试题 Word版
展开
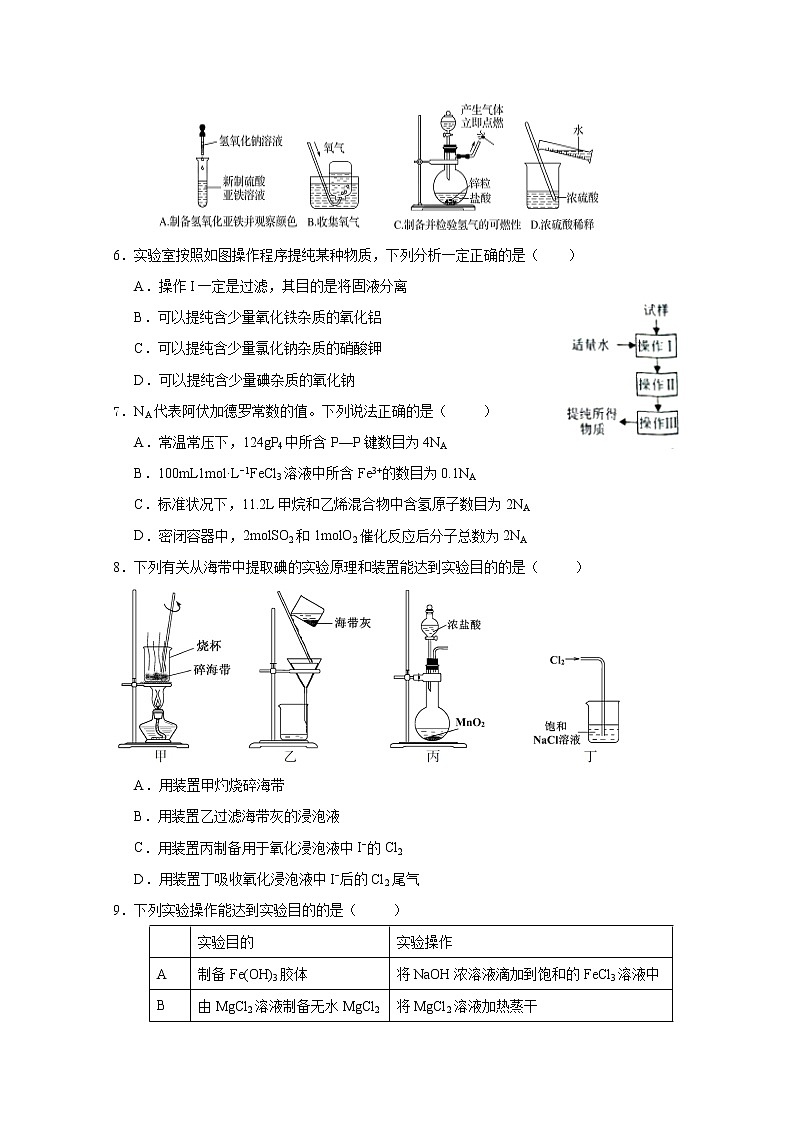
延边第二中学2018~2019学年度第二学期第二次阶段检测高二年级化学学科试卷 试卷说明:试卷分为两部分,第一部分选择题共20题(共60分),第二部分为非选择题(共40分)可能用到的相对原子量:H:1 Li:7 C:12 N:14 O:16 Na:23 Al:27 S:32 Cl:35.5 K:39 Ca:40 Fe:56Cu:64 Ba:137Ⅰ部分(共60分)1.下列物质在生活中应用时,起还原作用的是( )A.明矾作净水剂 B.甘油作护肤保湿剂C.漂粉精作消毒剂 D.铁粉作食品袋内的脱氧剂2.图表归纳是学习化学的常用方法,某同学归纳的下表物质与图中对应关系正确的是( )选项XYZA含氧酸一元强酸HClO4B易溶碱强碱NaOHC盐酸式盐NaHCO3D非电解质氧化物CO23.化学与生活、社会发展息息相关,下列有关说法不正确的是( )A.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应B.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应C.“青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化D.向豆浆中加入盐卤(主要成分为MgCl2)可制作豆腐,利用了胶体聚沉的性质4.阿伏加德罗常数的值为NA。下列说法正确的是( ) A.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA B.2.4 g Mg与H2SO4完全反应,转移的电子数为0.1NA C.标准状况下,2.24 L N2和O2的混合气体中分子数为0.2NA D.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA5.下列实验能达到目的且符合安全要求的是( ) 6.实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
A.操作I一定是过滤,其目的是将固液分离B.可以提纯含少量氧化铁杂质的氧化铝C.可以提纯含少量氯化钠杂质的硝酸钾D.可以提纯含少量碘杂质的氧化钠7.NA代表阿伏加德罗常数的值。下列说法正确的是( )A.常温常压下,124gP4中所含P—P键数目为4NAB.100mL1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NAC.标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NAD.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA8.下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( ) A.用装置甲灼烧碎海带B.用装置乙过滤海带灰的浸泡液C.用装置丙制备用于氧化浸泡液中I−的Cl2D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气9.下列实验操作能达到实验目的的是( ) 实验目的实验操作A制备Fe(OH)3胶体将NaOH浓溶液滴加到饱和的FeCl3溶液中B由MgCl2溶液制备无水MgCl2将MgCl2溶液加热蒸干C除去Cu粉中混有的CuO加入稀硝酸溶液,过滤、洗涤、干燥D比较Ksp(AgCl)与Ksp(AgI)向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液10.下列有关物质分类或归纳的说法中,正确的是( )A、C60、液氯是单质,HD和干冰是化合物,NO2是酸性氧化物 B、胆矾、铝热剂、漂白粉、福尔马林都是混合物C、煤的干馏、煤的气化、煤的液化、海带中提取碘的过程都包括化学变化D、已知NaH2PO2是正盐,其水溶液呈碱性,则H3PO2属于三元弱酸11.同温同压下,x g的甲气体和y g的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是( )A.x∶y等于甲与乙的相对分子质量之比B.x∶y等于等质量的甲与乙的分子个数之比C.x∶y等于同温同压下甲与乙的密度之比D.y∶x等于同温同体积下等质量的甲与乙的压强之比12.标准状况下V L氨气溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρg·mL-1,质量分数为w,物质的量浓度为cmol·L-1,则下列关系中不正确的是( )A.ρ=(17V+22 400)/(22.4+22.4V)B.w=17c/(1 000ρ)C.w=17V/(17V+22 400)D.c=1 000Vρ/(17V+22 400)13.设NA为阿伏加德罗常数,下列叙述正确的是( ) A.1 mol N2与4 mol H2反应生成的NH3分子数为2NA B.32 g S8(分子结构:)中的共价键数目为NA C.标准状况下,11.2 L Cl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA D.39g钾与氧气完全反应,生成K2O转移NA个电子,生成KO2转移2NA电子14.某白色粉末由两种物质组成,为鉴别其成分进行如下实验:①取少量样品加入足量水仍有部分固体未溶解,再加入足量稀盐酸,有气泡产生,固体全部溶解;②取少量样品加入足量稀硫酸有气泡产生,振荡后仍有固体存在。该白色粉末可能为( ) A.NaHCO3、Al(OH)3 B.AgCl、NaHCO3 C.Na2SO3、BaCO3 D.Na2CO3、CuSO415.利用下列实验装置不能完成相应实验的是( )A.用装置①测量生成氧气的化学反应速率B.用装置②比较NaHCO3和Na2CO3的热稳定性C.装置③中分液漏斗内的液体可顺利加入蒸馏烧瓶中D.装置④可实现制取CO2实验中的“即关即止,即开即用”的作用16.一定温度下,某物质在水中的溶解度为S,计算该温度下这种饱和溶液中溶质的物质的量浓度,必不可少的物理量是( )①溶液中溶质的摩尔质量 ②溶液中溶质和溶剂的质量比 ③溶液的密度 ④溶液的体积A.①② B.②③ C.①③ D.②④17.正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀; ②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )A.萃取、过滤、蒸馏、蒸馏 B.过滤、分液、蒸馏、萃取C.过滤、蒸馏、过滤、蒸馏 D.过滤、分液、过滤、蒸馏18.一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入350mL 2mol•L﹣1的稀硝酸恰好使混合物完全溶解,放出2.24L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为( ) A.0.21 mol B.0.25 molC.0.3 molD.0.35 mol19.实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )A.①、②、③中依次盛装KMnO4溶液、浓H2SO4、焦性没食子酸溶液B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度C.结束反应时,先关闭活塞K,再停止加热D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气20. 1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是( )A.该合金中铜与镁的物质的量之比是2:1B.NO2和N2O4的混合气体中,NO2的体积分数是80%C.该浓硝酸中HNO3的物质的量浓度是14.0 mol/LD.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mLII部分(共40分)21.(10分)人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草 酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸 (H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。【配制KMnO4标准溶液】如图所示是配制50 mL KMnO4标准溶液的过程示意图。(1)请你观察图示判断,其中不正确的操作有_____________(填序号)。(2)其中确定50 mL溶液体积的容器是_____________(填名称)。(3)如果用图示的操作配制溶液,所配制的溶液浓度将_________(填“偏大”或“偏小”)。【测定血液样品中Ca2+的浓度】抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol/L KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。(4)已知草酸跟KMnO4反应的离子方程式为2MnO4-+5H2C2O4+6H+===2Mnx++10CO2↑+8H2O,则方程式中的x=________。(5)经过计算,血液样品中Ca2+的浓度为________mg/cm3。22.(10分)醋酸亚铬[(CH3COO)2Cr·H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题: (1)仪器a的名称是___________。(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1、K2,关闭K3。①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_____________________________。②同时c中有气体产生,该气体的作用是__________________________________。(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是_____________________________;(4)指出装置d可能存在的缺点____________________________。 23.(20分)硫及其化合物有许多用途,相关物质的物理常数如下表所示: H2SS8FeS2SO2SO3H2SO4熔点/℃−85.5115.2>600(分解)−75.516.810.3沸点/℃−60.3444.6−10.045.0337.0 回答下列问题:(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______________________,基态S原子电子占据最高能级的电子云轮廓图为_________形。(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_________________________________________。 (4)气态三氧化硫以单分子形式存在,其分子的立体构型为_______________形,其中共价键的类型有_____________种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________________。(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为__________________g·cm−3;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为____________________nm。1molFeS2晶体中含有阴阳离子总数为 。 1-20 DCCDB CCBDC BABCB CDCBD 21. (1)②⑤ (2)容量瓶 (3)偏小 (4)2 (5)1.222. (1)分液(或滴液)漏斗(2)①Zn+2Cr3+===Zn2++2Cr2+ ②排除c中空气(3)c中产生H2使压强大于大气压(答案合理即可) (4)敞开体系,可能使醋酸亚铬与空气接触(答案合理即可) 23. (1)略 哑铃 ⑵H2S ⑶S8属于分子晶体,熔点高低与其相对分子质量的大小直接相关,因为S8的相对分子质量比SO2大的多,因此其熔沸点比SO2高许多。⑷平面三角形 2 sp3杂化 (5) (答案合理即可) √2a/2 2NA





