

安徽省示范高中皖北协作区2020届高三联考化学 试卷
展开安徽省示范高中皖北协作区2020届高三联考
可能用到的相对原子质量:H1 C 12 N 14 O16 Na23 A127 Si28 S32 Ca 40
7.西晋张华《博物志》载:“临邛(今四川邛崃)火井一所,纵广五尺,深二三丈....昔时人以竹木投以取火....以盆盖井上,煮盐得盐。”文中涉及的操作方法是( )
A.蒸馏 B.升华 C.干馏 D.结晶
8.下列关于有机物乙苯( )的说法正确的是( )
A.沸点比苯高
B.分子中所有碳原子不可能共平面
C.二氯代物共有12种
D.能与H2发生加成反应,说明分子中含有碳碳双键
9.利用如图所示装置进行下列实验,能得出相应实验结论的是( )
10.工业上除去电石渣浆(含CaO)上清液中的S2- ,并制取石膏( CaSO4 ·2H2O)的常用流程如下:
下列说法正确的是( )
A. Mn(OH)2、MnO32-在过程I、II中均起催化剂作用
B.过程I中,反应的离子方程式为2Mn(OH)2 +O2 +4OH-==2MnO32- +4H2O
C.将10L上清液中的S2 -转化为SO42- (S2-浓度为480 mg·L-1) ,理论上共需要0.03 mol 的O2
D.常温下,56 g CaO溶于水配成1 L溶液,溶液中Ca2+的数目为6.02 ×1023个
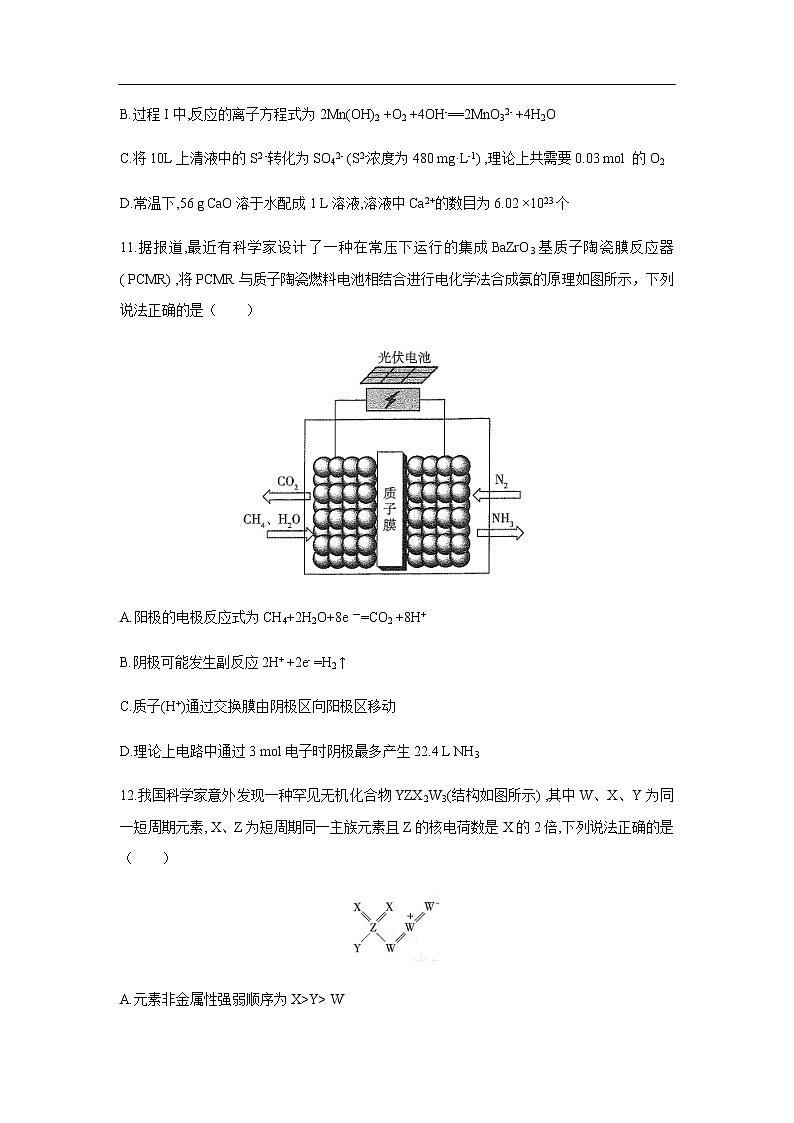
11.据报道,最近有科学家设计了一种在常压下运行的集成BaZrO3基质子陶瓷膜反应器( PCMR) ,将PCMR与质子陶瓷燃料电池相结合进行电化学法合成氨的原理如图所示,下列说法正确的是( )
A.阳极的电极反应式为CH4+2H2O+8e一=CO2 +8H+
B.阴极可能发生副反应2H+ +2e- =H2 ↑
C.质子(H+)通过交换膜由阴极区向阳极区移动
D.理论上电路中通过3 mol电子时阴极最多产生22.4 L NH3
12.我国科学家意外发现一种罕见无机化合物YZX2W3(结构如图所示) ,其中W、X、Y为同一短周期元素, X、Z为短周期同一主族元素且Z的核电荷数是X的2倍,下列说法正确的是( )
A.元素非金属性强弱顺序为X>Y> W
B. Z的氧化物的水化物是强酸
C. NaY的水溶液不能存放在玻璃试剂瓶中
D. X与Z具有相同的最高化合价
13.常温下,用0.10 mol·L-1NH3·H2O标准溶液滴定20 mL0.10 mol·L-1盐酸与未知浓度CH3COOH的混合溶液,混合溶液的相对导电能力变化曲线如图所示,已知Kb(NH3·H2O) =Ka(CH3COOH)。下列叙述错误的是( )
A. H*的导电能力大于等浓度的NH4+
B. a点混合溶液中c( CH3COO- ) +c( CH3COOH) =0.10 mol·L-1
C. b点混合溶液中,c( NH4+ ) +c( NH3·H2O) >c( CH3COOH)
D. e点混合溶液中,c(NH4+) >c(Cl-) >c(CH3COO-) >c(OH-)>c(H+)
26.(14分)间硝基苯胺是一种重要的有机合成中间体,它是一种黄色针状晶体,微溶于冷水,在水中的溶解度随温度升高而增大,易溶于乙醇、乙醚、甲醇等。实验室制备间硝基苯胺的反应原理及装置如下(夹持及加热装置略去):
实验步骤:
①硫氢化钠溶液的制备
将0.05molNa2S·9H2O溶于25mL水中,分批加入4.2gNaHCO3粉末,完全溶解后,慢慢加入30ml.甲醇,冰水浴冷却,立即析出一水合碳酸钠。静置,抽滤,滤饼用15mL甲醇分三次洗涤,合并滤液和洗涤液备用。
②间硝基苯胺的制备
在A中将0.03 mol间二硝基苯溶于40 mL热甲醇中,装上B,从B的顶端加入上述硫氢化钠溶液,水浴加热回流20min。冷却至室温后,改为蒸馏装置,蒸出大部分甲醇,将残液倾入150mL冷水中,立即析出间硝基苯胺粗品,抽滤,洗涤,重结晶,脱色后,得黄色的间硝基苯胺针状晶体2.4 g。回答下列问题:
(1)仪器B的名称是________, 使用时要从_____(填“ a”或“b")口通入冷水;滴液漏斗的细支管c的作用是_____________________________________________。
(2)写出步骤①中总反应的离子方程式:______________________________________。
(3)步骤①中合并洗涤液的目的是______________________________________。
(4)步骤②中制备装置改为蕪馏装置,需增加的仪器除了蒸馏头、温度计、尾接管之外,还有________、________。
(5)步骤②中蒸出大部分甲醇的目的是_______________________________________。
(6)步骤②中洗涤粗品使用的洗涤剂为________;粗品脱色使用的脱色剂可以是___________。
(7)本实验的产率为______[保留 2位有效数字;Mr(间硝基苯胺) = 138]。
27. (14分)粉煤灰是燃煤产生的工业固体废料,主要成分有Al2O3、SiO2 ,还含有少量Fe2O3、CaO等。采用酸碱联合的方法从粉煤灰中综合回收氧化铝及二氧化硅的工艺流程如下:
硫酸熟化过程中发生的反应有:
Al2O3·2SiO2 +3H2SO4 ==Al(SO4)3 +2SiO2 +3H2O
3Al2O3·2SiO2 +9H2SO4==3Al2( SO4)3 + 2SiO2 +9H2O
(1)“结晶”操作:缓缓加热,浓缩至_______________ ,放置冷却,得到Al2(SO4)3·18H2O。
(2)Al2(SO4)3·18H2O在250 ~300 °C下失重40.5%得Al2(SO4)·xH2O,x=______。
(3)“还原焙烧”过程中发生反应的化学方程式为__________________________________。
(4)设计实验检验粗氧化铝中是否含有Fe2O3: ______________________________________。
(5)向硅酸钠溶液中通入过量CO2制备白炭黑的化学方程式为_____________________。
(6)粗氧化铝制备冶金级氧化铝过程中发生反应[ Al(OH)4]- +CO2 ==Al(OH)3↓+ HCO3- ,该反应
的平衡常数为_______[已知 Al(OH)3+H2O [ Al(OH)4]-+H+ K1 =4×10-13 ;H2CO3
H2O +CO2 K2 =600; Kal(H2CO3) =4.2×10-7、Ka2(H2CO3) =5.6×10-11]。
28. (15分)甲醛( HCHO)在化工、医药、农药等方面有着广泛的应用。
(1)甲醇脱氢法可制备甲醛,同时生成副产物CO等,已知以下热化学方程式:
CH3OH(1) HCHO(g) +H2(g) △H1= +129.8kJ· mol-1 ( I )
CH3OH(g) CO(g) +2H2(g) △H2= +94.6kJ· mol-1( II)
CH3OH(1) CO(g) +2H2(g) △H3= +127.9 kJ ·mol-1 ( III)
①CH3OH(g) HCHO(g) +H2(g) △H4=_______kJ· mol-1(IV)
②650°C条件下,Na2CO3固体催化甲醇脱氢,是自由基引发的链反应,甲醇在Na2CO3表面上先吸附,然后发生分解,生成·H和·CH2OH或CH3O·自由基,自由基再从催化剂表面脱附、脱氢生成HCHO和CO, ·H自由基相互结合成H2。
已知:C—H键键能为413 kJ ·mol-1;O—H键键能为463 kJ · mol -1 ,试将可能性较大的转化过程补充完整:
CH3OH=·H+·CH2OH或CH3OH=·H + CH3O·_____==____+ HCHO
________=3_______+ CO
·H+·H=H2
③反应温度对该反应的影响如图所示,从图中可以看出随着反应温度的升高,甲醇平衡转化率逐渐增加,这是因为____________________________;温度高于650 °C ,甲醛选择性迅速降低,原因是____________________________________________。
按只发生反应( II )和( IV)两个平行反应,在650 °C平衡时体系总压强为p,则该温度下反应(IV)的压强平衡常数Kp=___________________. (列出算式即可)。
(2)市售甲醛溶液含量的测定方法如下(已知:HCHOO+ H2O2==HCOOH + H2O、HCOOH + NaOH===HCOONa + H2O):
①向盛有10mL水的锥形瓶中滴入mg甲醛溶液样品,加过氧化氢溶液25mL(过量)与溴麝香草酚蓝指示液2滴,再加入1 mol · L-1氢氧化钠溶液25 mL,剩余的NaOH用1 mol ·L-1盐酸滴定至溶液显黄色,消耗盐酸V1mL。
②空白实验:向盛有10mL水的锥形瓶中加过氧化氢溶液25mL与溴麝香草酚蓝指示液2滴,再加入1mol·L-1氢氧化钠溶液25mL,用1mol·L-1盐酸滴定至溶液显黄色,消耗盐酸V2mL。
则甲醛溶液样品中甲醛的质量分数为______(用含m、V1、V2的代数式表示)。
35.化学· 选修3:物质结构与性质(15分)
月球土壤中含有H、Ne、Na、Mg、Si、S、Cl、Cu等多种元素,是人类未来的资源宝库,回答下列问题:
(1)在下列电子构型中,属于Na原子的激发态构型的是______
A.1s22s22p63s1 B.1s2s22p63p1
C.1s22s22p63s13p1 D.1s22s22p43s3
(2)基态Na、Na+、O、Ne电离最外层一个电子所需能量从小到大的顺序为_________
(3)三氯化碘常以二聚体I2Cl6的形式存在,经电导仪测定知,它能发生部分电离,其电离方程式为I2C16ICl2++ICl4-。ICl2+离子的立体构型为______, 中心原子的杂化类型是_____。
(4)在[ Cu( NH3)4]2+中∠HNH比游离的氨气分子中∠HNH______,(填“大”“小”或“相等"),原因是__________________________
(5)已知MgO晶体结构与NaCl类似,Mg2+周围最近的O2-组成的多面体的形状为_____MgO的熔点高于Na2O的原因是____________________________
(6)硅的晶体结构属于金刚石型,晶胞如图所示。已知其密度为ρg●cm-3 ,设NA为阿伏加德罗常数的值,则晶胞参数a=_____nm,晶体中Si—Si 键的键长为_______ nm(用含 p、NA的代数式表示)。
36.化学· 选修5:有机化学基础(15分)
有机化合物F和K是重要的药物合成中间体,可通过以下路线合成:
(1)C的化学名称为___________________.
(2)E中的官能团名称是___________________。
(3)反应④所需的试剂和条件分别是___________、_____________。
(4)G的分子式为_________。
(5)⑨的反应类型是_____________________。
(6)写出符合下列条件的E的同分异构体的结构简式:_______________________________(不考虑立体异构,只需写出3个)。
①能发生银镜反应;②遇FeCl3溶液发生显色反应;③核磁共振氢谱为五组峰,峰面积比为2:2:2:1:1
(7)设计由和HO(CH2)5OH制备
的合成路线:_____________________________________(无机试剂任选)。
【参考答案】








