
初中化学人教版九年级下册第十单元 酸和碱综合与测试课堂检测
展开一、单选题
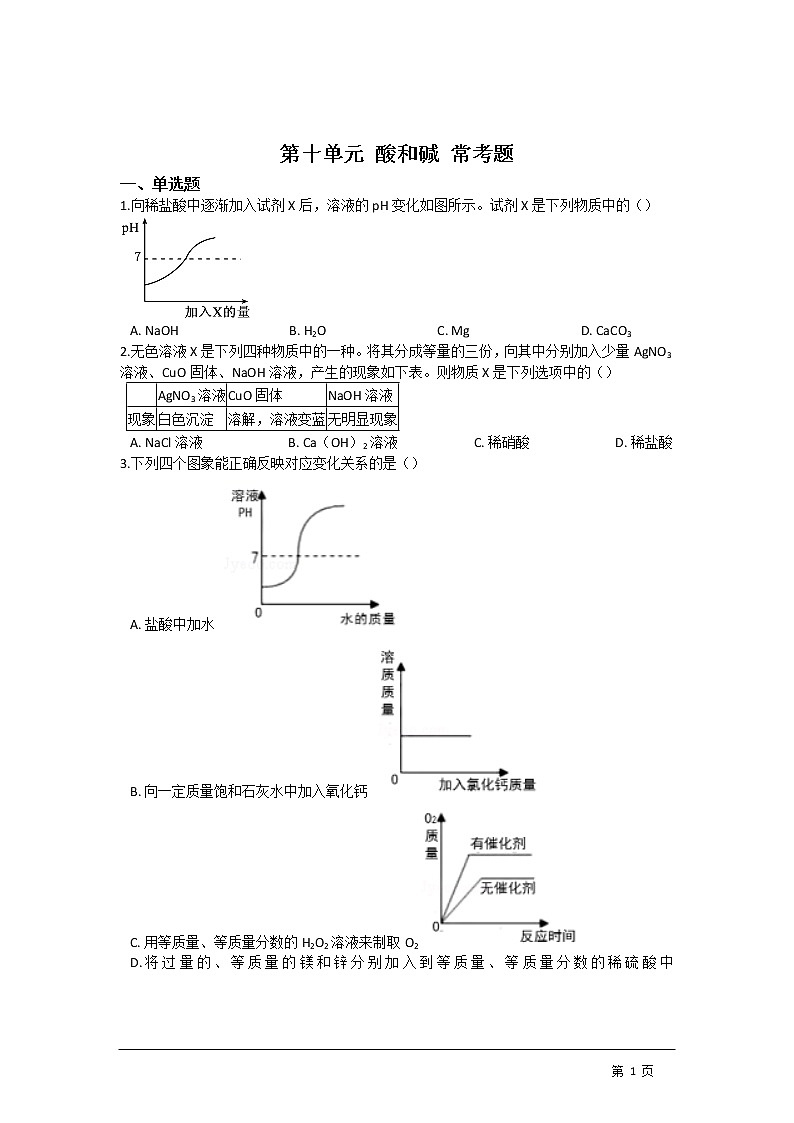
1.向稀盐酸中逐渐加入试剂X后,溶液的pH变化如图所示。试剂X是下列物质中的()
A. NaOH B. H2O C. Mg D. CaCO3
2.无色溶液X是下列四种物质中的一种。将其分成等量的三份,向其中分别加入少量AgNO3溶液、CuO固体、NaOH溶液,产生的现象如下表。则物质X是下列选项中的()
A. NaCl溶液 B. Ca(OH)2溶液 C. 稀硝酸 D. 稀盐酸
3.下列四个图象能正确反映对应变化关系的是()
A. 盐酸中加水
B. 向一定质量饱和石灰水中加入氧化钙
C. 用等质量、等质量分数的H2O2溶液来制取O2
D. 将过量的、等质量的镁和锌分别加入到等质量、等质量分数的稀硫酸中
4.实验室有一瓶久置的氧化钙,因吸收空气中的水蒸气和二氧化碳而变质,经测定该固体中氢元素的质量分数为0.4%,碳元素的质量分数为2.4%.则未变质的氧化钙占变质前纯氧化钙的质量分数约为()
A. 65.2% B. 34.8% C. 74.4% D. 22.4%
5.向一定质量的稀盐酸中加入一段镁条,测定溶液反应的不同数据随时间的变化,并绘制图象,请分析其中图象绘制明显错误的是()
A. B. C. D.
6.下列图像与对应的表述一致的是()
A. 加热氯酸钾和二氧化锰的混合物
B. 向一定量硫酸铜溶液中不断加入锌粉
C. 向一定量的稀盐酸和氯化钙的混合溶液中不断加入碳酸钠溶液至过量
D. 向稀硫酸中不断的加水
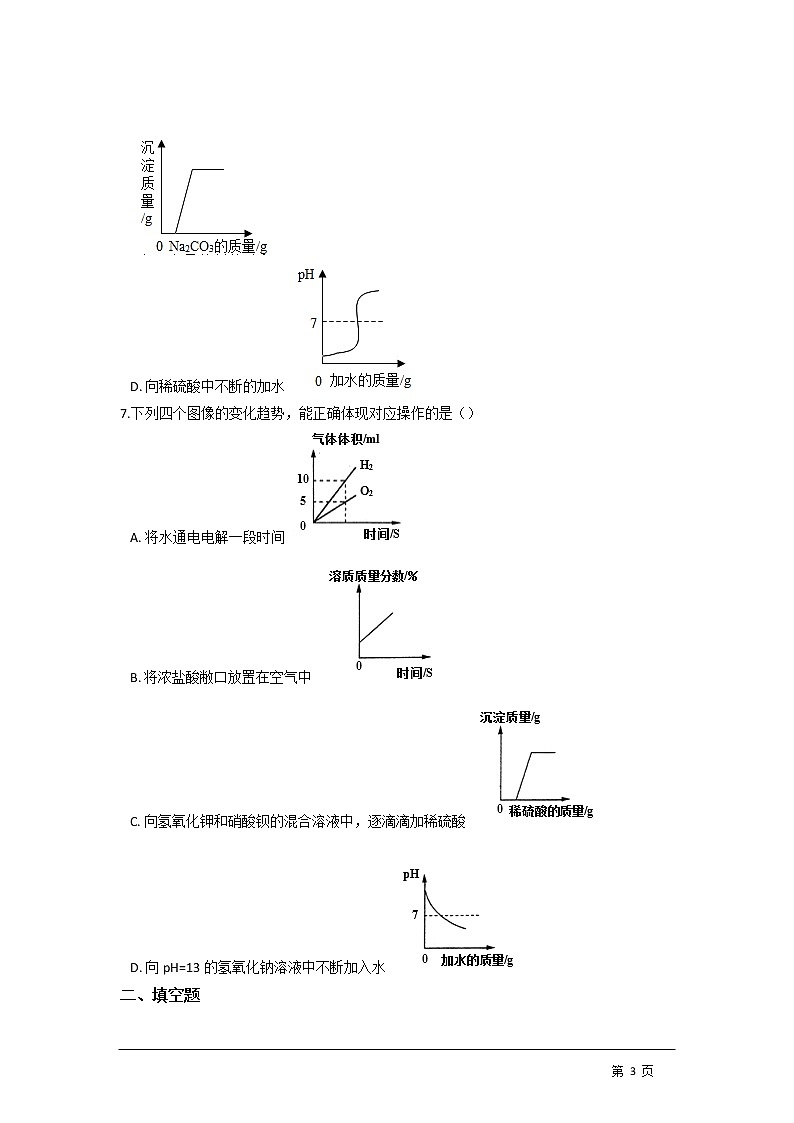
7.下列四个图像的变化趋势,能正确体现对应操作的是()
A. 将水通电电解一段时间
B. 将浓盐酸敝口放置在空气中
C. 向氢氧化钾和硝酸钡的混合溶液中,逐滴滴加稀硫酸
D. 向pH=13的氢氧化钠溶液中不断加入水
二、填空题
1.A~E均为初中化学常见的物质,它们之间的关系如图所示(部分物质已经略去)。已知A是目前世界上年产量最高的金属;B是胃酸的主要成分;C中金属元素的质量分数为40%, 其水溶液呈蓝色,常用来配制农药波尔多液;D属于碱;E属于盐。则C的化学式为________;A与B反应的化学方程式为________;E转化为D的化学方程式为________。
2.除去NaCl溶液中CaCl2、MgCl2、Na2SO4杂质的操作顺序为:①加过量的NaOH溶液;②加过量的BaCl2溶液;③加过量的Na2CO3溶液;④过滤;⑤加适量的盐酸。
(1)为什么加过量的NaOH溶液后,镁离子被彻底除去而钙离子不能被彻底除去。________。
(2)加盐酸时有气体生成的化学反应方程式为________。
3.如图是甲、乙两种物质的溶解度曲线。________(填“升高”或“降低”)温度,能将甲的饱和溶液变为不饱和溶液;t1℃时,若将65g乙的饱和溶液稀释成15%,需加水的质量为________g;t2℃时,配制相等质量的甲、乙两种物质的饱和溶液,所需水的质量关系是甲________(填“>”、“<”或“=”)乙。
4.“宏观一微观一符号”三重表征是化学独特的表示物质及其变化的方式。请结合图示回答问题:
图1 图2
(1)图1中,“Fe”表示多种信息,如表示铁元素、铁单质,还能表示________。
(2)从微粒的角度说明图2反应的实质是________。
(3)下图为某反应的微观示意如图:
该反应的化学方程式为: ________
5.以下是我们所学的部分化学物质,它们与生产、生活息息相关。
①自然界中最坚硬的物质名称是________;干冰的化学式是________;碳 60 的摩尔质量为________;二氧化碳灭火是利用了二氧化碳________的性质。
②写出图中 I 的化学方程式________。氧化钙俗称为________。
II 的转化过程中________(选填“放出”或“吸收”)热量。
属于物理变化的过程是________(选填“I”、“II”、“III”或“IV”)。
三、计算题
1.某工厂化验室用10%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸(该产品中其它物质不与NaOH反应),消耗氢氧化钠溶液的质量与反应过程中溶液的pH值关系如图所示。
(1)图中A点表示的意义是________。
(2)A点消耗氢氧化钠溶液的溶质的质量为________g。
(3)求石油产品中残余硫酸的质量(写出计算过程)。
2.我校实践活动小组的同学,对某一工厂排放的废水进行检测,发现主要污染物是氢氧化钠,为了测定废水中氢氧化钠的含量,他们取 160g 废水于烧杯中,逐渐加入溶 质质量分数为 5%的稀盐酸至 146g 时恰好完全反应(废水中的其他成分不与盐酸反应)。求:
(1)所用稀盐酸中溶质的质量为________g。
(2)废水中氢氧化钠溶质的质量分数________(写计算过程)。
3.将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是________℃
(2)计算稀盐酸中溶质的质量分数(精确到0.1%)
四、实验探究题
1.对比实验是化学研究中经常采用的方法。化学兴趣小组的同学在研究CO2通入NaOH溶液是否发生了反应,设计了下列二组实验。请和化学兴趣小组的同学一起探究并回答问题:
(设计与实验)
(1)(探究与结论)
实验I中步骤一看不到明显现象,步骤二产生的现象是________。
(2)实验Ⅱ中步骤二看到有白色沉淀析出,则发生反应的化学方程式是________。
(3)在实验Ⅱ的步骤一中CO2和NaOH溶液一定发生了化学反应,但却看不到明显的现象,原因是________。
(4)(拓展延伸)现有下列信息:
资料卡片一
20℃NaOH、Na2CO3在水中的溶解度
物质 溶解度(S)/g
NaOH 109
Na2CO3 21.8
资料卡片二
20℃NaOH、Na2CO3在乙醇中的溶解度
物质 溶解度(S)/g
NaOH 17.3
Na2CO3 <0.01
请你和化学兴趣小组的同学一起利用以上料信息再设计实验Ⅲ,证明CO2确实与NaOH发生了化学反应。
实验Ⅲ的操作为:________。
看到的现象是________。
39.学习了酸与碱的化学性质后,兴趣小组的同学利用实验室的一瓶氢氧化钠溶液进行如下探究。
探究Ⅰ(提出问题)该氢氧化钠溶液是否已经变质?
氢氧化钠露置于空气中变质的反应方程式________,________(填“是”或“不是”)复分解反应。
(实验探究)
(实验结论)氢氧化钠溶液没有变质。
探究Ⅱ(提出问题)中和反应过程中是否有能量变化?
(实验探究)
甲同学:取适量该氢氧化钠溶液,滴加1~2滴酚酞,在溶液中插入温度计,再逐滴加入稀盐酸,边滴加边搅拌,测得温度变化情况如图所示。
①写出该反应的化学方程式________,实验中搅拌的目的是________;
②从图像可知,中和反应是________过程;请解释BC段的成因________。
乙同学:取少量氢氧化钠固体与稀盐酸反应进行实验,得出了同样的结论。小华同学认为,乙同学的结论不可信,你认为她的理由是________。
2.观察是学习化学的重要方法。研究小组进行如下实验,发现均有红棕色二氧化氮气体产生。
查阅资料:4HNO3 O2↑+4NO2↑+2H2O;C+4HNO3(浓) CO2↑+4NO2↑+2H2O
(1)浓HNO3(浓硝酸)易挥发出HNO3 , 浓硝酸的挥发性是浓硝酸的________(填“物理”或“化学”)性质。
(2)(实验1)中所用碎玻璃与浓硝酸不发生化学反应,灼热的碎玻璃在实验中起到的作用是________。
(3)(实验2)中有红棕色气体产生,并不能证明(实验2)中木炭与浓硝酸发生了反应,理由是:________。
(4)(实验3)发现生成的气体产物中检测出二氧化碳(体积分数大于0.03%),但也不能证明(实验3)中木炭与浓硝酸发生了反应,请用化学方程式说明理由:________
答案解析部分
一、单选题
1.【答案】 A
2.【答案】 D
3.【答案】 D
4.【答案】 C
5.【答案】 A
6.【答案】 C
7.【答案】 A
二、填空题
1.【答案】 CuSO4;Fe+2HCl=FeCl2+H2↑;Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
2.【答案】 (1)Mg(OH)2难溶于水,而Ca(OH)2微溶于水
(2)Na2CO3+2HCl=2NaCl+CO2↑+H2O
3.【答案】 升高;35;<
4.【答案】 (1)铁原子
(2)OH-和H+反应生成水(OH-+H+=H2O)
(3)O2+2SO2 2SO3
5.【答案】 金刚石;CO2;720g/ml;不可燃、不助燃、密度比空气大;CaCO3 CaO+CO2↑;生石灰;放出;III
三、计算题
1.【答案】 (1)酸碱恰好中和
(2)4
(3)4.9g
2.【答案】(1)7.3
(2)设160g的氢氧化钠溶液中溶质的质量为x
x=8.0g
废水中氢氧化钠溶质的质量分数= ×100%=5%。
答:所用稀盐酸的质量为7.3g,废水中氢氧化钠溶质的质量分数为5%
3.【答案】(1)20.9
(2)解:酸碱恰好完全反应时,溶液的pH等于7,此时盐酸溶液的质量为10g。氢氧化钠的质量=10.0g×4.0%=0.4g
则设盐酸溶液的溶质的质量分数为x
=
x=3.7%
四、实验探究题
1.【答案】 (1)有气泡冒出
(2)CaCl2+Na2CO3=CaCO3↓+2NaCl
(3)CO2与NaOH溶液反应生成易溶于水的Na2CO3
(4)将二氧化碳通入盛有一定体积的饱和NaOH乙醇溶液试管中;有白色沉淀产生
2.【答案】 2NaOH+CO2═Na2CO3+H2O;不是;稀盐酸;NaOH+HCl═NaCl+H2O;使稀盐酸和氢氧化钠溶液充分反应;放热;完全反应后不再放热,逐渐冷却;氢氧化钠固体溶于水放热
3.【答案】 (1)物理
(2)加热
(3)红热的木炭可以为浓硝酸直接分解提供热量
(4)C+O2 CO2
AgNO3溶液
CuO固体
NaOH溶液
现象
白色沉淀
溶解,溶液变蓝
无明显现象
反应时间(s)
0
10
20
30
40
50
60
溶液温度(℃)
20.5
20.6
20.7
20.8
20.9
20.8
20.7
实验
序号
实验步骤一
实验步骤二
实验
序号
实验步骤一
实验步骤二
实验I
实验II
实验操作
实验现象
实验结论
方法1:取样,滴加足量的________,
无气体产生
氢氧化钠溶液没有变质
方法2:取样,滴加氢氧化钙溶液
HCl+
NaOH=NaCl+H2O
36.5
40
7.3g
x
NaOH+
HCl=NaCl+H2O
40
36.5
0.4g
20.0gx
2022年度最新人教版九年级化学下册第十单元 酸和碱期末试卷必考题: 这是一份2022年度最新人教版九年级化学下册第十单元 酸和碱期末试卷必考题,共11页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
2022年度最新人教版九年级化学下册第十单元 酸和碱期末模拟试卷【必考题】: 这是一份2022年度最新人教版九年级化学下册第十单元 酸和碱期末模拟试卷【必考题】,共11页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。
2022学年最新人教版九年级化学下册第十单元 酸和碱期末复习试卷必考题: 这是一份2022学年最新人教版九年级化学下册第十单元 酸和碱期末复习试卷必考题,共16页。试卷主要包含了单选题,填空题,计算题,实验探究等内容,欢迎下载使用。













