





初中化学北京课改版(2024)九年级下册(2024)第二节 溶解的限度教学演示ppt课件
展开
这是一份初中化学北京课改版(2024)九年级下册(2024)第二节 溶解的限度教学演示ppt课件,共45页。PPT课件主要包含了2溶解的限度,第八章溶液,学习目标,教学重点,教学难点,课程导入,饱和溶液与不饱和溶液,新课探究,实验视频,溶解度等内容,欢迎下载使用。
通过实验探究,建立饱和溶液与不饱和溶液的概念,了解饱和溶液与不饱和溶液相互转化的方法。
了解固体物质溶解度的涵义,会利用溶解性表或溶解度曲线,查阅相关物质的溶解性或溶解度,能依据给定的数据绘制溶解度曲线。
掌握结晶的概念和两种主要结晶方法,了解结晶在工业与生产生活中的应用。
01 饱和溶液与不饱和溶液的判断和相互转化
01 对溶解度概念的理解
02 溶解度的概念和溶解度曲线的绘制与分析
03 结晶的方法和应用
02 运用溶解度曲线解决实际问题
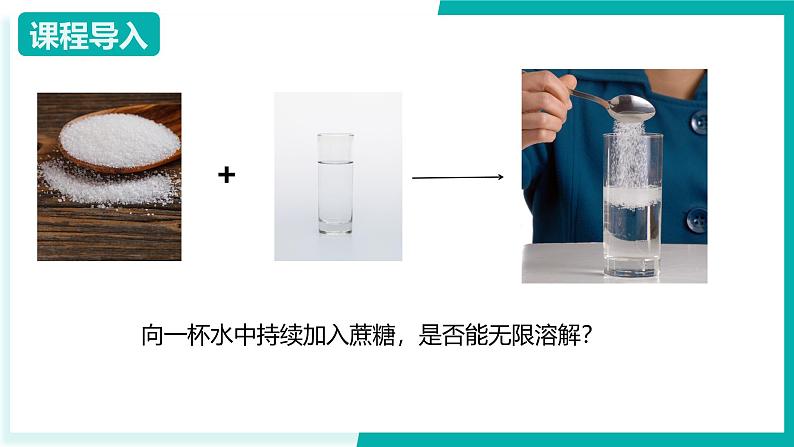
向一杯水中持续加入蔗糖,是否能无限溶解?
一、饱和溶液与不饱和溶液
结论:在一定量的水中,最多溶解NaCl的量是一定的。
①在室温下,向装有 20 mL 蒸馏水的烧杯中加入 5 g 硝酸钾,充分搅拌。②继续加入 5 g 硝酸钾,充分搅拌。③用酒精灯加热烧杯,并搅拌。④继续加入 2 g 硝酸钾,充分搅拌。⑤冷却。⑥向烧杯中继续加入 20 mL 蒸馏水,充分搅拌。
未溶解的硝酸钾逐渐溶解
室温下 20mL 蒸馏水能溶解 5g 硝酸钾
室温下 20mL 蒸馏水不能完全溶解 10g 硝酸钾
升高温度,硝酸钾在水中的溶解能力增强
升温后 20mL 蒸馏水能溶解更多硝酸钾
温度降低,硝酸钾在水中的溶解能力下降
增加溶剂的量,能溶解更多的硝酸钾
探究结论: 硝酸钾在一定量的水中不能无限制地溶解,其溶解量受温度、溶剂的量等因素影响 。
1.以上实验中除烧杯、玻璃棒、酒精灯外,还需要哪些仪器?这些仪器的作用是什么?
托盘天平:称量硝酸钾的质量。量筒:量取一定体积的蒸馏水。药匙:取用硝酸钾固体。胶头滴管:在使用量筒量取蒸馏水时,用于准确量取所需体积,添加少量蒸馏水至刻度线 。
2.影响硝酸钾溶解的因素有哪些?这些因素是如何影响的?
影响硝酸钾溶解的因素有温度、溶剂的量
一定温度下,大部分固体物质不能无限制地溶解在一定量水中。在一定温度下,一定量溶剂中所加溶质不能再继续溶解的溶液叫作这种溶质的饱和溶液;如果溶质还能继续溶解,就叫作这种溶质的不饱和溶液。
溶液达到饱和时,溶质仍会继续溶解,同时会有相同质量的溶质从溶液中析出,使得剩余固体的总质量保持不变,观察到的现象是固体不再继续溶解。
溶质为气体时,压强也是影响溶解限度的因素之一。
在一定温度下,一定量溶剂中所加溶质不能再继续溶解的溶液叫作这种溶质的饱和溶液
在饱和溶液与不饱和溶液中,溶质和溶剂的量又有什么关系呢?
下表为氯化钠溶解过程的相关数据,观察数据并进行数据分析,将分析结果填入表格
观察以上表格,思考下列问题
1. 相同温度下,氯化钠饱和溶液与不饱和溶液中的溶质与溶剂质量比有什么关系?
在一定温度下的氯化钠饱和溶液中,溶质与溶剂的质量比是固定值,且大于不饱和溶液中溶质与溶剂的质量比。
2. 不同温度的氯化钠饱和溶液,溶质与溶剂质量比是否相同?
在不同温度下的氯化钠饱和溶液中,溶质与溶剂的质量比不同,且温度高的质量比大于温度低的质量比。
下表为硝酸钾溶解过程的相关数据,观察数据并进行数据分析,将分析结果填入表格中。
3. 相同温度下,氯化钠饱和溶液与硝酸钾饱和溶液中的溶质与溶剂质量比是否相同?
在相同温度下的氯化钠饱和溶液与硝酸钾饱和溶液中,溶质与溶剂的质量比不同
在一定温度下,在一定量溶剂里溶质的溶解量是有限度的。
可以用在一定温度下,某物质溶解在给定溶剂中达到饱和状态时的溶液组成数据,衡量其在此溶剂中的溶解能力。
在一定温度下,某固体物质在 100 g 溶剂(通常溶剂为水)中达到饱和状态时所溶解的质量。
注意 描述溶解度时要注意以下几点:
2. 100g溶剂里;
3. 溶液为饱和状态;
溶解度既可以作为衡量物质溶解能力的物理量,也可以作为判断某物质的溶液是否达到饱和的定量依据,是物质溶解限度的数值化表示。
20 ℃ 时,氯化钠在水中的溶解度是 36 g
表示:在 20 ℃ 时,100 g 水中最多能溶解 36 g 氯化钠,溶液达到饱和
20 ℃时,在 200 g 水中氯化钠的溶解度就变成 72 g 了,这种说法对吗?
不对。溶解度本质上是一个比值,它反映的是溶质质量与溶剂质量在特定条件下的比例关系。比如 20℃时,200g 水中溶解 72g 氯化钠达到饱和,此时溶质与溶剂质量比为 72÷200 = 0.36,与 100g 水中溶解 36g 氯化钠达到饱和时的溶质溶剂质量比相同。溶解度是由物质本身性质和温度决定的一个固定比值,与实际使用的溶剂和溶质的量无关,不能因为溶剂的量改变就认为溶解度发生了变化。
如何应用溶解度判断溶液是否饱和?例如,在 20 ℃ 时, 将 30g 氯化钠加入 100g 水中,溶液是否饱和?
1. 明确20℃时氯化钠的溶解度
在 20℃时,100g 水中最多能溶解 36g 氯化钠,此时溶液达到饱和状态。
2. 对比实际加入溶质的量和该温度下溶解度对应的溶质质量
20℃时将 30g 氯化钠加入到 100g 水中。因为 30g < 36g,即实际加入到 100g 水中的氯化钠的质量小于 20℃时 100g 水中所能溶解的氯化钠的最大质量(溶解度对应的溶质质量)。
得出结论:在 20℃时,把 30g 氯化钠加入 100g 水中,溶液还能继续溶解氯化钠,所以该溶液是不饱和溶液。
一般来说,在一定温度下,对于某溶质的溶液,设该温度下溶质的溶解度为 S,实际向100 g 溶剂中加入的溶质质量为 m:若 m=S,则溶液恰好达到饱和状态;若 m>S,则溶液为饱和溶液,且有未溶解的溶质剩余;若 m<S,则溶液为不饱和溶液。
一些物质在不同温度下的溶解度
根据溶解度数值的大小和范围,人们对固体溶解能力进行了定性描述。
溶解度与溶解性的对应关系
1. 准备一张坐标纸(如图所示)。2. 以温度为横坐标,溶解度为纵坐标,利用下表中硝酸钾和氯化钠的数据,找到不同温度下溶解度对应的点,用平滑曲线将这些点连接起来。3. 以小组为单位,观察这两条曲线的特点,并分享交流。
在平面直角坐标系中,以横坐标表示温度,纵坐标表示溶解度,画出物质的溶解度随温度变化的曲线,这种曲线叫作溶解度曲线。
1. KNO3和NaCl的溶解度随温度变化有什么规律?
KNO3的溶解度随温度升高而增大,NaCl的溶解度受温度影响不大。
2. A点对应的溶液状态是?
A点对应KNO3的不饱和溶液,NaCl的饱和溶液。
几种固体物质的溶解度曲线
在该交点所对应的温度下,这几种固体物质在相同溶剂(一般是水)中的溶解度相等。即:在交点对应的温度,在100g水中达到饱和状态时不同溶质所溶解的质量是一样的。
比较两图,你有什么发现?
大多数固体物质的溶解度随温度升高而增大,氢氧化钙的溶解度随温度升高而减小。
1.曲线上任一点:表示某物质在某温度时的溶解度,溶液所处的状态是饱和溶液;2.曲线上方的点:表示某温度下某物质的溶液中溶质有剩余;溶液所处的状态是饱和溶液 ;3.曲线下方的点:表示某温度下某物质溶液中溶质的量不足;溶液所处的状态是不饱和溶液。
溶解度的大小与温度有关。大多数固体物质的溶解度随温度升高而增大如硝酸钾、氯化铵等,有些物质的溶解度受温度影响不大,如氯化钠;也有些固体物质,其溶解度随温度升高而减小,如氢氧化钙。 同种物质在不同种溶剂中的溶解度也不相同。例如,10 ℃ 时,硝酸钾在水中的溶解度为 20.9 g,而在液氨(NH3)中的溶解度为 45.4 g 。
气体在水中的溶解度是指在压强 101 kPa 和一定温度时,气体溶解在1 体积水里达到饱和状态时的气体体积。
20 ℃ 时,氧气的溶解度为 0.031
表示:在压强 101 kPa 和 20 ℃ 时,1 体积水里最多溶解 0.031 体积氧气
温度下降,溶解度增大
为什么天气炎热时,需要向鱼缸中供氧气?
温度升高,气体在水中的溶解度减小
打开碳酸饮料的瓶盖,会观察到大量气泡冒出,为什么?
压强减小,气体在水中的溶解度减小
如何从海水中获得固体盐?类比硝酸钾晶体析出作出说明。
海水在太阳下水分慢慢蒸发,结晶析出NaCl晶体
探究目的: 依据溶解度曲线,探索从溶液中得到固体的方法。
1. 蒸发食盐水。在蒸发皿中注入少量饱和食盐水,加热使水蒸发,并用玻璃棒不断搅拌。2. 冷却热饱和溶液。将热的硝酸钾饱和溶液放入冷水中。
实验现象: 分别析出氯化钠晶体和硝酸钾晶体
为什么可用不同的方法从溶液中得到氯化钠和硝酸钾晶体,这与二者的溶解度曲线有什么联系?
溶质以晶体形式从其饱和溶液中析出的过程,叫作结晶。
蒸发结晶:适合溶解度随温度变化不大的物质(如NaCl)
降温结晶:适合溶解度随温度变化很明显的物质(KNO3)
注意:饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。相同溶质、相同温度:饱和溶液一定比不饱和溶液浓。
从溶液中分离出固体溶质:1. 思路:先分析溶质溶解度随温度的变化特点,若变化不大,用蒸发结晶法;若变化显著且降温溶解度大减,用降温结晶法。2. 方法
蒸发结晶:溶液放蒸发皿加热,用玻璃棒搅拌防飞溅,有较多固体时停热用余热蒸干。
降温结晶:加热制成热饱和溶液,缓慢冷却析晶,过滤分离晶体并洗涤。
人们把海水引到盐田里,在阳光和风的作用下陆续蒸发掉其中的水分后,除去其中的杂质,可以得到固体食盐。
饱和溶液:在一定温度下,一定量溶剂里,不能继续溶解溶质的溶液。
不饱和溶液:在一定温度下,一定量溶剂里,能继续溶解溶质的溶液。
影响因素:温度、溶剂的量。
判断方法:在一定条件下,溶质是否继续溶解。
饱和溶液与不饱和溶液的相互转化
固体的溶解度:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。
溶解度四要素:1. 在一定温度下;2. 100g溶剂里;3. 溶液为饱和状态;4. 溶质的质量。
溶解度曲线的意义:物质的溶解度随温度的升高而增大、减小或者变化不大。
气体的溶解度:在压强 101 kPa 和一定温度时,气体溶解在1 体积水里达到饱和状态时的气体体积。影响因素:温度、压强。
定义:溶质以晶体形式从其饱和溶液中析出的过程。
方法:蒸发结晶、降温结晶。
【检测题1】小红同学为证明某硝酸钾溶液是否达到饱和状态,设计了以下方案。一定能达到目的的是( )A.温度不变,向溶液中加入少量硝酸钾溶液B.温度不变,向溶液中加入少量硝酸钾晶体C.给溶液加热,直至有硝酸钾晶体析出D.给溶液降温,直至有硝酸钾晶体析出
【检测题2】20℃时,氯化钠的溶解度是36g,这表示( )A.20℃时,100g氯化钠饱和溶液中含氯化钠36gB.20℃时,100g水中溶解36g氯化钠,溶液达到饱和状态C.100g水中最多溶解36g氯化钠D.20℃时,氯化钠在水中溶解36g,溶液达到饱和状态
【检测题3】如图是甲、乙两种物质的溶解度曲线,下列叙述正确的是( )A.20℃时,甲的溶解度大于乙的溶解度B.40℃时,甲、乙两种物质的溶解度相等C.采用降温的方法可以将乙的不饱和溶液转化为饱和溶液D.60℃时,在100g水中加入100g甲,充分溶解后溶液质量为200g
【检测题4】使接近饱和的硝酸钾溶液变为饱和溶液的三种方 法分别是 、 、 。
【检测题5】甲、乙、丙三种固体物质的溶解度曲线如右图所示。回答下列问题:(1)a3℃时,三种物质的溶解度由大到小的顺序是 。
【检测题5】甲、乙、丙三种固体物质的溶解度曲线如右图所示。回答下列问题:(2)a2℃时, 和 的溶解度大小相等;(3)三种物质中, 的溶解度受温度的影响最大, 的溶解度受温度的影响最小, 的溶解度随温度的升高而减小。
相关课件
这是一份初中化学北京课改版(2024)九年级下册(2024)第一节 物质的溶解课文课件ppt,共37页。PPT课件主要包含了学习目标,教学重点,教学难点,课程导入,物质的溶解形成溶液,新课探究,物质溶解中的能量变化,课堂小结,物质的溶解,课堂检测等内容,欢迎下载使用。
这是一份化学北京课改版(2024)第二节 金属的性质图片课件ppt,共57页。PPT课件主要包含了学习目标,教学重点,教学难点,课程导入,金属的化学性质,金属的物理性质,新课探究,熔点最高的金属,硬度最高的金属,金属的物理性质差异性等内容,欢迎下载使用。
这是一份北京课改版(2024)九年级下册(2024)第一节 常见的材料课堂教学课件ppt,共34页。PPT课件主要包含了学习目标,教学重点,教学难点,课程导入,有机合成材料,初步认识材料,新课探究,金属材料,素材拓展,学科融合等内容,欢迎下载使用。










