
人教版 (2019)选择性必修2第二节 原子结构与元素的性质说课课件ppt
展开
这是一份人教版 (2019)选择性必修2第二节 原子结构与元素的性质说课课件ppt,共40页。PPT课件主要包含了影响原子半径的因素,原子半径最大,原子半径最小,金属性最强,非金属性最强,Beg,Be+g,Be2+g,Be3+g,M2O3等内容,欢迎下载使用。
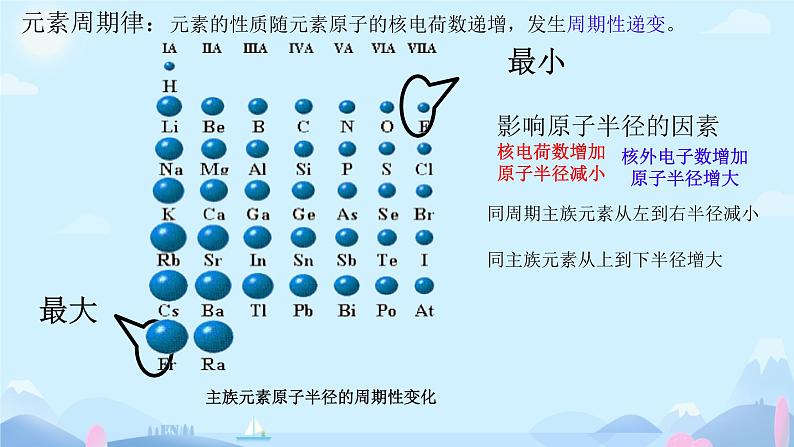
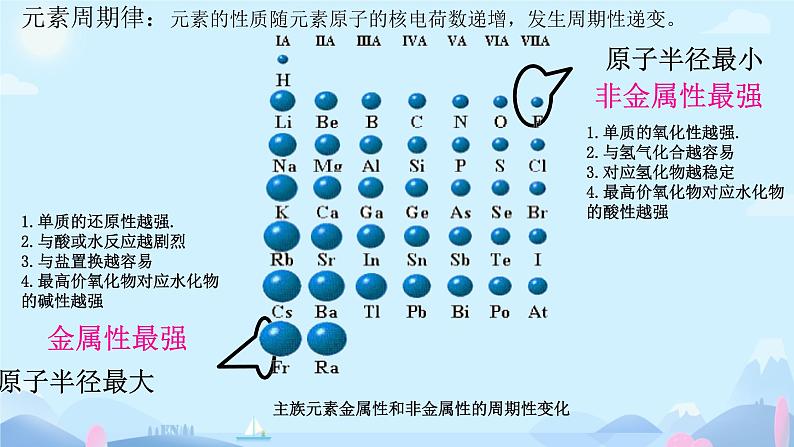
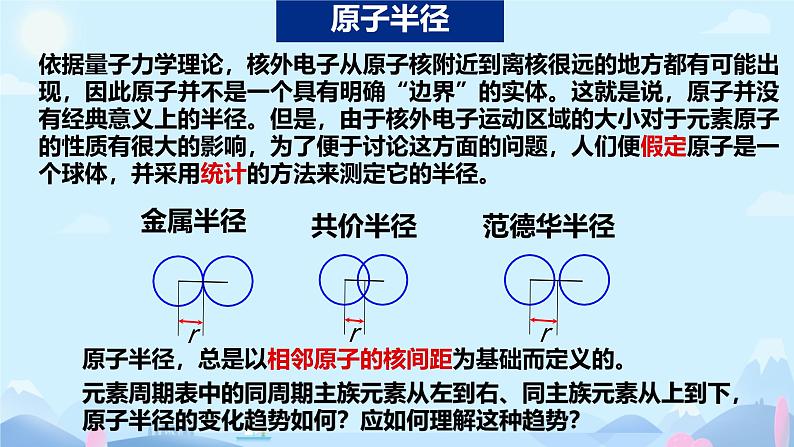
元素周期律:元素的性质随元素原子的核电荷数递增,发生周期性递变。
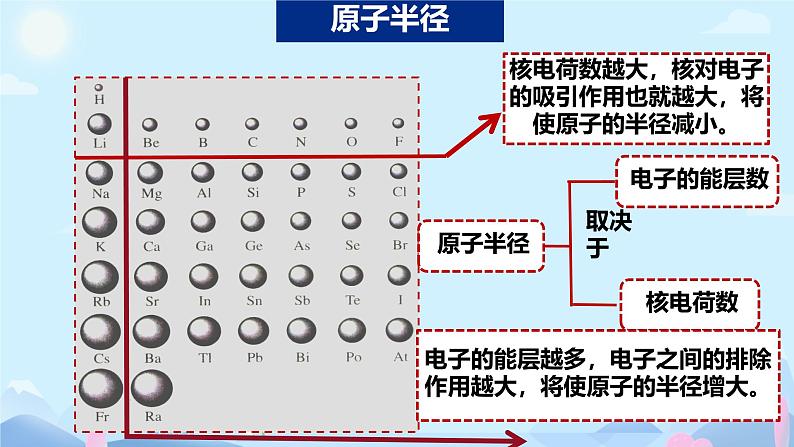
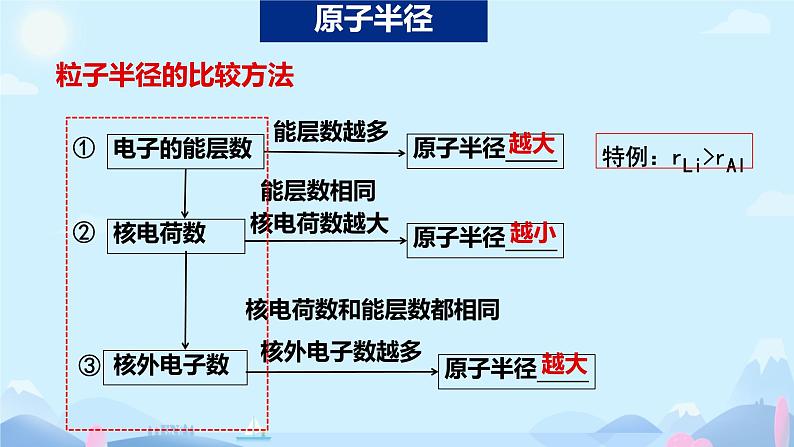
核电荷数增加原子半径减小
核外电子数增加 原子半径增大
同周期主族元素从左到右半径减小
同主族元素从上到下半径增大
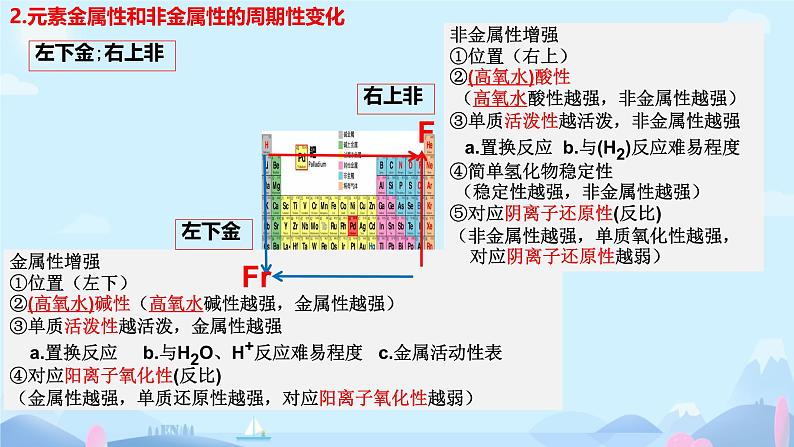
主族元素金属性和非金属性的周期性变化
1.单质的氧化性越强.2.与氢气化合越容易3.对应氢化物越稳定4.最高价氧化物对应水化物 的酸性越强
1.单质的还原性越强.2.与酸或水反应越剧烈3.与盐置换越容易4.最高价氧化物对应水化物 的碱性越强
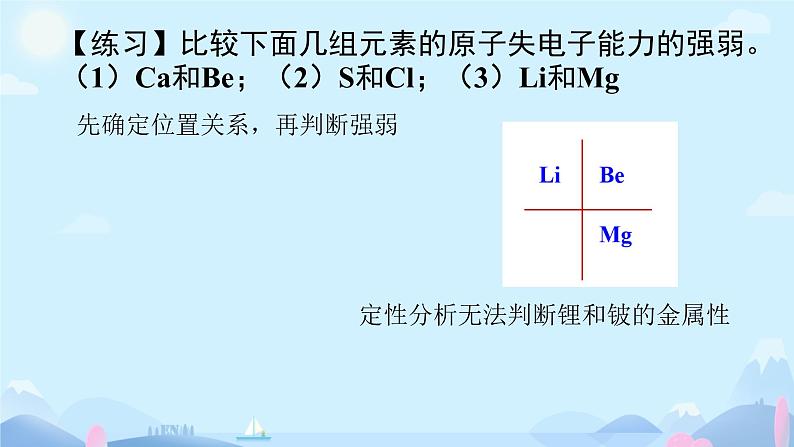
【练习】比较下面几组元素的原子失电子能力的强弱。(1)Ca和Be;(2)S和Cl;(3)Li和Mg
先确定位置关系,再判断强弱
定性分析无法判断锂和铍的金属性
I1<I2<I3……<In
同一元素的不同电离能变化规律:
思考:观察铍原子三级电离能比较示意图,你看到了什么? 由此想到了什么?
因为随着原子的电子的逐个失去,阳离子所带正电荷越大,再要失去一个电子需要克服的电性引力越大,消耗的能量越多。
这些突跃能提供什么信息呢?
确定最稳定的离子的价态
失电子达到稳定状态后,再失电子需要消耗相当多的能量。
练习:结合规律观察Li和Ca元素的电离能数据,分析:为什么Li元素易形成Li+,而不易形成Li2+;Ca元素易形成Ca2+,而不易形成Ca3+?
练习:已知某元素M的各级电离能(In/kJ•m1-1)如下:
试推测该元素的原子最外层有_______个电子主要化合价是_______价,该元素氧化物的化学式可能是_______
不同元素的不同电离能变化规律:
碱金属元素Li、 Na、K、Rb第一电离能变化规律?是什么因素在影响元素的第一电离能大小?
【归纳】原子半径是影响元素第一电离能的因素。 同一主族,从上向下原子半径逐渐增大, 第一电离能在逐渐减小,失电子能力逐渐增强。
【归纳】第二周期,从上向下原子半径逐渐减小, 第一电离能总体有增大趋势。
根据原子半径,推测第二周期元素的第一电离能变化规律。
试从核外电子排布的角度分析B和O的第一电离能反常的原因。
Be失去的是s能级的电子,B失去的是p能级的电子,p能级能量高于s能级的能量,电子更活跃,第一电离能更小。
N的最高能级是半满状态,比O更稳定,更难失电子,第一电离能更大。
核外电子排布的稳定性也是影响元素第一电离能的因素。
其中,B 和 O反常。
(1)同主族元素从上到下第一电离能逐渐减少(2)同周期元素从左到右第一电离能总体呈增大趋势,中间有反常,如ⅡA>ⅢA;ⅤA>ⅥA。 Be B N O Mg Al P S
练习:比较下面几组元素的原子失电子能力的强弱。(1)Ca和Be;(2)S和Cl;(3)Li和Mg
【解析】(1)Ca>Be;(2)S>Cl;(3)Li>Mg
练习:(1)N、O、S元素中第一电离能的大小顺序是 。 (2)Li原子的第一电离能______kJ/ml
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量
相关课件
这是一份鲁科版 (2019)选择性必修1第2节 化学能转化为电能——电池备课ppt课件,共21页。PPT课件主要包含了一次电池,二次电池,回收处理,化学电源,锌锰干电池,1酸性锌锰干电池,MnO2,KOH,2碱性锌锰干电池,铅蓄电池等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质图文ppt课件,文件包含122原子结构与元素的性质第2课时原子半径电离能课件精讲高二化学同步课件人教版2019选择性必修2pptx、122原子结构与元素的性质第2课时原子半径电离能习题精炼高二化学人教版2019选择性必修2含解析docx等2份课件配套教学资源,其中PPT共26页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修2第二节 原子结构与元素的性质优质课课件ppt,共26页。PPT课件主要包含了元素周期律,非金属性逐渐增强,金属性逐渐增强,非金属区,金属区,零族元素,电离能,3电离能的意义,S22p4,电负性等内容,欢迎下载使用。










