

化学九年级下册(2024)课题1 金属材料学案及答案
展开
这是一份化学九年级下册(2024)课题1 金属材料学案及答案,共6页。
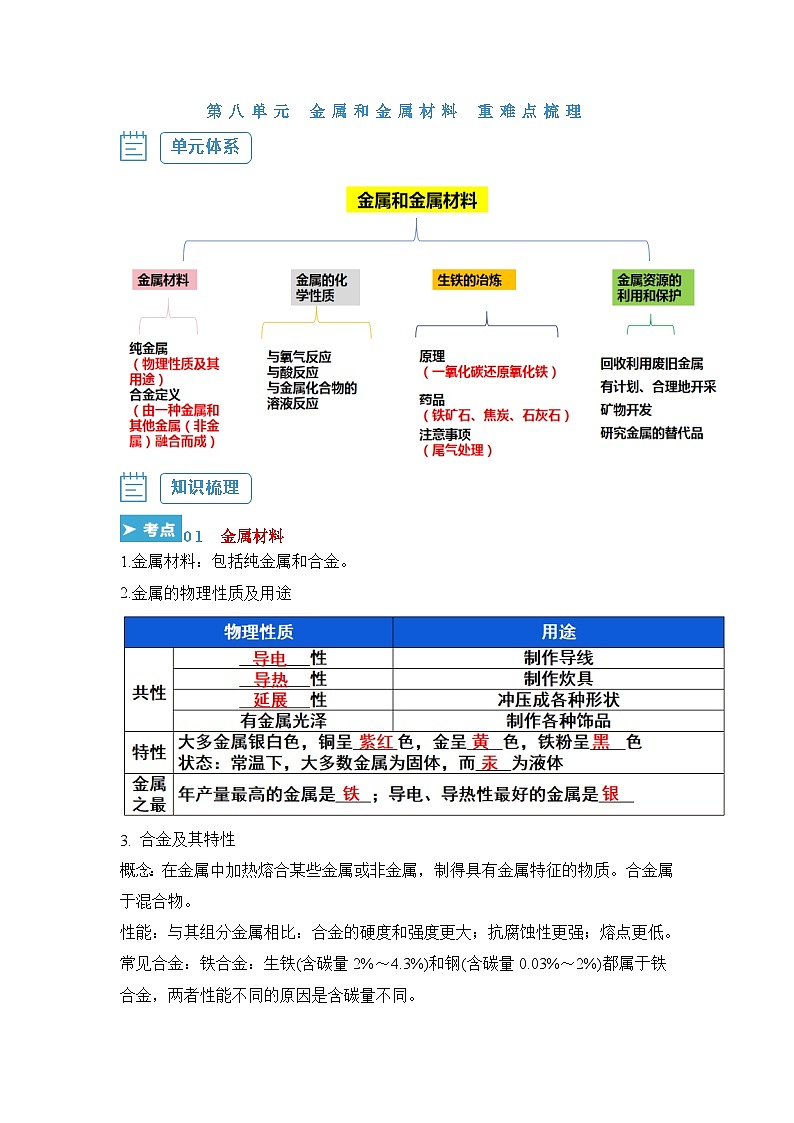
知识梳理
01 金属材料
1.金属材料:包括纯金属和合金。
2.金属的物理性质及用途
合金及其特性
概念:在金属中加热熔合某些金属或非金属,制得具有金属特征的物质。合金属于混合物。
性能:与其组分金属相比:合金的硬度和强度更大;抗腐蚀性更强;熔点更低。
常见合金:铁合金:生铁(含碳量2%~4.3%)和钢(含碳量0.03%~2%)都属于铁合金,两者性能不同的原因是含碳量不同。
黄铜:铜锌合金。
钛合金:熔点高、密度小、可塑性好。由于和人体具有良好的“相容性”,因此可用于制造人造骨。
特别提醒:
(1)合金中至少含有一种金属元素。
(2)比较合金与组成它们的纯金属的最简方法:相互刻画。
(3)金属之最:
①地壳中含量最多的金属元素——铝;
②熔点最高的金属——钨;
③生活中使用最多且目前世界上年产量最高的金属——铁。
02 金属的化学性质
金属与氧气反应
镁、铝等金属在常温下就能与氧气反应。
现象:金属镁、铝常温下在空气中表面逐渐变暗,
化学方程式:2Mg+O2点燃2MgO ;4Al+3O2=2Al2O3 。
铁、铜等在常温下几乎不与氧气反应,但在高温时能与氧气反应。如铜在氧气中加热时会出现红色金属变为黑色固体的现象,化学方程式:2Cu + O2加热2CuO。
金等在高温时也不与氧气反应。
2.金属与稀盐酸、稀硫酸反应
根据金属活动性顺序,位于氢前面的金属能置换出盐酸、稀硫酸中的氢,且金属活动性越强,反应速率越快。位于氢后面的金属不能与盐酸、稀硫酸反应。
3.金属与金属化合物的溶液反应
在金属活动性顺序里:位于前面的金属能把位于后面的金属从它们的化合物的溶液里置换出来,且越靠后的金属越容易被其他活泼金属从其盐溶液中置换出来(K、Ca、Na除外!)。
置换反应
(1)概念:由一种单质与一种化合物反应,生成另一种化合物和另一种单质的反应,叫做置换反应。
(2)特点:“单换单”。
(3)通式:A+BC→B+AC
(4)判断置换反应能否发生要依据金属活动性顺序。
金属活动性顺序的应用
比较不同金属的活动性强弱:在金属活动性顺序里:金属的位置越靠前,它的活动性就越强。
(2)判断某金属是否能与酸反应以及反应快慢。在金属活动性顺序里:位于氢前面的金属能置换出盐酸、稀硫酸中的氢,且金属活动性越强,反应速率越快。
03 金属矿物和冶炼
几种金属矿物
(1)金属来自地壳中天然存在的矿物。主要有两种形态:
①单质形态:少数化学性质很不活泼的金属,以单质形态存在,如金、铂等。
②化合物形态:绝大多数金属都是以化合物形态存在于矿物之中,如赤铁矿、钛铁矿等。
(2)金属在地壳中的含量:地壳中所占的质量分数最高的金属是铝,其次是铁。
2.铁的冶炼
①原理:在高温条件下,利用炉内反应生成的一氧化碳把铁从铁矿石中还原出来。
3.金属资源保护
(1)铁生锈的条件是:铁与O2、水接触(铁锈的主要成分:Fe2O3·xH2O)
(铜生铜绿的条件:铜与O2、水、CO2接触,铜绿的化学式:Cu2(OH)2CO3)
(2)防止铁制品生锈的措施:
①保持铁制品表面的清洁、干燥
②表面涂保护膜:如涂油、刷漆、电镀、烤蓝等
③加入其他金属,改变其组成
(3)铁与铝的生锈对比
①铁锈很疏松,不能阻碍里层的铁继续与氧气、水蒸气反应,因此铁制品可以全部被锈蚀,因而铁锈应及时除去。
②铝与氧气反应生成致密的氧化铝薄膜,从而阻止铝进一步氧化,因此,铝具有很好的抗腐蚀性能。
4.保护金属资源的途径
①防止金属腐蚀;②回收利用废旧金属;③合理开采矿物;④寻找金属的代用 。
意义:节约金属资源,减少环境污染
04 常见题型
1.金属与酸反应生成氢气问题的分析方法
(1)等质氢图
两种金属分别与酸反应,产生的氢气质量相同,此图反映两种情况:
①酸不足,金属过量,产生的氢气质量由酸的质量决定。
②酸足量,投放的两种金属分别与酸反应产生氢气的质量恰好相同,如6.5g锌和5.6g铁分别投入足量的盐酸中,反应产生的氢气质量相同。
(2)等质等价金属图
如等质量的镁、铁、锌分别与足量的酸反应,生成的金属离子都带2个单位的正电荷,产生氢气的速率和质量不同。此图反映出:
①金属越活泼,图示中反应物的线越陡,如Mg线比Zn 线陡、Zn 线比Fe线陡,说明金属活动性Mg> Zn>Fe。
②金属的相对原子质量越小,等质量时与足量酸反应产生的氢气越多,曲线的拐点越高,因此,相对原子质量Zn>Fe>Mg。
可简单概括为:越陡越活,越高越小。
(3)等质不等价金属图
如等质量的铝、镁、锌分别与足量酸反应,生成的化合物中金属元素的化合价分别为+3、+2、+2价,此图反映出等质不等价金属与酸反应不仅产生氢气的速率不同,而且产生氢气的质量与金属元素化合价有关。可用下式计算氢气质量:
m(H2)=m(金属)×金属元素的化合价
相对原子质量
2.金属与与混合盐溶液的反应后的溶液和滤渣成分分析
如将铁粉加入到硝酸铜和硝酸银的混合溶液中。
(1)将题目中涉及的金属,按照金属的活动性由强到弱的顺序排列:如Fe、Cu、Ag。
(2)根据金属活动性由弱到强依次加入盐溶液中的金属,其顺序为Ag、Cu、Fe。
(3)根据加入金属的量分析,如下表:
3.验证金属活动性强弱的实验设计方法
(1)如何验证Fe、Cu、Ag三种金属的活动性顺序
方案一:Fe、CuSO4、Ag Fe+CuSO4=Cu+FeSO4 Ag和CuSO4不反应
方案二:FeSO4、Cu、AgNO3 Cu+AgNO3=Cu(NO3)2+2Ag Cu和FeSO4不反应
总结:
两金夹一盐:活动性最强和最弱的金属的单质与活动性居中金属的盐溶液。
两盐夹一金:活动性最强和最弱的金属的盐溶液与活动性居中的金属的单质。
几种氢前金属比较:
放入同种酸中反应比较剧烈程度。反应越剧烈的金属活动性越强。
相关学案
这是一份初中化学物质的除杂、鉴别知识清单,共7页。学案主要包含了除杂方法,除杂清单,鉴定的常见方法等内容,欢迎下载使用。
这是一份初中化学人教版九年级下册课题 1 金属材料优质导学案,共6页。学案主要包含了实验现象,实验结论,注意事项等内容,欢迎下载使用。
这是一份初中化学人教版九年级下册课题 1 金属材料精品学案及答案,共6页。学案主要包含了实验现象,实验结论,注意事项等内容,欢迎下载使用。










