







所属成套资源:2025年高考化学大二轮专题复习课件+讲义+专练
专题三 主观题突破3 化学键、杂化方式与空间结构 分子结构与性质--2025年高考化学大二轮专题复习课件+讲义+专练
展开
这是一份专题三 主观题突破3 化学键、杂化方式与空间结构 分子结构与性质--2025年高考化学大二轮专题复习课件+讲义+专练,文件包含专题三主观题突破3化学键杂化方式与空间结构分子结构与性质--2025年高考化学大二轮专题课件pptx、专题三主观题突破3化学键杂化方式与空间结构分子结构与性质--2025年高考化学大二轮专题复习教师版docx、专题三主观题突破3化学键杂化方式与空间结构分子结构与性质--2025年高考化学大二轮专题复习学生版docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
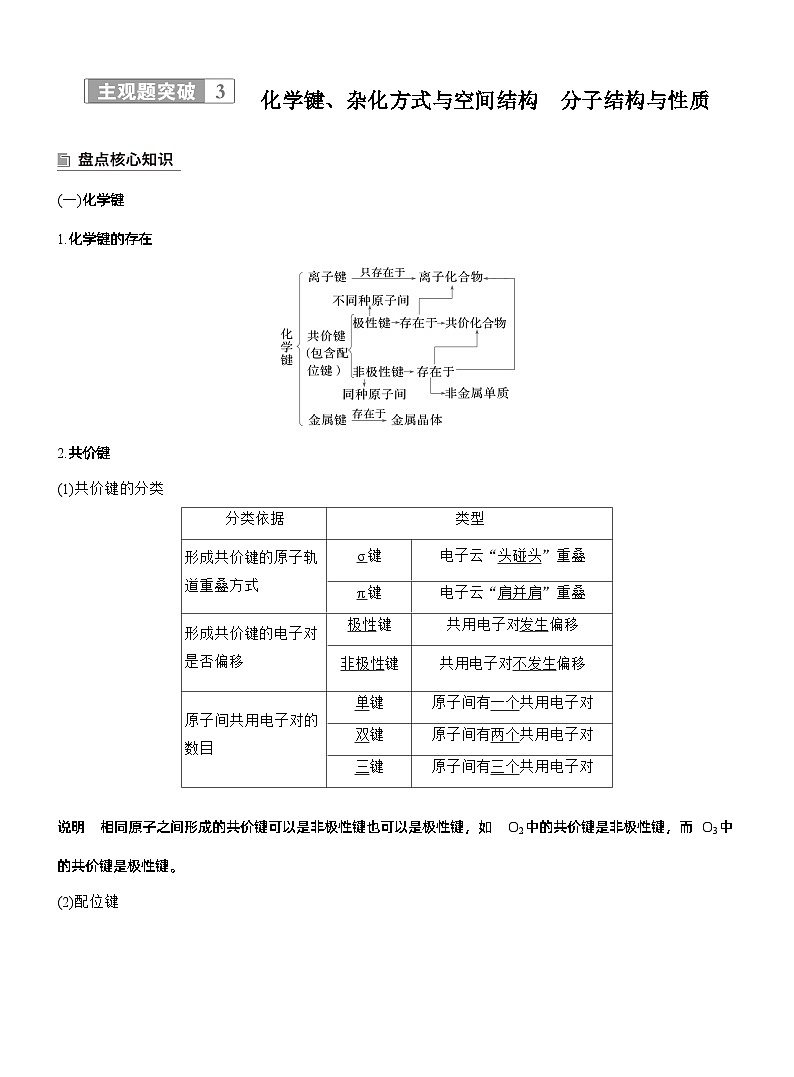
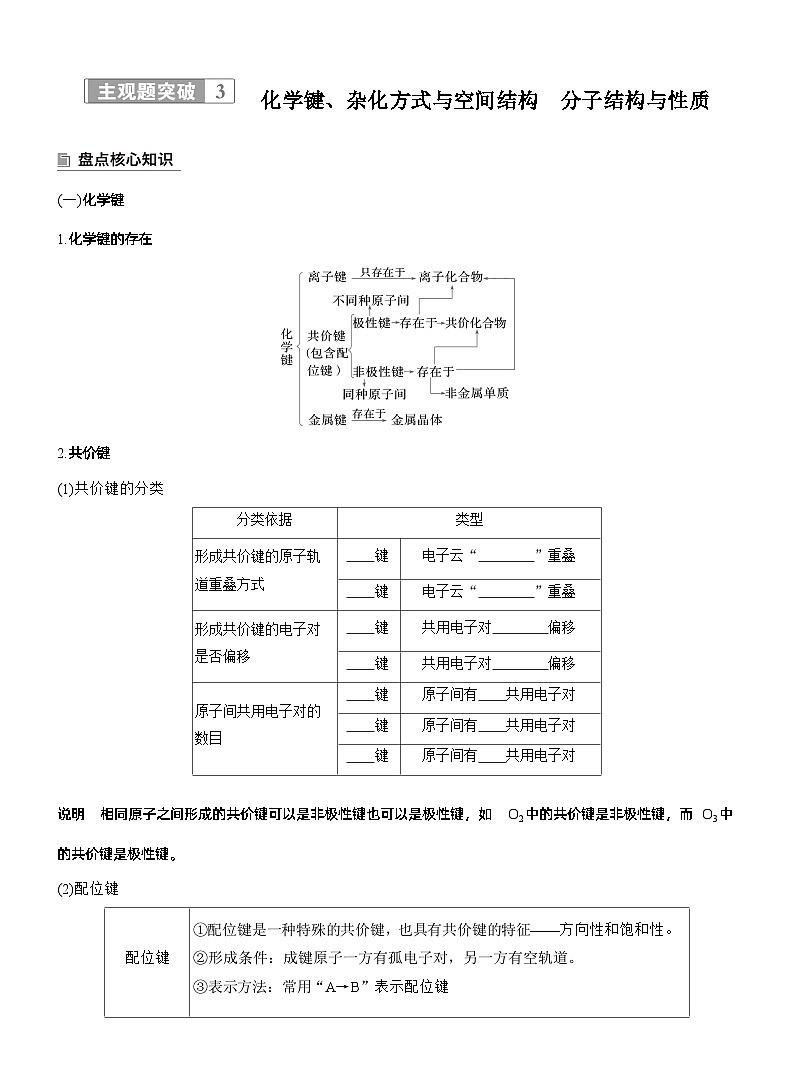
(一)化学键1.化学键的存在
2.共价键(1)共价键的分类
说明 相同原子之间形成的共价键可以是非极性键也可以是极性键,如O2中的共价键是非极性键,而O3中的共价键是极性键。
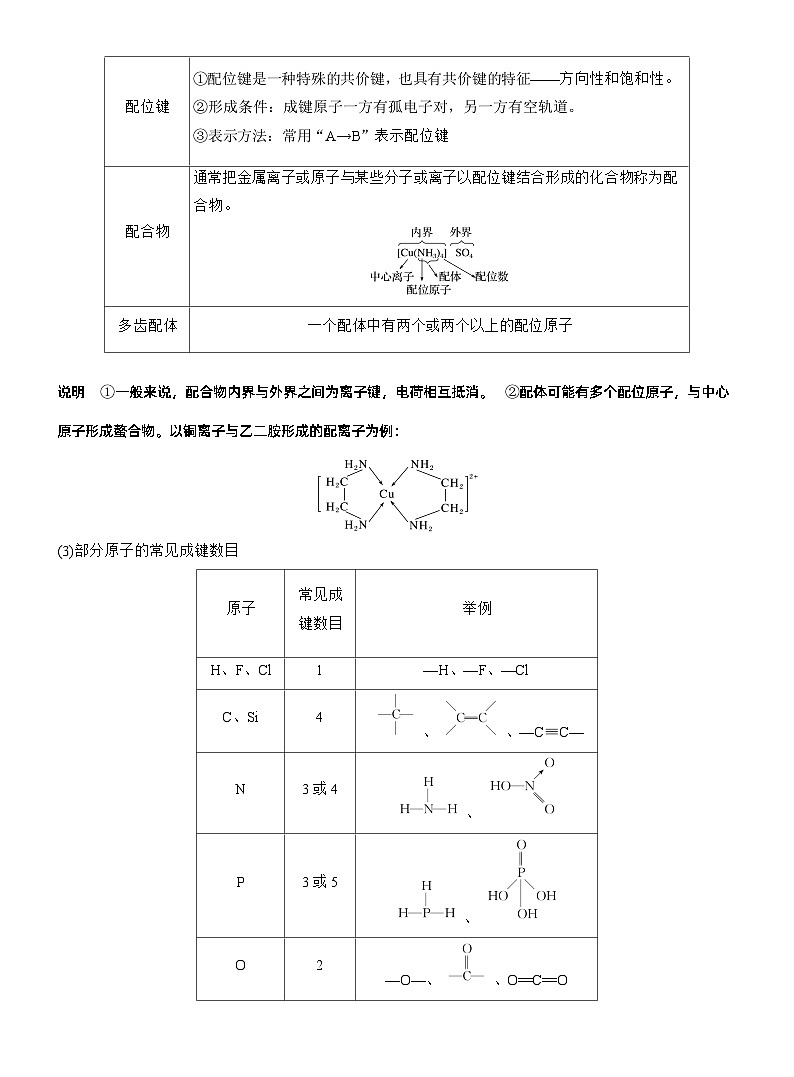
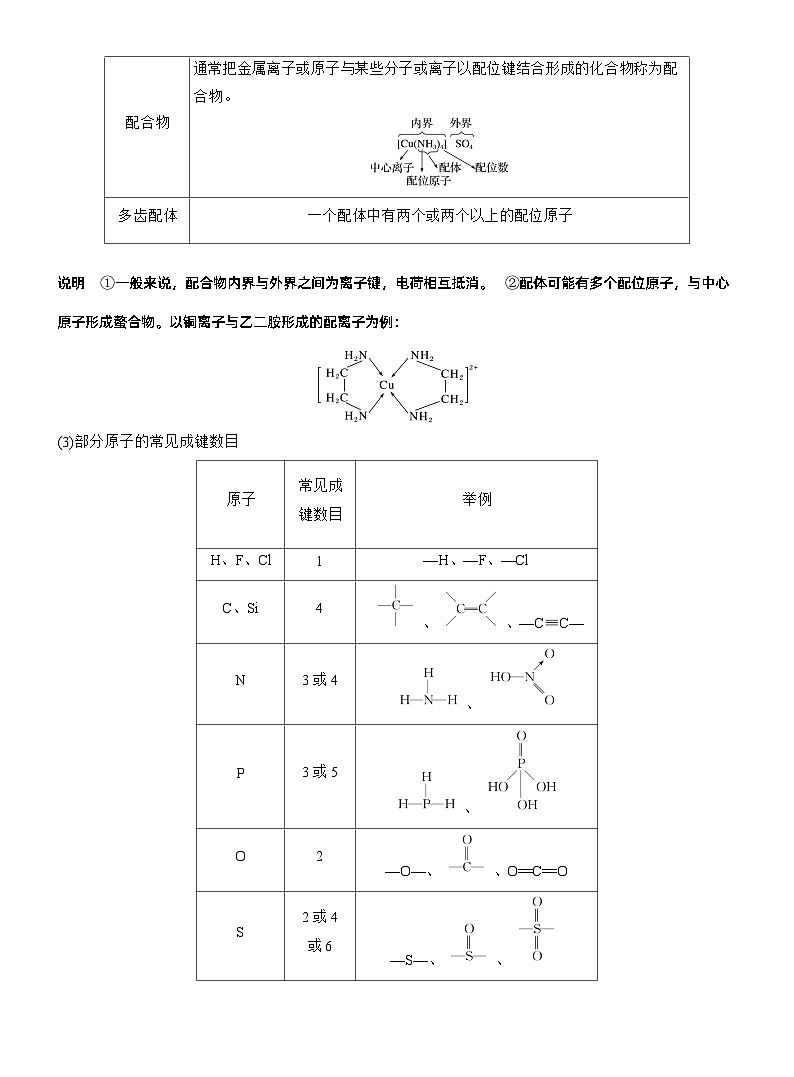
说明 ①一般来说,配合物内界与外界之间为离子键,电荷相互抵消。②配体可能有多个配位原子,与中心原子形成螯合物。以铜离子与乙二胺形成的配离子为例:
(3)部分原子的常见成键数目
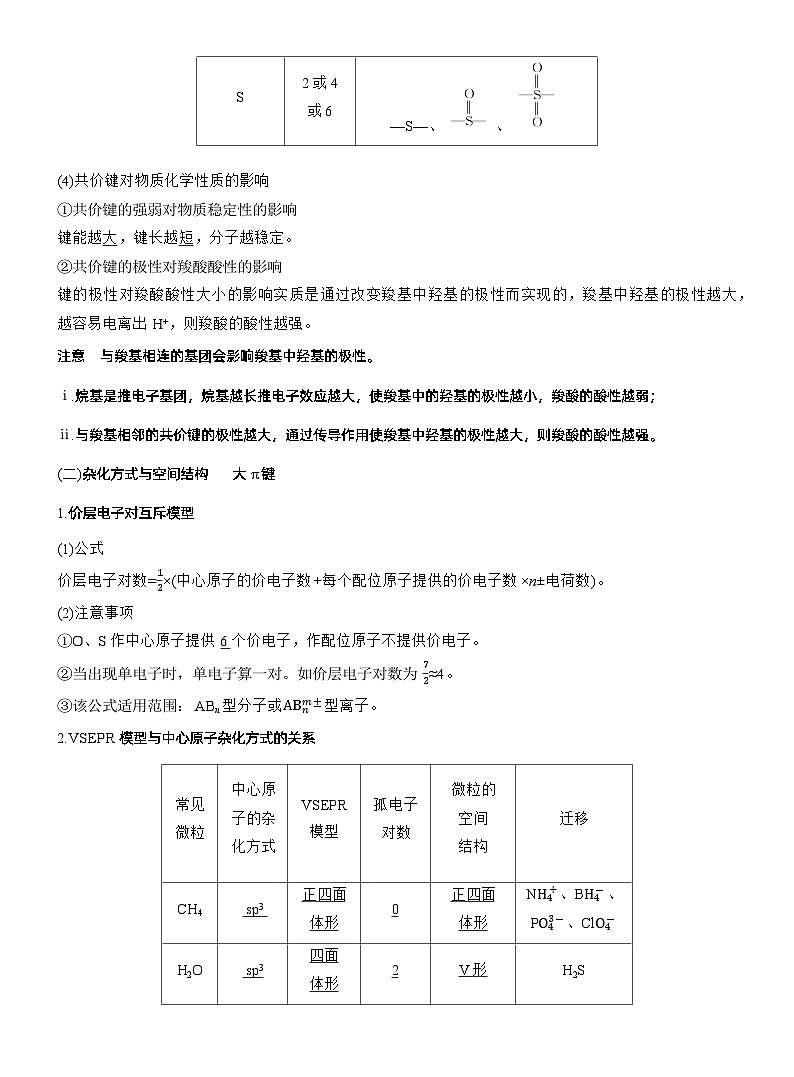
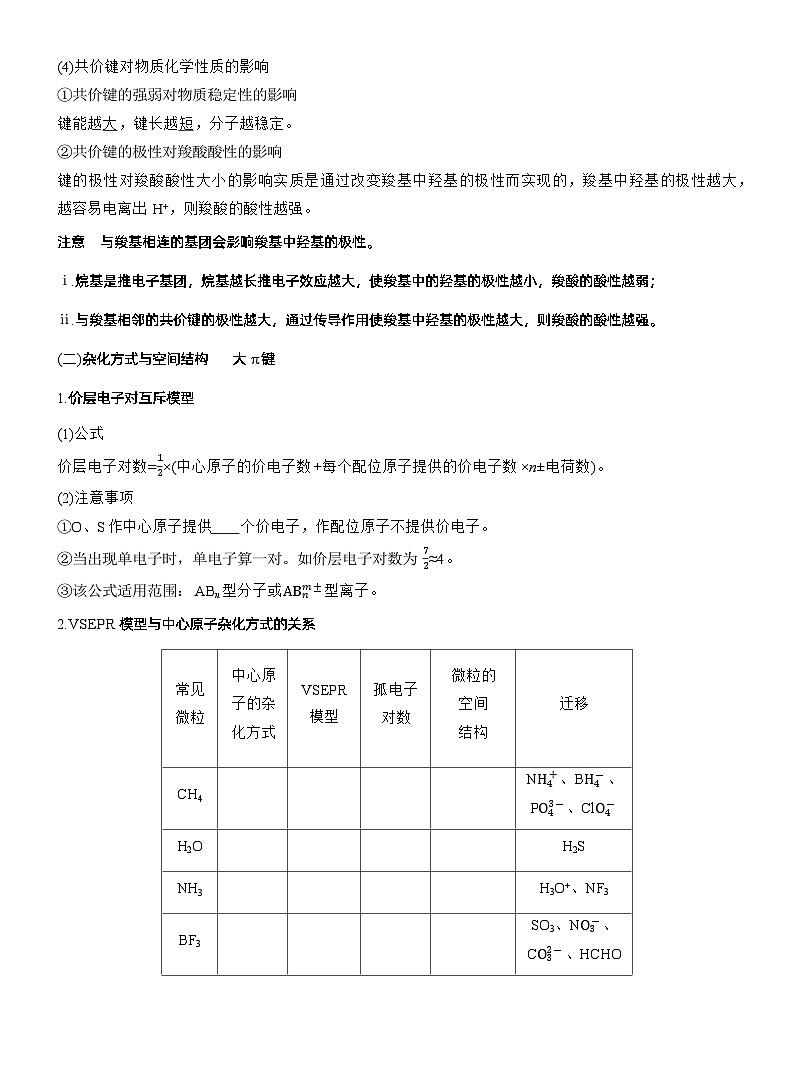
(4)共价键对物质化学性质的影响①共价键的强弱对物质稳定性的影响键能越 ,键长越 ,分子越稳定。②共价键的极性对羧酸酸性的影响键的极性对羧酸酸性大小的影响实质是通过改变羧基中羟基的极性而实现的,羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越强。注意 与羧基相连的基团会影响羧基中羟基的极性。ⅰ.烷基是推电子基团,烷基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱;ⅱ.与羧基相邻的共价键的极性越大,通过传导作用使羧基中羟基的极性越大,则羧酸的酸性越强。
2.VSEPR模型与中心原子杂化方式的关系
注意 原子总数相同、价电子总数相同的分子(或离子)互为等电子体。等电子体具有相同的结构特征(空间结构和化学键类型)及相近的性质。
3.中心原子的成键特点与杂化方式的关系(1)单键C、N、O( 、 、—O—): 杂化。
(2)双键C、N、O( 、 、 ): 杂化。
(3)“==C==”: 杂化。(4)三键C、N(—C≡C—、—C≡N): 杂化。
4.共轭大π键(1)形成条件①中心原子采取sp或者sp2杂化。②参与形成大π键的多个原子应在同一平面或同一直线上。(2)大π键共用电子数的分析方法①大π键中共用电子的数目等于垂直于分子或离子平面的p轨道中的电子数目总和。②判断出中心原子的杂化方式,并画出价层电子轨道表示式。未参与成键的杂化轨道,优先填充两个电子,形成孤电子对,杂化轨道中的电子不参与形成大π键。
③根据配位原子的价层电子轨道表示式,判断配位原子中未参与成键且垂直该分子或离子平面的p轨道中电子数目(单电子优先形成π键)。
5.键角大小的比较原因解释(1)依据杂化方式和空间结构比较键角大小规律:直线形>平面三角形>正四面体形>三角锥形>V形。(2)杂化方式相同,孤电子对数不同键角大小规律:中心原子上孤电子对数越多,孤电子对对成键电子对的斥力 ,键角 。(3)中心原子不同,配位原子相同键角大小规律:中心原子的电负性越大,键角 。(4)中心原子相同,配位原子不同键角大小规律:配位原子的电负性越大,键角 。
(三)分子结构与性质1.分子结构与分子极性的关系
2.物质的溶解性比较答题模板(1)“相似相溶”规律非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。(2)氢键对溶解性的影响与水形成分子间氢键有利于溶质在水中溶解,溶质分子内形成氢键时不利于溶质在水中溶解。(3)溶质与水发生反应对溶解性的影响如果溶质与水发生化学反应,可增大其溶解度。
3.晶体类型与熔、沸点比较答题模板(1)不同类型晶体熔、沸点比较不同类型晶体的熔、沸点高低的一般规律:共价晶体>离子晶体>分子晶体。(2)同为分子晶体一般先看氢键,后看范德华力,最后看分子的极性。(3)同为共价晶体看共价键的强弱,取决于键长,即成键原子半径大小。
(4)同为离子晶体看离子键(或晶格能)的强弱,取决于阴、阳离子半径的大小和所带电荷数。(5)同为金属晶体看金属键的强弱,取决于金属阳离子的半径和所带电荷数。
1.[2024·浙江1月选考,17(3)]已知:
+H2O―→ 。
—NH2中心原子上有孤电子对,孤
电子对对成键电子对排斥力大,键角变小
2.[2024·浙江6月选考,17(3)]化合物HA、HB、HC和HD的结构如图。
①HA、HB和HC中羟基与水均可形成氢键(—O—H…OH2),按照氢键由强到弱对三种酸排序: ,请说明理由:_____________________________________________________________________________________________________________________________。 ②已知HC、HD钠盐的碱性:NaC>NaD,请从结构角度说明理由:_______________________________________________________________________________________________________。
逐渐减小,键的极性:C==O>C==S>C==Se,使得HA、HB、HC中羟基的极性逐渐增大,羟基与H2O形成的氢键逐渐增强
半径:S>O,键长:S—H>O—H,S—H键更易断键电离,因此HD酸性更强,酸根不易水解,碱性:NaC>NaD
3.[2024·北京,15(2)]SnCl2和SnCl4是锡的常见氯化物,SnCl2可被氧化得到SnCl4 。
①SnCl2分子的VSEPR模型名称是 。
②SnCl4的Sn—Cl键是由锡的 轨道与氯的3p轨道重叠形成σ键。
4.[2024·全国甲卷,35(2)(3)(4)](2)CaC2俗称电石,该化合物中不存在的化学键类型为 (填标号)。 a.离子键b.极性共价键c.非极性共价键d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷 ,其中电负性最大的元素是 ,硅原子的杂化轨道类型为 。
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:_________________________________________________________________________________________________________________________________________。
SnF4属于离子晶体,SnCl4、SnBr4、SnI4属于分子晶体,离子晶体的熔点比分子晶体的高,分子晶体的相对分子质量越大,分子间作用力越强,熔点越高
5.[2021·河北,17(3)(4)](3)已知有关氮、磷的单键和三键的键能(kJ·ml-1)如表:
从能量角度看,氮以N2而白磷以P4(结构式可表示为)形式存在的原因是______________________________________________________________________________________。
在原子数目相同的条件下,N2比N4具有更低的能量,而P4比P2具有更低的能量,能量越低越稳定
(4)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为______________,其中P采取 杂化方式。
6.[2020·山东,17(2)]NH3、PH3、AsH3的沸点由高到低的顺序为________ (填化学式,下同),还原性由强到弱的顺序为____________ ,键角由大到小的顺序为 。
NH3、PH3、AsH3
晶体,水分子存在分子间氢键,沸点高
原子结构与性质、分子结构与性质
F>N>C>H 5∶4(或4∶5)
> N和B的杂化方式相同,但N的电负性大于B,共用电子对偏向N,因此N附近电子对排斥力大,使得H—N—H的键角较大
sp2杂化 带星号的碳碳之间是通过未杂化的两个p轨道形成的σ键,一般的碳碳单键是sp3杂化轨道头碰头形成,p轨道比sp3杂化轨道要伸展得更长,因此带星号碳碳之间的键长长
> Cl电负性大,N(CH3)Cl2中Cl原子多,使N电子云密度降低,N的孤电子对不易给出,与BF3形成配位键,即形成的配位键稳定性低
AlCl3是非极性分子,极性比MgCl2小,四氯化碳是非极性溶剂,故AlCl3的溶解度更大 燃烧时释放出大量的热和大量气体
(1)H—N==C==S(2)① ①号N原子的一个单电子和②号N原子的一个孤电子对参与形成大π键,①号N原子剩余1个孤电子对,使得①号N原子的电子云密度较大
2 CH3As(OH)2 CH3As(OH)2与(CH3)2AsOH两种含砷有机酸均属于分子晶体,CH3As(OH)2含两个羟基,形成的氢键数目多,沸点高
(1)碘单质、CS2均为非极性分子,水为极性分子,所以根据相似相溶原理,碘单质在CS2中的溶解度比在水中的大(2)三角锥形 PI3+3H2O===3HI+ H3PO3
(1)O2-半径小于Cl-半径,且O2-所带电荷数多,所以MgO的离子键较强,熔点较高(2)6 sp2、sp3 >
1.基态磷原子的价层电子轨道表示式是 。某激发态P原子的电子排布式为[Ne]3s13p33d1,该P原子中共有 种能量不同的电子。
2.H、C、N、F四种元素电负性由大到小的顺序为 ,基态Cu2+的价层电子中,两种自旋状态的电子数之比为 。
3.铜和锌同周期且相邻,现有几种铜、锌元素的相应状态,①锌:[Ar]3d104s2、②锌:[Ar]3d104s1、③铜:[Ar]3d104s1、④铜:[Ar]3d10,失去1个电子需要的能量由大到小排序是 。
4.碳和氧是构建化合物的常见元素。
某烃结构如图 ,带星号碳原子的杂化方式为 ;带星号碳碳之间的键长比一般碳碳单键的键长要长,请从碳成键轨道的成分角度分析其原因:__________________________________________________________________________________________________________ 。
带星号的碳碳之间是通过未杂化的两个p轨道形成
的σ键,一般的碳碳单键是sp3杂化轨道头碰头形成,p轨道比sp3杂化轨道要伸展得更长,因此带星号碳碳之间的键长长
5.氨硼烷(NH3BH3)具有良好的储氢能力,分子中有配位键。则氨硼烷中H—N—H的键角 (填“>”“”“
相关课件
这是一份专题五 主观题突破3 平衡体系中的有关计算--2025年高考化学大二轮专题复习课件+讲义+专练,文件包含专题五主观题突破3平衡体系中的有关计算--2025年高考化学大二轮专题课件pptx、专题五主观题突破3平衡体系中的有关计算--2025年高考化学大二轮专题复习专练docx、专题五主观题突破3平衡体系中的有关计算--2025年高考化学大二轮专题复习教师版docx、专题五主观题突破3平衡体系中的有关计算--2025年高考化学大二轮专题复习学生版docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份专题三 主观题突破4 晶体类型与性质 晶体结构--2025年高考化学大二轮专题复习课件+讲义+专练,文件包含专题三主观题突破4晶体类型与性质晶体结构--2025年高考化学大二轮专题课件pptx、专题三主观题突破4晶体类型与性质晶体结构--2025年高考化学大二轮专题复习教师版docx、专题三主观题突破4晶体类型与性质晶体结构--2025年高考化学大二轮专题复习学生版docx等3份课件配套教学资源,其中PPT共51页, 欢迎下载使用。
这是一份专题三 主观题突破2 元素电离能、电负性的规范解答--2025年高考化学大二轮专题复习课件+讲义+专练,文件包含专题三主观题突破2元素电离能电负性的规范解答--2025年高考化学大二轮专题课件pptx、专题三主观题突破2晶体类型与性质晶体结构--2025年高考化学大二轮专题复习专练docx、专题三主观题突破2元素电离能电负性的规范解答--2025年高考化学大二轮专题复习教师版docx、专题三主观题突破2元素电离能电负性的规范解答--2025年高考化学大二轮专题复习学生版docx等4份课件配套教学资源,其中PPT共13页, 欢迎下载使用。









