



所属成套资源:2025年高考化学大二轮专题复习课件+讲义+专练
考前特训 (一)关注碳中和,推进碳达峰--2025年高考化学大二轮专题复习(讲练)
展开
这是一份考前特训 (一)关注碳中和,推进碳达峰--2025年高考化学大二轮专题复习(讲练),文件包含考前特训一关注碳中和推进碳达峰--2025年高考化学大二轮专题复习教师版docx、考前学生版一关注碳中和推进碳达峰--2025年高考化学大二轮专题复习学生版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
(一)关注碳中和,推进碳达峰 [分值:50分]
(选择题1~3题,每小题4分,4~7题,每小题6分,共36分)
1.为了2030年实现碳达峰和2060年实现碳中和,“十四五”期间生态环境与资源综合利用发展途径对煤炭行业高质量发展具有重要意义。下列相关说法错误的是( )
A.开发煤炭废弃资源的高值、高效利用技术能降低二次污染
B.煤的综合利用有利于保护自然环境和社会的可持续发展
C.向煤中加入适量碳酸钙可减少燃烧产物中二氧化碳的量
D.利用太阳能等清洁能源代替煤炭,有利于节约资源、保护环境
2.我国提出争取在2030年前实现碳达峰、2060年前实现碳中和,这对于改善环境、实现绿色发展至关重要。CO2催化加氢制CO技术是兼顾新能源和实现碳达峰的重要途径之一,该反应机理如图所示。下列说法错误的是( )
A.反应:CO2(g)+H2(g)CO(g)+H2O(g) ΔH,达平衡后,若升温,c(H2)降低,则ΔH>0
B.催化剂(In2O3)表面易于形成丰富的氧空位,有效促进CO2的吸附活化
C.步骤d、e中,CO2的吸附与转化均存在化学键的断裂与形成
D.催化剂(In2O3)能提高催化加氢的速率,是因为降低了反应的活化能
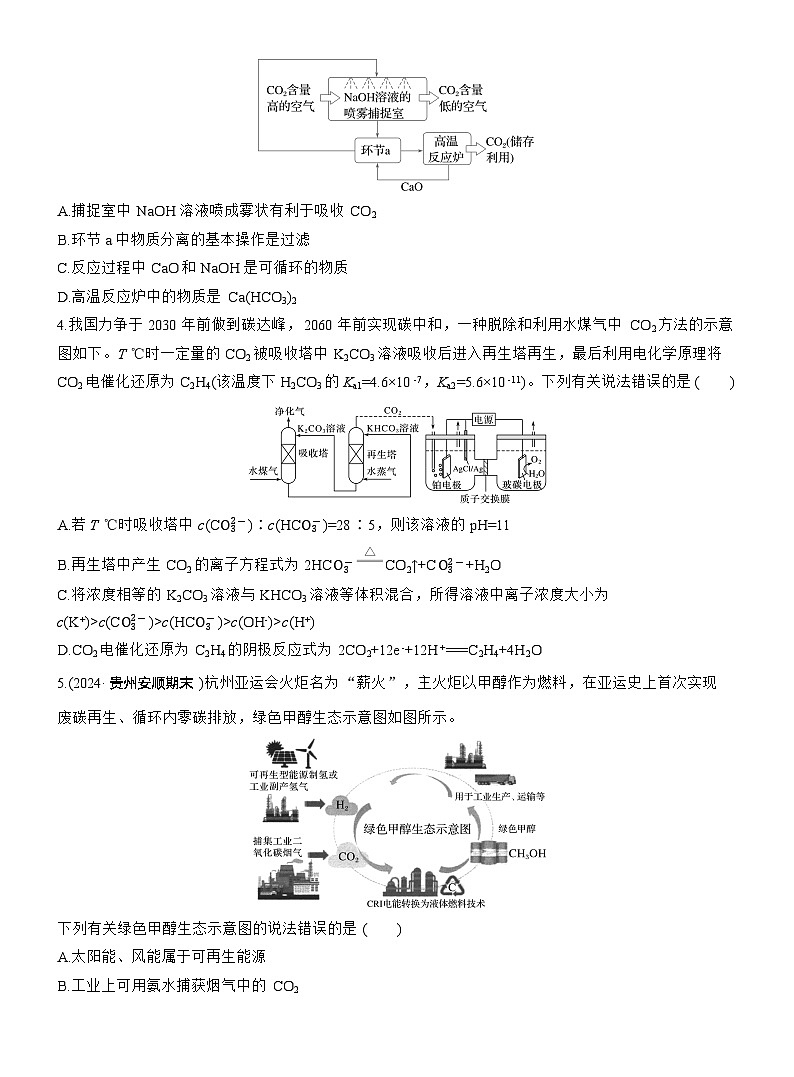
3.中国努力争取2060年前实现碳中和。利用NaOH溶液喷淋捕捉空气中的CO2,反应过程如图所示。下列说法错误的是( )
A.捕捉室中NaOH溶液喷成雾状有利于吸收CO2
B.环节a中物质分离的基本操作是过滤
C.反应过程中CaO和NaOH是可循环的物质
D.高温反应炉中的物质是Ca(HCO3)2
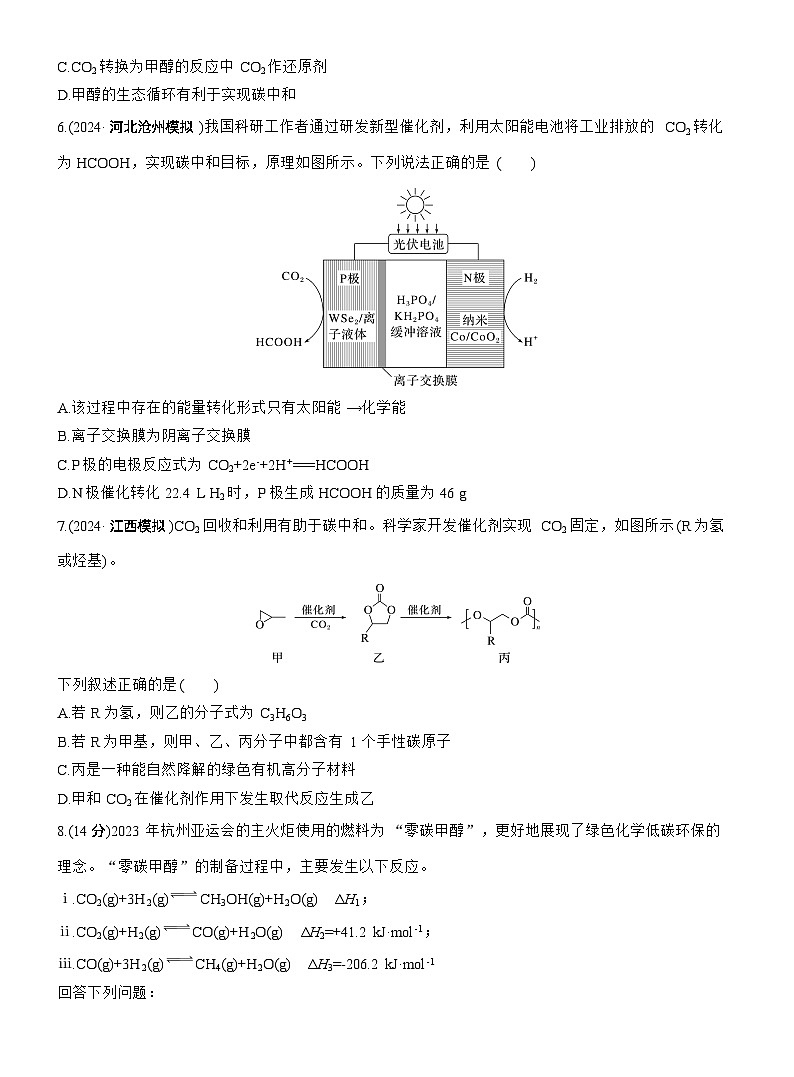
4.我国力争于2030年前做到碳达峰,2060年前实现碳中和,一种脱除和利用水煤气中CO2方法的示意图如下。T ℃时一定量的CO2被吸收塔中K2CO3溶液吸收后进入再生塔再生,最后利用电化学原理将CO2电催化还原为C2H4(该温度下H2CO3的Ka1=4.6×10-7,Ka2=5.6×10-11)。下列有关说法错误的是( )
A.若T ℃时吸收塔中c(CO32-)∶c(HCO3-)=28∶5,则该溶液的pH=11
B.再生塔中产生CO2的离子方程式为2HCO3-CO2↑+CO32-+H2O
C.将浓度相等的K2CO3溶液与KHCO3溶液等体积混合,所得溶液中离子浓度大小为c(K+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.CO2电催化还原为C2H4的阴极反应式为2CO2+12e-+12H+===C2H4+4H2O
5.(2024·贵州安顺期末)杭州亚运会火炬名为“薪火”,主火炬以甲醇作为燃料,在亚运史上首次实现废碳再生、循环内零碳排放,绿色甲醇生态示意图如图所示。
下列有关绿色甲醇生态示意图的说法错误的是( )
A.太阳能、风能属于可再生能源
B.工业上可用氨水捕获烟气中的CO2
C.CO2转换为甲醇的反应中CO2作还原剂
D.甲醇的生态循环有利于实现碳中和
6.(2024·河北沧州模拟)我国科研工作者通过研发新型催化剂,利用太阳能电池将工业排放的CO2转化为HCOOH,实现碳中和目标,原理如图所示。下列说法正确的是( )
A.该过程中存在的能量转化形式只有太阳能→化学能
B.离子交换膜为阴离子交换膜
C.P极的电极反应式为CO2+2e-+2H+===HCOOH
D.N极催化转化22.4 L H2时,P极生成HCOOH的质量为46 g
7.(2024·江西模拟)CO2回收和利用有助于碳中和。科学家开发催化剂实现CO2固定,如图所示(R为氢或烃基)。
下列叙述正确的是( )
A.若R为氢,则乙的分子式为C3H6O3
B.若R为甲基,则甲、乙、丙分子中都含有1个手性碳原子
C.丙是一种能自然降解的绿色有机高分子材料
D.甲和CO2在催化剂作用下发生取代反应生成乙
8.(14分)2023年杭州亚运会的主火炬使用的燃料为“零碳甲醇”,更好地展现了绿色化学低碳环保的理念。“零碳甲醇”的制备过程中,主要发生以下反应。
ⅰ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1;
ⅱ.CO2(g)+H2(g)CO(g)+H2O(g) ΔH2=+41.2 kJ·ml-1;
ⅲ.CO(g)+3H2(g)CH4(g)+H2O(g) ΔH3=-206.2 kJ·ml-1
回答下列问题:
(1)反应ⅰ可能的反应历程如图1所示。
注:方框内包含微粒种类及数目,微粒的相对总能量[如最后一个方框表示1个CH3OH(g)分子和1个H2O(g)分子的相对总能量为-0.51 eV,单位:eV],TS表示过渡态、*表示吸附在催化剂上的微粒,1 eV=1.6×10-22 kJ。
①ΔH1= kJ·ml-1(计算结果保留1位小数)。
②该反应历程中,生成甲醇的决速步骤的反应方程式为 。
(2)在恒温恒压条件下,通入CO2(g)与H2(g)混合气体,发生反应ⅰ、ⅱ、ⅲ。下列可以说明反应达到平衡状态的是 (填字母)。
A.反应混合物中各组分的物质的量浓度不再改变
B.反应后混合气体的压强不再改变
C.混合气体的密度不再改变
D.混合气体的平均相对分子质量不变
(3)一定温度下,将CO2(g)和H2(g)按n(CO2)∶n(H2)=1∶3充入恒容密闭容器中,发生反应ⅰ、ⅱ、ⅲ,容器内总压强与反应时间的变化关系如图2所示。实验测得平衡时n(CH3OH)n(CH4)=3,H2O的分压为15 kPa。
①0~10 min内,CO2的平均分压变化率为 kPa·min-1。
②反应ⅲ的压强平衡常数Kp= kPa-2(以平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果保留2位有效数字)。
(4)一定条件下,向恒温恒容密闭容器中充入CO2(g)和H2(g)只发生反应ⅰ,在两种不同催化剂下建立平衡的过程中H2的转化率随反应时间的变化曲线如图3所示。
①两种催化剂催化效果较好的是 。
②催化剂Ⅰ条件下,t2 min时改变的反应条件可能是 (填字母)。
A.降低温度
B.容器容积不变,通入一定量He(g)
C.容器容积不变,通入一定量CH3OH(g)
D.缩小容器容积
答案精析
1.C [煤中加入适量碳酸钙,可达到钙基固硫的作用,减少燃烧产物中二氧化硫的量,但不能减少二氧化碳的排放量,故C错误。]
2.C [对转化反应,升温c(H2)降低,说明平衡正向移动,ΔH>0,A正确;观察反应机理图可知,催化剂先吸附氢气,氢原子与氧成键后脱水,得到较多的氧空位,促进了CO2的吸附活化,B正确;步骤d中,CO2只是进入氧空位被催化剂吸附,不存在化学键的断裂与形成,C错误;In2O3作催化剂降低了反应的活化能,从而提高化学反应速率,D正确。]
3.D [环节a为向碳酸氢钠溶液中加入氧化钙,氧化钙与碳酸氢钠溶液反应生成碳酸钙沉淀和氢氧化钠,过滤得到碳酸钙沉淀和氢氧化钠溶液,B正确;高温反应炉中碳酸钙受热分解生成氧化钙和二氧化碳,将二氧化碳收集后储存,环节a得到的氢氧化钠溶液和反应炉中得到的氧化钙可以循环利用,C正确、D错误。]
4.C [水煤气中的CO2被吸收塔中K2CO3溶液吸收后形成KHCO3溶液进入再生塔,再生塔中KHCO3分解产生CO2,再将CO2电催化还原为C2H4。设c(CO32-)=2.8 ml·L-1,则c(HCO3-)=0.5 ml·L-1,根据CO32-+H2OHCO3-+OH-可知,c(HCO3-)·c(OH-)c(CO32-)=KwKa2,则0.5×c(OH-)2.8=1.0×10-145.6×10-11,解得c(OH-)=1.0×10-3 ml·L-1,溶液中c(H+)=1.0×10-11 ml·L-1,pH=11,A正确;再生塔中,KHCO3受热分解产生CO2,该反应的离子方程式为2HCO3-CO2↑+CO32-+H2O,B正确;将浓度相等的K2CO3溶液与KHCO3溶液等体积混合,Kh=KwKa2>Ka2,则CO32-的水解程度大于HCO3-的电离程度,故所得溶液中离子浓度大小为c(K+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),C错误;CO2在阴极上被还原为C2H4,电极反应式为2CO2+12e-+12H+===C2H4+4H2O,D正确。]
5.C [CO2可与氨水中的一水合氨反应,故可用氨水捕获烟气中的CO2,故B正确;CO2转换为甲醇,C元素的化合价降低,反应中CO2作氧化剂,故C错误;甲醇的生态循环不会排放CO2,有利于实现碳中和,故D正确。]
6.C [能量转化形式:太阳能→电能→化学能,A错误;P极电极反应消耗H+,故P极区需要补充H+,该离子交换膜为阳离子交换膜,B错误;P极上CO2→HCOOH,C元素的化合价降低,得电子,发生还原反应,则P极为阴极,电极反应式为CO2+2e-+2H+===HCOOH,C正确;没有说明是否为标准状态,不能确定H2的物质的量,D错误。]
7.C [若R为氢,则乙()的分子式为C3H4O3,A项错误;丙分子中有n个手性碳原子,B项错误;丙的链节含酯基,在自然界中可水解生成小分子,C项正确;甲和CO2发生加成反应生成乙,D项错误。]
8.(1)①-49.1 ②HCOOH*+2H2(g)===H2COOH*+32H2(g)[或HCOOH*+12H2(g)===H2COOH*]
(2)ACD (3)①1.25 ②2.3×10-4 (4)①催化剂Ⅰ ②C
解析 (1)①根据ΔH=生成物的总能量-反应物的总能量可得,ΔH1=(-0.51-0)eV×6.02×1023 ml-1=-0.51×1.6×10-22 kJ×6.02×1023 ml-1≈-49.1 kJ·ml-1。②反应的活化能=过渡态的能量-反应物的总能量,则可比较经历过渡态TS1、TS2、TS3、TS4、TS5、TS6的反应的活化能可得,经历TS3过渡态时,反应的活化能最大、反应速率最慢,反应方程式为HCOOH*+2H2(g)===H2COOH*+32H2(g)或HCOOH*+12H2(g)===H2COOH*。(2)恒温恒压条件下,反应混合物中各组分的物质的量浓度不再改变,可说明反应达到平衡状态,A符合题意,B不符合题意;由于反应ⅰ和反应ⅲ均为反应前后气体分子数发生变化的反应,在恒温恒压条件下发生反应ⅰ、ⅱ、ⅲ,反应前后混合气体的体积发生变化,混合气体的质量不变,则反应前后混合气体的密度、平均相对分子质量发生变化,当混合气体的密度、平均相对分子质量不变时,可说明反应达到平衡状态,C、D符合题意。
(3)【第一步:根据信息假设反应物的量】设起始时n(CO2)=1 ml,n(H2)=3 ml。
【第二步:根据图像计算物质转化的量】设平衡时总物质的量为x ml,由题图2可知,起始时总压强为100 kPa,平衡时总压强为80 kPa。恒温恒容条件下,100 kPa80 kPa=4mlxml,x=3.2,气体总物质的量减少0.8 ml。由于反应ⅰ和反应ⅲ均为反应前后气体分子数减小的反应,反应ⅱ为反应前后气体分子数不变的反应,设平衡时n(CH3OH)=a ml,n(CH4)=b ml,依据差量法计算:
CO2(g)+3H2(g)CH3OH(g)+H2O(g) Δn
1 2
a ml 2a ml
CO(g)+3H2(g)===CH4(g)+H2O(g) Δn
1 2
b ml 2b ml
ab=3,2a+2b=0.8,解得a=0.3,b=0.1。
【第三步:列三段式计算】假设反应ⅰ达到平衡后发生反应ⅱ,反应ⅱ达到平衡后发生反应ⅲ,设反应ⅱ生成的CO的物质的量为y ml。
反应ⅰ CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量/ml 1 3 0 0
转化量/ml 0.3 0.9 0.3 0.3
平衡量/ml 0.7 2.1 0.3 0.3
反应ⅱ CO2(g) + H2(g)CO(g) + H2O(g)
起始量/ml 0.7 2.1 0 0.3
转化量/ml y y y y
平衡量/ml 0.7-y 2.1-y y 0.3+y
反应ⅲ CO(g) + 3H2(g)CH4(g)+H2O(g)
起始量/ml y 2.1-y 0 0.3+y
转化量/ml 0.1 0.3 0.1 0.1
平衡量/ml y-0.1 1.8-y 0.1 0.4+y
根据p(H2O)p总=n(H2O)n总,15 kPa80 kPa=n(H2O)3.2ml可得,n(H2O)=0.6 ml,即0.4+y=0.6,y=0.2。
【第四步:根据具体问题计算】①反应过程中消耗的CO2的物质的量为0.5 ml,CO2的压强变化量为0.5ml4ml×100 kPa=12.5 kPa,则0~10 min内,CO2的平均分压变化率为12.5 kPa10min=1.25 kPa·min-1。②平衡时n(H2O)=0.6 ml,n(CH4)=0.1 ml,n(CO)=0.1 ml,n(H2)=1.6 ml,p(H2O)=15 kPa,p(CH4)=p(CO)=2.5 kPa,p(H2)=40 kPa,则反应ⅲ的压强平衡常数Kp=p(CH4)·p(H2O)p(CO)·p3(H2)=2.5 kPa×15 kPa2.5 kPa×(40 kPa)3≈2.3×10-4kPa-2。(4)②由题图3可知,从t2 min开始H2的转化率降低,平衡逆向移动。由于反应ⅰ的正反应为放热反应,降低温度,平衡正向移动,H2的转化率增大,A不符合题意;容器容积不变,通入一定量He(g),各组分的浓度不变,平衡不移动,H2的转化率不变,B不符合题意;容器容积不变,通入一定量CH3OH(g),平衡逆向移动,H2的转化率降低,C符合题意;缩小容器容积,相当于增大压强,由于反应ⅰ为反应前后气体分子数减小的反应,平衡正向移动,H2的转化率增大,D不符合题意。
相关试卷
这是一份考前特训 综合大题标准练(一)--2025年高考化学大二轮专题复习(讲练),文件包含考前特训综合大题标准练一--2025年高考化学大二轮专题复习教师版docx、考前学生版综合大题标准练一--2025年高考化学大二轮专题复习学生版docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
这是一份考前特训 选择题标准练(一)--2025年高考化学大二轮专题复习(讲练),文件包含考前特训选择题标准练一--2025年高考化学大二轮专题复习教师版docx、考前学生版选择题标准练一--2025年高考化学大二轮专题复习学生版docx等2份试卷配套教学资源,其中试卷共17页, 欢迎下载使用。
这是一份考前特训 (五)衔接大学知识,关注科技发展--2025年高考化学大二轮专题复习(讲练),文件包含考前特训五衔接大学知识关注科技发展--2025年高考化学大二轮专题复习教师版docx、考前学生版五衔接大学知识关注科技发展--2025年高考化学大二轮专题复习学生版docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。









