





第9章 水溶液中的离子反应与平衡 第45讲 难溶电解质的沉淀溶解平衡课件--2025年高考化学一轮总复习考点课件
展开
这是一份第9章 水溶液中的离子反应与平衡 第45讲 难溶电解质的沉淀溶解平衡课件--2025年高考化学一轮总复习考点课件,共48页。PPT课件主要包含了饱和溶液,Na2S等内容,欢迎下载使用。
第45讲 难溶电解质的沉淀溶解平衡
1.了解难溶电解质的沉淀溶解平衡。2.理解溶度积(Ksp)的含义,并能进行相关计算。3.了解沉淀的生成、溶解与转化,并能运用化学平衡原理解释。
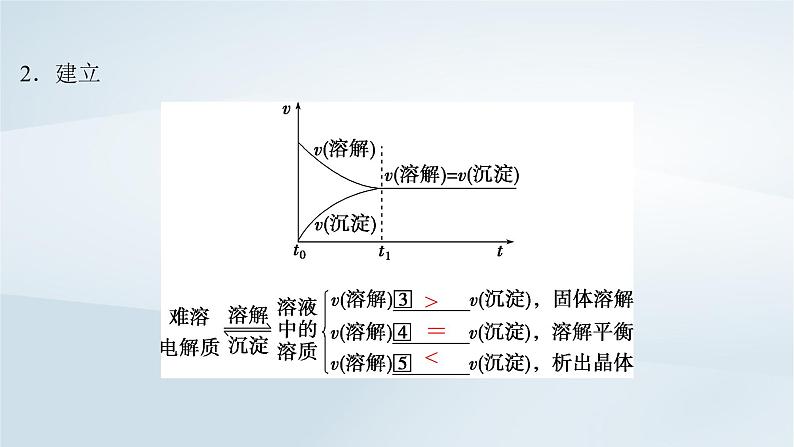
考点一 沉淀溶解平衡及其影响因素 1.概念在一定温度下,当难溶强电解质溶于水形成____________,沉淀溶解和生成的速率________时,即达到溶解平衡状态。
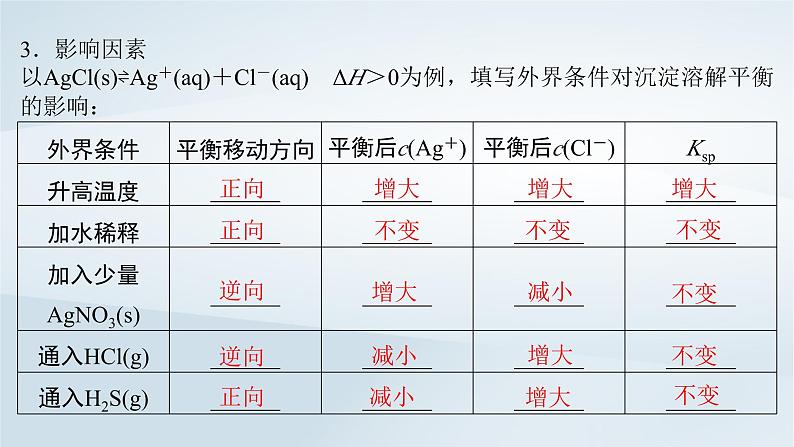
3.影响因素以AgCl(s)⇌Ag+(aq)+Cl-(aq) ΔH>0为例,填写外界条件对沉淀溶解平衡的影响:
1.将足量BaCO3固体分别加入:①30 mL水;②10 mL 0.2 ml·L-1 Na2CO3溶液;③50 mL 0.01 ml·L-1 BaCl2溶液;④100 mL 0.01 ml·L-1盐酸中溶解至溶液饱和。所得溶液中c(Ba2+)由大到小的顺序为________。答案:③>④>①>②
2.已知Ca(OH)2的饱和溶液中存在平衡:Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq) ΔH<0。下列有关该平衡体系的说法正确的是( )①升高温度,平衡逆向移动 ②向溶液中加入少量碳酸钠粉末能增大钙离子的浓度 ③除去氯化钠溶液中混有的少量钙离子,可以向溶液中加入适量的NaOH溶液 ④恒温下,向溶液中加入CaO,溶液的pH升高 ⑤给溶液加热,溶液的pH升高 ⑥向溶液中加入Na2CO3溶液,其中固体质量增加 ⑦向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变A.①⑥B.①⑥⑦C.②③④⑥D.①②⑤⑥⑦
解析:加入碳酸钠粉末会生成CaCO3沉淀,使Ca2+浓度减小,②错;加入氢氧化钠溶液,会生成Ca(OH)2,不能除去Ca2+,③错;恒温下,Ksp不变,加入CaO后,仍为Ca(OH)2的饱和溶液,pH不变,④错;加热,Ca(OH)2的溶解度降低,溶液的pH降低,⑤错;加入NaOH固体,平衡向左移动,Ca(OH)2 固体质量增加,⑦错。
3.室温下向100 mL蒸馏水中加入1 g CaCO3,一段时间后再向其中加入10 mL蒸馏水,一段时间后继续加入10 mL蒸馏水。该过程中电导率的变化如下图所示。
已知:室温下,CaCO3的溶解度为0.001 3 g。下列说法不正确的是( )A.a→b电导率上升是由于CaCO3固体部分溶解于水中B.c和e对应的时刻分别加入了10 mL蒸馏水C.c→d、e→f,电导率下降,说明CaCO3的溶解平衡逆向移动D.g点后的电导率几乎不再改变,说明CaCO3的溶解达到平衡状态
解析:碳酸钙在水中的溶解度较小,但溶于水的碳酸钙在溶液中完全电离,使溶液中的离子浓度增大,导致a→b电导率上升,故A项正确;由题图可知,c→d、e→f的电导率下降,说明溶液中离子浓度减小,即c和e对应的时刻分别加入了10 mL蒸馏水,加入蒸馏水,碳酸钙的溶解平衡正向移动,故B项正确、C项错误;g点后的电导率几乎不再改变,说明溶液中的离子浓度不再改变,碳酸钙的溶解达到平衡状态,故D项正确。
考点二 溶度积及其应用 1.溶度积和离子积以AmBn(s)⇌mAn+(aq)+nBm-(aq)为例:
2.溶度积的影响因素(1)浓度:加水稀释,平衡向________方向移动,但Ksp________。(2)温度:绝大多数难溶电解质的溶解是________过程,升高温度,平衡向__________方向移动,Ksp________。(3)其他:向平衡体系中加入可与体系中某些离子反应生成更难溶物质或更难电离物质或气体的离子时,平衡向溶解方向移动,但Ksp不变。
3.溶度积与溶解度的关系(1)相同类型难溶物(如A2B型:Ag2SO4、Ag2S等;AB型:AgCl、AgBr、BaSO4、CaCO3等),溶度积越小、溶解度越小。(2)不同类型难溶物:结合溶度积估算溶解度。
答案:(1)× (2)√ (3)× (4)×
一、溶度积的概念及影响因素1.下列说法正确的是( )A.难溶电解质的溶度积Ksp越小,它的溶解度越小B.Ksp(Ag2CrO4)0。下列叙述错误的是( )A.加热悬浊液,使其温度升高,Ksp(AgCl)增大B.加少量水稀释,上述平衡正向移动,c(Ag+)不变C.向悬浊液中通入少量氨,Q(AgCl)c(I-)>c(Ag+)
解析:三种卤化银组成形式相同,Ksp小的物质先形成沉淀,故a点时形成的是黄色的AgI沉淀,A项错误;由题图可知,当消耗4.50 mL AgNO3溶液时,溶液中I-、Br-、Cl-均沉淀完全,由于三种卤素离子的浓度相等,故每种离子完全沉淀时均消耗1.50 mL AgNO3 溶液,0.100 ml·L-1×1.50 mL=c(I-)×15.00 mL,解得c(I-)=0.01 ml·L-1,B项错误;
相关课件
这是一份新高考化学一轮复习课件第9章 第57讲 难溶电解质的沉淀溶解平衡(含解析),共60页。PPT课件主要包含了必备知识,关键能力,溶度积常数及应用,沉淀溶解平衡的应用,真题演练明确考向,课时精练等内容,欢迎下载使用。
这是一份高考化学一轮复习第9章水溶液中的离子反应与平衡第45讲难溶电解质的沉淀溶解平衡课件,共47页。PPT课件主要包含了饱和溶液,Na2S等内容,欢迎下载使用。
这是一份2025届高考化学一轮总复习第9章水溶液中的离子反应与平衡第45讲难溶电解质的沉淀溶解平衡课件,共47页。PPT课件主要包含了饱和溶液,Na2S等内容,欢迎下载使用。









