
江苏省扬州市八校2024-2025学年高一(上)12月学情检测 化学试卷
展开
这是一份江苏省扬州市八校2024-2025学年高一(上)12月学情检测 化学试卷,共9页。试卷主要包含了下列物质属于电解质的是, 下列说法正确是等内容,欢迎下载使用。
I卷(选择题,共42分)
选择题:共14题,每题3分,共42分。每小题只有一个选项最符合题意。
1. 我国承诺在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当,下列措施不利于实现“碳中和”的是( )
A. 研究CO2转化为淀粉的技术B. 加强CO2的捕集和再利用
C. 践行节能低碳的生活方式D. 加大化石能源的消费比重
2. 反应NaCl+NH3+H2O+CO2=NH4Cl+NaHCO3↓ 可用于联合制碱。下列说法正确的是( )
A. 氯离子的结构示意图:
B. 中子数为10的氧原子:
C. 反应体系中核外电子总数相等微粒只有NH3和
D. NaHCO3电离方程式:NaHCO3=Na++H++
3. 下列制取、净化Cl2、验证其氧化性并进行尾气吸收的装置和原理能达到实验目的的是( )
4.下列物质属于电解质的是( )
A. Mg B. SO2 C.乙醇 D.HCl
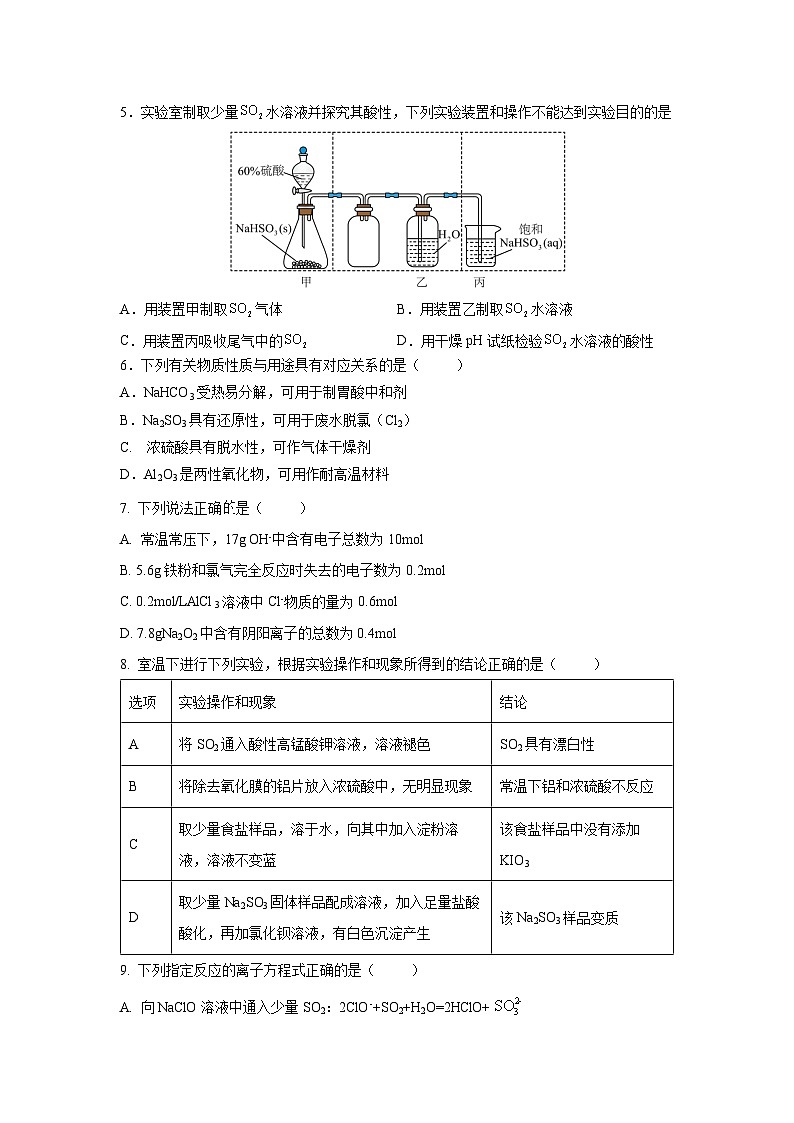
5.实验室制取少量水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
A.用装置甲制取气体B.用装置乙制取水溶液
C.用装置丙吸收尾气中的D.用干燥pH试纸检验水溶液的酸性
6.下列有关物质性质与用途具有对应关系的是( )
A.NaHCO3受热易分解,可用于制胃酸中和剂
B.Na2SO3具有还原性,可用于废水脱氯(Cl2)
C. 浓硫酸具有脱水性,可作气体干燥剂
D.Al2O3是两性氧化物,可用作耐高温材料
7. 下列说法正确是( )
A. 常温常压下,17g OH-中含有电子总数为10ml
B. 5.6g铁粉和氯气完全反应时失去的电子数为0.2ml
C. 0.2ml/LAlCl3溶液中Cl-物质的量为0.6ml
D. 7.8gNa2O2中含有阴阳离子的总数为0.4ml
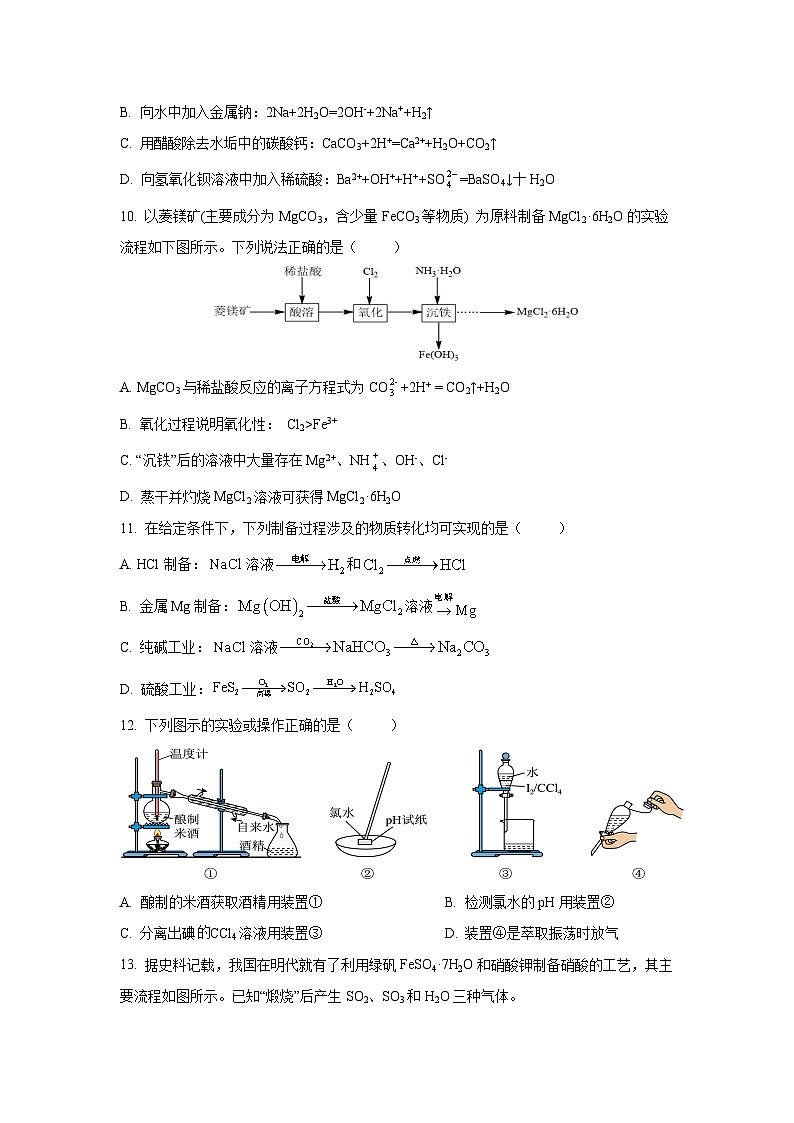
8. 室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
9. 下列指定反应的离子方程式正确的是( )
A. 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O=2HClO+
B. 向水中加入金属钠:2Na+2H2O=2OH-+2Na++H2↑
C. 用醋酸除去水垢中的碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
D. 向氢氧化钡溶液中加入稀硫酸:Ba2++OH++H++SO=BaSO4↓十H2O
10. 以菱镁矿(主要成分为MgCO3,含少量FeCO3等物质) 为原料制备MgCl2·6H2O的实验流程如下图所示。下列说法正确的是( )
A. MgCO3与稀盐酸反应的离子方程式为CO+2H+ = CO2↑+H2O
B. 氧化过程说明氧化性: Cl2>Fe3+
C. “沉铁”后的溶液中大量存在Mg2+、NH、OH-、Cl-
D. 蒸干并灼烧MgCl2溶液可获得MgCl2·6H2O
11. 在给定条件下,下列制备过程涉及的物质转化均可实现的是( )
A. HCl制备:溶液和
B. 金属Mg制备:溶液
C. 纯碱工业:溶液
D. 硫酸工业:
12. 下列图示的实验或操作正确的是( )
A. 酿制的米酒获取酒精用装置①B. 检测氯水的pH用装置②
C. 分离出碘CCl4溶液用装置③D. 装置④是萃取振荡时放气
13. 据史料记载,我国在明代就有了利用绿矾FeSO4·7H2O和硝酸钾制备硝酸的工艺,其主要流程如图所示。已知“煅烧”后产生SO2、SO3和H2O三种气体。
下列说法不正确的是( )
A. 将煅烧产生的三种气体通入BaCl2溶液,产生两种白色沉淀
B. 煅烧过程中铁元素的化合价升高
C. “吸收”过程中发生的氧化还原反应为2SO2+2H2O+O2=2H2SO4
D. 加入硝酸钾制得硝酸是因为硫酸的沸点高于硝酸
14. 海水资源综合利用的部分过程如下图所示,下列说法正确的是( )
A. 工业上通过电解饱和食盐水制备金属钠和氯气
B. 制溴工业中用SO2水溶液吸收溴蒸汽,生成HBr和H2SO3
C. 在制溴工业中,通过氧化、还原、再氧化的步骤实现了溴的富集
D. 在制镁工业中,工业常NaOH溶液作为Mg2+沉淀剂
Ⅱ卷(选择题,共58分)
15. 由次氯酸钠碱性废水(含有杂质Ca2+)处理硫酸工业尾气的流程如下:
已知:次氯酸钠高温时不稳定会分解。
(1)84消毒液的有效成分为,可用作消毒剂、漂白剂。用于环境杀菌消毒的NaClO溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是__________________。
(2)控制合适的条件有利于提高SO2的吸收率(脱硫率)。
①脱硫时保持溶液呈碱性,脱硫时发生的氧化还原反应的离子方程式为:___________。
②提高脱硫率的可行措施有___________(填序号)。
加快通入尾气的速率 b、吸收塔中喷淋的碱液与气体逆向接触
c、适当提高碱液浓度
③温度控制在40~60℃之间,脱硫率较高,温度不宜过高的原因是___________。
(3)脱硫完成后过滤,滤渣的主要成分为___________(填化学式)。
(4)为实现燃煤脱硫,向煤中加入浆状Mg(OH)2,使燃烧产生的SO2最终转化为稳定的MgSO4,写出该反应的化学方程式:___________。
(5)燃煤烟气中的SO2也可用Na2SO3溶液吸收,吸收SO2后的溶液通过 (填字母)可使吸收液再生。
a.加热 b.加入足量的NaOH c.通入O2
16. 二氧化氯(ClO2)是一种高效、低毒的消毒剂。请回答下列问题∶
(1)①工业制备ClO2的反应原理为:2NaClO3+4HCl═2NaCl+2ClO2↑+Cl2↑+2H2O,
该反应中每生成0.5mlClO2转移电子数为___ ____ml。
②现需要用36.5%浓盐酸配制500mL2ml·L-1稀盐酸,必须使用的玻璃仪器有烧杯、量筒、胶头滴管和_____ __。
③下列操作会使所配盐酸浓度偏低的是 。
a.定容时俯视刻度线 b.容量瓶水洗后未干燥 c.转移时有少量溶液溅出
(2)ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO),需将其转化为Cl-除去。下列试剂中可将ClO转化为Cl-的是__ _____(填序号)。
A.O2 B. KI C.KMnO4 D.SO2
(3)用ClO2处理过的饮用水常含有一定量有害的ClO2。我国规定饮用水中ClO2的含量在0.1~0.8mg·L-1。测定水样中ClO2的含量的过程如下:
步骤1:量取25.00mL水样加入锥形瓶中;
步骤2:用稀H2SO4调节溶液呈酸性,加入足量的KI晶体充分反应;
步骤3:逐滴加入2.00×10-3ml·L-1的Na2S2O3溶液,恰好完全反应时,消耗Na2S2O3溶液20.00mL;
已知:2ClO2+10KI+4H2SO4=2KCl+5I2+4K2SO4+4H2O,I2+2Na2S2O3=Na2S4O6+2NaI,根据上述数据计算并判断该水样中ClO2的含量是否符合国家规定。_______(请写出计算过程)
17.Ⅰ 和在生活、生产中有着广泛的应用,以氯化钠为原料制备和的部分工艺流程如下:
(1)海水晒盐获得的粗盐中含有杂质,需要进行粗盐的精制。实验过程如下:称取一定质量的粗盐,加水充分溶解,向所得溶液中依次加入稍过量的NaOH溶液、甲溶液、乙溶液,过滤;向滤液中加入足量盐酸,蒸发结晶,制得精盐。甲溶液为____ _______溶液(填化学式)。实验中不取样出来进行分析,判断NaOH溶液加入量己“稍过量”的实验方法及现象是_______ ____。
(2)反应I过滤所得的需要洗涤、干燥。其中检验是否洗涤干净的操作是___________ 。
(3)处理母液的两种方法:
方法一:向母液中加入石灰乳,发生反应生成的_____(填化学式)可循环利用。
方法二:向母液中加入细小的食盐颗粒并降温,可得到晶体,加入食盐的目的是____。
Ⅱ. 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:
已知:①Cl2+2OH− == ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为________ ___;
实验中控制温度除用冰水浴外,还需采取的措施__ _。
步骤Ⅱ合成N2H4·H2O装置如图−1所示。
NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是______;使用冷凝管的目的是
18. (1)海带中的碘元素灼烧后通常以I- 的形式存在,从海带中提取单质碘的流程如下。
①灼烧海带所用仪器名称:酒精灯、三脚架、泥三角、___________。操作⑤的名称___________。
②写出氧化时发生反应的离子方程式为___________。
(2)燃煤烟气中的捕集可通过如下所示的物质转化实现。
“吸收”后所得的溶液与足量石灰乳反应的化学方程式为______ ____;载人航天器内,常用LiOH固体而很少用KOH固体吸收空气中的,其原因是___________。(已知LiOH:24g/ml,KOH:56g/ml)
利用铁及其氧化物循环制氢,原理如图所示,反应器Ⅰ中化合价发生改变的元素有_______;含1mlCO和2ml的混合气体通过该方法制氢,理论上可获得_______。
已知:3Fe + 4H2O(g) === Fe3O4 + 4H2
【参考答案】
选择题(42分)
非选择题(58分)
计算题4分,其余每空均2分,选择有错0分,漏1分,方程式系数错1分
(1)NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解
(2)① ClO-+SO2+2OH-=Cl-++H2O ② bc
③ 温度过高,SO2溶解度小,次氯酸钠不稳定会分解
(3)CaSO4 (4)O2+2SO2+2Mg(OH)2=2MgSO4+2H2O (5)a b
16.(1)① 0.5 ② 玻璃棒、500mL容量瓶 ③ c (2) BD
(3) n(Na2S2O3)=2.00×10-3ml·L-1×20.00×10-3L=4.00×10-5ml
ClO2~5Na2S2O3
n(ClO2)=1/5n(Na2S2O3)=4.00×10-5×1/5ml=8.00×10-6ml
ClO2的含量为=21.6 mg·L-1>0.8 mg·L-1,不符合
17.Ⅰ(1)BaCl2 静置,向上层清液中继续滴加NaOH溶液,若无白色沉淀出现则已稍过量
(2)取少许最后一次洗涤滤液于试管中,滴加HNO3酸化的AgNO3溶液,若无白色沉淀生成,则说明洗涤干净
(3) 降低的溶解度
Ⅱ(1) 3Cl2+6OH−5Cl−+ClO3−+3H2O 缓慢通入Cl2
(2) NaClO碱性溶液 减少水合肼的挥发
18.(1)①. 坩埚 萃取(萃取、分液) ② 2I-+H2O2+2H+=I2+2H2O
(2)
相同质量的LiOH固体可吸收更多二氧化碳
(3) C、H、Fe 8/3
A
B
C
D
制取Cl2
除去HCl
验证Cl2氧化性
吸收尾气
选项
实验操作和现象
结论
A
将SO2通入酸性高锰酸钾溶液,溶液褪色
SO2具有漂白性
B
将除去氧化膜的铝片放入浓硫酸中,无明显现象
常温下铝和浓硫酸不反应
C
取少量食盐样品,溶于水,向其中加入淀粉溶液,溶液不变蓝
该食盐样品中没有添加KIO3
D
取少量Na2SO3固体样品配成溶液,加入足量盐酸酸化,再加氯化钡溶液,有白色沉淀产生
该Na2SO3样品变质
海水
→制盐工业:粗盐→精盐→饱和食盐水→氯碱工业
→制溴工业:
→制镁工业:
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
答案
D
B
C
D
C
B
A
D
B
B
A
C
A
C
相关试卷
这是一份2025扬州八校高一上学期12月学情检测试题化学含答案,文件包含µ▒ƒΦïÅτ£üµë¼σ╖₧σ╕éσཱུí2024-2025σ¡ªσ╣┤Θ½ÿΣ╕ÇΣ╕èσ¡ªµ£ƒ12µ£êσ¡ªµâàµúǵ╡ïσîûσ¡ªΦ»òΘóÿdocx、µ▒ƒΦïÅτ£üµë¼σ╖₧σ╕éσཱུí2024-2025σ¡ªσ╣┤Θ½ÿΣ╕ÇΣ╕èσ¡ªµ£ƒ12µ£êσ¡ªµâàµúǵ╡ïσîûσ¡ªτ¡öµíêdocx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
这是一份2024~2025学年江苏省扬州市八校高一(上)12月学情检测化学试卷(含答案),共10页。
这是一份江苏省扬州市八校2024-2025学年高一上学期12月学情检测化学试卷(Word版附答案),文件包含江苏省扬州市八校2024-2025学年高一上学期12月学情检测化学试题docx、江苏省扬州市八校2024-2025学年高一上学期12月学情检测化学答案docx等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。








