

福建省名校联盟2024-2025学年高三上学期期中考试 化学试题(原卷版)-A4
展开
这是一份福建省名校联盟2024-2025学年高三上学期期中考试 化学试题(原卷版)-A4,共9页。试卷主要包含了考试结束后,将答题卡交回, 铍用于宇航器件的构筑等内容,欢迎下载使用。
本试卷共8页,考试时间75分钟,总分100分。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3.考试结束后,将答题卡交回。
可能用到的相对原子质量:N 14 O16 Na 23
一、选择题(每题只有一个正确答案。每题4分,共40分。)
1. 2024年10月14日,嫦娥六号取自月球背面的土壤样品首次亮相海外。下列说法正确的是
A. 月壤中含有珍贵的,其与互为同位素
B. 航天员手臂“延长器”中的碳纤维属于有机高分子材料
C. 量子通信材料如螺旋碳纳米管、石墨烯等纳米材料属于胶体
D. “嫦娥六号”探测器使用的太阳能电池可将化学能转化为电能
2. 下列实验操作正确且能达到目的的是
A. AB. BC. CD. D
3. 在下列稀溶液中通入过量,相关反应的离子方程式错误的是
A. AB. BC. CD. D
4. 氮及其化合物部分转化关系如下,设为阿伏加德罗常数的值。下列说法错误的是
A. 常温下,的氨水中含有数目为
B. 常温常压下,中含有的分子数为
C. 反应①中生成的转移的电子数为
D. 标准状况下,中所含质子总数为
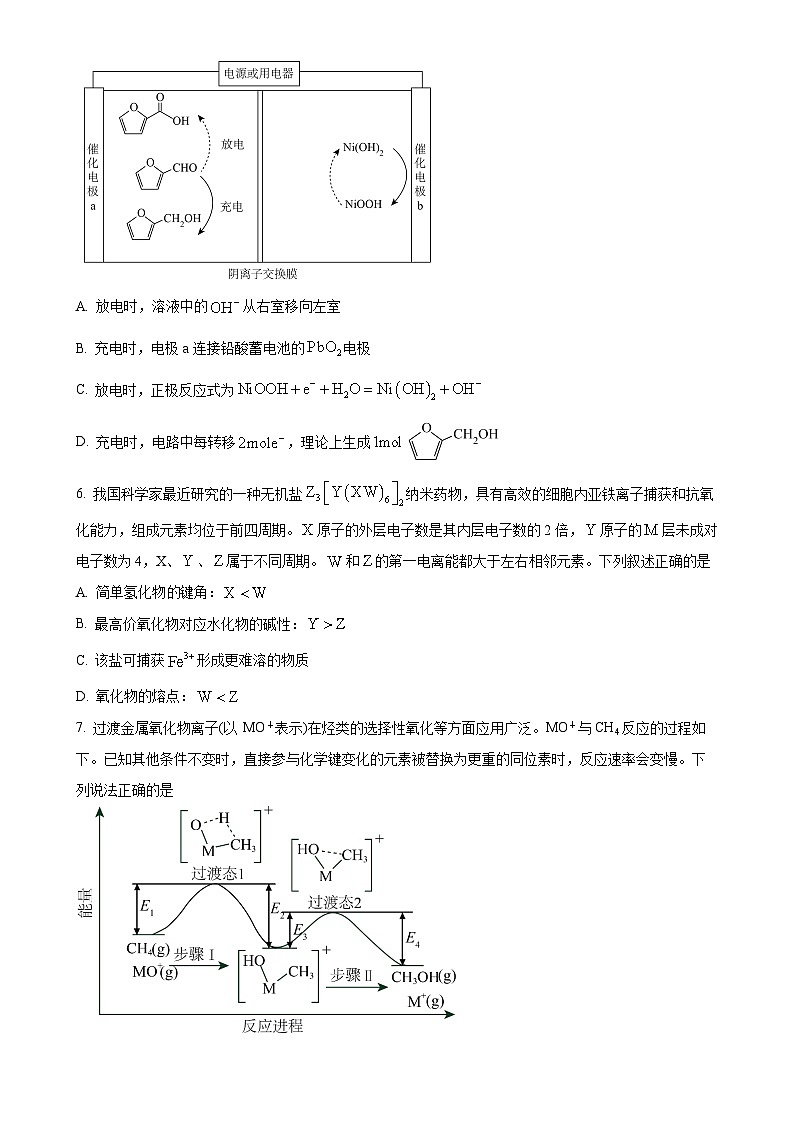
5. 近期我国科技工作者基于生物质平台分子糠醛()的氧化还原性,创制了一种新型可充放电的“生物质电池”,在存储和释放电力的同时,可生产高附加值的化学品,其原理如下。下列说法错误的是
A. 放电时,溶液中的从右室移向左室
B. 充电时,电极a连接铅酸蓄电池的电极
C. 放电时,正极反应式为
D. 充电时,电路中每转移,理论上生成
6. 我国科学家最近研究的一种无机盐纳米药物,具有高效的细胞内亚铁离子捕获和抗氧化能力,组成元素均位于前四周期。原子的外层电子数是其内层电子数的2倍,原子的层未成对电子数为4,X、、属于不同周期。和的第一电离能都大于左右相邻元素。下列叙述正确的是
A. 简单氢化物键角:
B. 最高价氧化物对应水化物的碱性:
C. 该盐可捕获形成更难溶的物质
D. 氧化物的熔点:
7. 过渡金属氧化物离子(以 MO+表示)在烃类的选择性氧化等方面应用广泛。MO+与CH4反应的过程如下。已知其他条件不变时,直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢。下列说法正确的是
A. 反应过程中涉及非极性键的断裂与形成
B. 其他条件相同时,CD4与MO+发生上述反应的E1变小
C. 若MO+与CH3D反应,生成的氘代甲醇有2种
D.
8. 实验室用还原(沸点31.85℃)制备高纯硅的装置如下(夹持装置和尾气处理装置略去)。下列说法错误的是( )
A. 装置I也可用于实验室制备
B. 装置II、III中依次盛装的是浓硫酸和高于32℃的热水
C. 实验时,应先打开活塞K,对氢气进行验纯后,再加热管式炉
D. 为鉴定制得的硅中是否含微量铁单质,仅需使用盐酸和溶液
9. 铍用于宇航器件的构筑。一种从铝硅酸盐[Be3Al2(SiO3)6]中提取铍的工艺流程如下:
已知:;HA为有机酸;“反萃取”生成Na2[Be(OH)4]。下列说法错误的是
A. “滤渣”主要成分为H2SiO3
B. “萃取分液”的目的是分离Be2+和Al3+
C. “反萃取”化学方程式为
D. 离子中4个O原子位于正四面体四个顶点
10. 常温下己二酸溶液中,与离子浓度变化的关系如图。下列叙述错误的是
A. 的数量级为
B. 溶液呈酸性
C. 当混合溶液呈中性时,
D. 若的初始浓度为,则的溶液中
二、非选择题
11. LFP是一种常见的锂离子正极材料,其中含有、炭黑、铝箔和粘合剂聚偏二氟乙烯()等。利用废弃LFP正极材料回收金属、选择性提锂的工艺流程如下图所示。
已知:①;。
②,。
③相关离子浓度小于即可认为该离子不存在。
回答下列问题:
(1)基态Li原子的核外电子排布式为___________;Fe元素在周期表中的位置为___________。
(2)“焙烧”产生的气体有HF和___________;同时有和生成,则发生反应的化学方程式为___________。
(3)“焙烧”不在玻璃设备中进行的原因是___________。
(4)“滤渣1”中的金属元素主要为___________(写元素符号);“滤渣2”的成分是,则“调节”的范围为___________。
(5)“沉锂”时加入的量是理论用量的1.5倍,其目的是___________(从平衡角度分析)。(6)的晶胞结构如图(a),每个晶胞中的数目为___________。其中围绕和分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。充电时,脱出部分形成,如下图所示,则___________。
12. 是一种易溶于水的白色结晶状粉末,在工业上有广泛的应用。某小组在实验室制备,并进行相关性质探究和产品纯度测定。
I.的制备
已知:、
该小组拟利用氮氧化物(平均组成为)制备实验装置如下。
(1)装置A中反应仪器的名称是___________。
(2)实验过程中,向装置B内间断性地通入适量的目的是___________。
(3)不能单独被纯碱溶液吸收,为了使完全被纯碱溶液吸收且产品纯度最高,___________。
II.性质探究
实验完毕后,从装置C中分离出固体粗产品(不含杂质),取少量上述产品配制成样品溶液进行相关实验探究。
(4)小组成员推测是弱酸。为证实推测,取上述样品溶液少量于试管中,加入___________(填试剂名称),实验现象为___________,则证实该推测合理。
(5)小组成员预测有氧化性。
①甲同学进行如下实验,并依据现象认为可以得出结论:该条件下,能氧化,其反应的离子方程式为___________。
②乙同学则认为C装置中制取的样品含有副产物,仅凭甲同学的实验不能得出上述结论。请你设计补充实验以证明在甲同学的实验条件下,能氧化的只有。实验方案为___________。
III.产品纯度测定
称取粗产品于烧瓶中,加入足量固体和的稀,充分反应并通一段时间的,将烧瓶中的溶液用容量瓶稀释成的待测液。取待测液于锥形瓶中,以淀粉溶液作指示剂,用标准溶液滴定,平行实验得标准溶液平均用量为。(已知:)
(6)该粗产品中的纯度为___________。
(7)纯度测定实验过程中若未通入,则测得的产品纯度将___________(填“偏大”“偏小”或“不影响”)。
13. 探究合成反应化学平衡的影响因素,有利于提高的产率。以、为原料合成的反应分为如下两步:
I.
II.
(1) ___________。
(2)两步反应的能量变化如图所示:
反应进程下列说法正确的有___________(填字母标号)。
A. 使用催化剂,可提高的平衡转化率
B. 降低步骤II中过渡态的能量,可显著提高生成甲醇的总速率
C. 提高反应温度,平衡时减小,增大
D. 为提高甲醇的产率,可将反应混合气循环通过极性且不溶于水的惰性液态溶剂
(3)按投料,实验测定的平衡转化率、或的平衡选择性随温度、压强的变化关系如图[选择性]。
①其中线表示___________的平衡选择性(填“”或“”);压强:___________(填“>”或“”“”“
相关试卷
这是一份福建省名校联盟2024-2025学年高三上学期期中考试化学,文件包含化学答案pdf、化学pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份福建省名校联盟2024-2025学年高三上学期期中考试化学,文件包含化学答案pdf、化学pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份福建省名校联盟2024-2025学年高三上学期期中考试 化学试题,文件包含福建省名校联盟2024-2025学年高三上学期期中考试化学试题pdf、化学参考答案和解析pdf、化学参考答案pdf等3份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。









