

福建省龙岩一级校联盟2024-2025学年高一上学期 期中考试化学试卷-A4
展开
这是一份福建省龙岩一级校联盟2024-2025学年高一上学期 期中考试化学试卷-A4,共8页。试卷主要包含了选择题,填空题等内容,欢迎下载使用。
(考试时间:75分钟 总分:100分)
命题人:长汀一中:陈梓云 漳平一中:黄丽惠 永定一中:江怀森
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 Mn 55
第Ⅰ卷 选择题(共42分)
一、选择题(本大题共14小题,每小题3分,共42分。在每小题所列出的四个选项中,只有一项是最符合题目要求的)
1.化学是一门具有创造性的科学。下列事实不能直接体现这一说法的是( )
A.水力发电
B青蒿素的发现与合成
C.新型材料的制造
D.“21世纪的金属”——钛的冶炼
2.下列物质中,与氯气、盐酸都能发生反应且生成不同氯化物的是( )
A.ZnB.AlC.CuD.Fe
3.2023年诺贝尔化学奖授予研究“量子点”的科学家。“量子点”是由数百或数千个原子组成的小团体,直径通常在2nm~10nm之间,将适量的“铜量子点”置于水中,形成的分散系是( )
A悬油液B乳浊液
C.胶体D.溶液
4.氧化还原反应与四种基本反应类型的关系如图,则下列化学反应属于区域3的是( )
A.
B.
C.
D.
5.在湿润的土壤中,氮元素有如图所示的转化过程,下列说法正确的是( )
是还原产物B.是还原剂
是氧化产物D.是氧化剂
6.下列有关阿伏加德罗常数的说法正确的是( )
A.常温常压下,中氮分子数目为
B.的氯化镁溶液中含氯离子数目为
C.常温常压下,和混合气体中含有原子数为
D.1ml钠与足量反应生成和的混合物,钠失去的电子数目为
7.对下列描述的相关说法正确的是( )
8.室温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明溶液中:、、、
B.在酸性溶液中:、、、
C.使酚酞变红色的溶液中:、、、
D.溶液中:、、、
9.下列反应能发生且离子方程式书写正确的是( )
A.将Na加入溶液中:
B铁粉与稀硫酸反应:
C.和水反应:
D.氧化镁和盐酸反应:
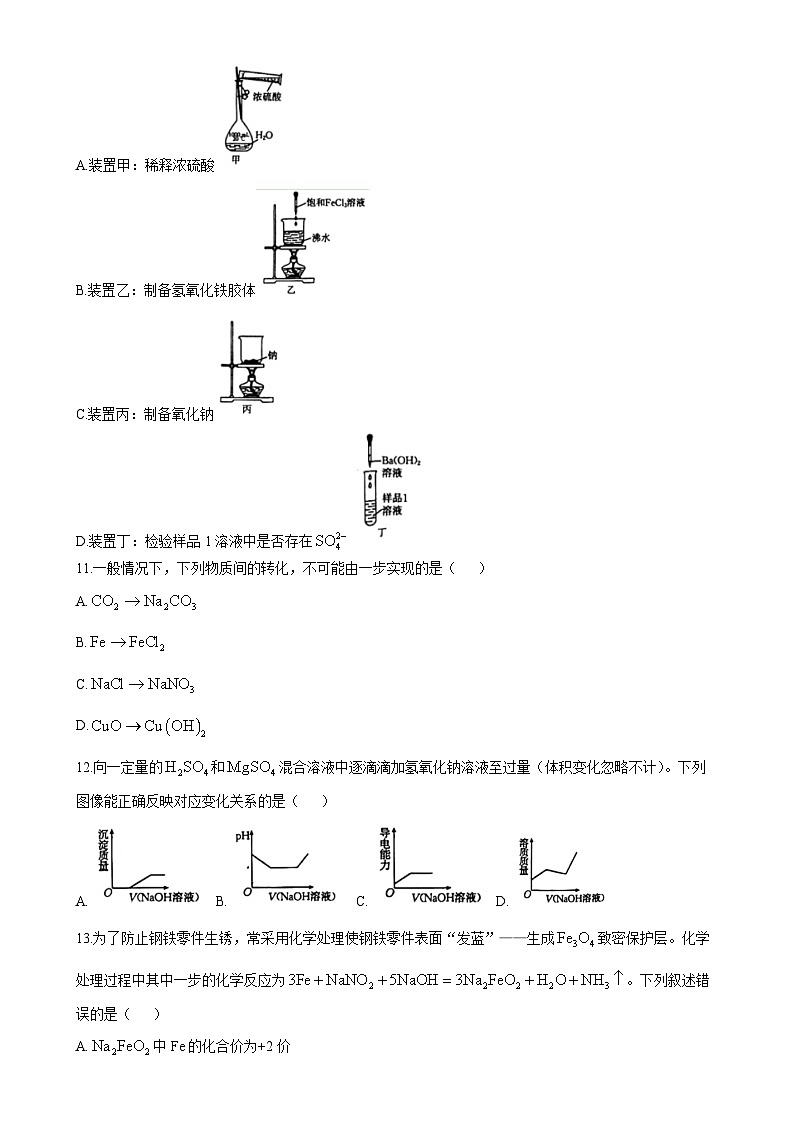
10.用如图所示实验装置进行相关实验探究,可以达到实验目的的是( )
A.装置甲:稀释浓硫酸
B.装置乙:制备氢氧化铁胶体
C.装置丙:制备氧化钠
D.装置丁:检验样品1溶液中是否存在
11.一般情况下,下列物质间的转化,不可能由一步实现的是( )
A.
B.
C.
D.
12.向一定量的和混合溶液中逐滴滴加氢氧化钠溶液至过量(体积变化忽略不计)。下列图像能正确反映对应变化关系的是( )
A.B.C.D.
13.为了防止钢铁零件生锈,常采用化学处理使钢铁零件表面“发蓝”——生成致密保护层。化学处理过程中其中一步的化学反应为。下列叙述错误的是( )
A.中Fe的化合价为+2价
B.Fe被氧化,发生氧化反应
C.还原性:
D.氧化剂与还原剂的物质的量之比为3:1
14.室温下,通过下列实验探究、溶液的性质。
根据上述实验推测,下列说法错误的是( )
A.等浓度的碳酸钠溶液和碳酸氢钠溶液的碱性,前者的更强
B.实验②中发生反应的离子方程式为
C.实验③中发生反应的化学方程式为
D.实验④中既有复分解反应发生,又有氧化还原反应发生
第Ⅱ卷 非选择题(共58分)
二、填空题(本大题共4小题,共58分)
15.(15分)物质类别和核心元素的价态是学习物质性质的两个重要视角。下图是钠及其化合物的“价-类”二维图。
请回答下列问题:
(1)物质①与水反应的离子方程式为______,所以通常将其保存在______中。
(2)二维图中缺失的②中有一种是淡黄色固体且可用作呼吸面具的供氧剂,该固体中阳离子和阴离子的个数比为______,其用作供氧剂时反应的化学方程式为______。
(3)常用于治疗胃酸过多,写出在水溶液中的电离方程式;______。
(4)从物质类别的视角看,NaOH属于______(填编号,下同)类物质,一般能与下列______类别的物质发生反应。
①酸性氧化物 ②碱性氧化物 ③酸 ④碱
(5)从核心元素价态的视角看,NaH中H元素的化合价为______,从H元素的价态分析,NaH常用作______(填“氧化剂”或“还原剂”)。
16.(14分)某实验需要的溶液,配制步骤包括:
①把称量好的固体放入烧杯中,加适量蒸馏水溶解;
②待烧杯中的溶液冷却到室温后,转入______;
③用少量蒸馏水洗涤烧杯和玻璃棒次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡;
④继续加蒸馏水至液面距刻度线处,改用______滴加蒸馏水至溶液凹液面与刻度线相切;
⑤将容量瓶塞紧,充分摇匀。
回答下列问题:
(1)用托盘天平称量所需晶体的质量为______g.
(2)实验步骤中使用的仪器分别为②______、④______。
(3)所配溶液取出20mL,取出的溶液中物质的正浓度是______,取出的溶液中溶质的质量为______g,将取出的溶液加水稀释至100mL,所得溶液的物质的量浓度为______。
(4)下列关于容量瓶的操作,正确的是______。
A.B.C.D.
(5)在配制过程中,下列操作导致所配制的溶液的物质的量浓度偏高的为______。
A.碳酸钠晶体部分风化
B.定容时仰视刻度线
C.称量时,物品和砝码的位置放反了
D.未冷却到室温就将溶液转移到容量瓶并定容
17.(13分)化学是在原子、分子水平上研究物质的组成、结构、性质、转化及其应用的基础自然科学。
(1)根据下列物质的组成和性质完成填空。
a.氯气b.硫酸铜溶液c.熔融氯化钠d.过氧化钠固体
①属于电解质的是______(填字母序号,下同)。
②上述状态下能导电的物质有______。
(2)经检测,某酸性废水中存在大量的、、、。现进行以下实验:
①取100mL该废水于烧杯中,逐滴滴加NaOH溶液至呈碱性,原废水中离子的数目会发生变化的是、、______(用离子符号表示)。
②欲除去其中的、,并得到中性溶液,设计的工艺流程如图所示。
操作X的名称是______,所需用到的玻璃仪器有烧杯、______,试剂b中溶质的化学式为______。
③测得100mL废水中、、、的物质的量浓度分别为、
、、,则该废水中______。
18.(16分)含氯物质在生产、生活中有重要作用。舍勒在研究软锰矿(主要成分是,其摩尔质量为)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色气体。
(1)写出浓盐酸与反应生成黄绿色气体的离子方程式:______,用与足量浓盐酸充分反应,生成的体积(标准状况下)为______L。
(2)实验室制取并收集干燥、纯净的。所用仪器如下图所示,装置的接口连接顺序:______→______→______→______(按气流方向,用小写字母表示);饱和食盐水的作用为______。
(3)实验室中也可以用高锰酸钾与浓盐酸在常温下反应制取氯气。从下列仪器中选择制取氯气的装置是______(填字母),仪器P的名称为______。
A.B.C.
(4)某兴趣小组在实验中发现浓盐酸与混合加热生成氯气,稀盐酸与混合加热不生成氯气。对用稀盐酸进行实验没有氯气生成的原因,兴趣小组经讨论后有如下猜想:
猜想一:小明认为是低导致。
猜想二:小红认为是①______导致。
小组设计了以下实验方案进行验证:
a.稀盐酸滴入中,然后通入HCl气体加
b.稀盐酸滴入中,然后加入NaCl固体加热
c.稀盐酸滴入中,然后加入浓硫酸加热
d.与NaCl的浓溶液混合加热
e.浓硫酸与NaCl固体、固体共热
实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。
由此可知猜想②______成立。
龙岩市一级校联盟22024—2025学年第一学期半期考联考
高一化学参考答案
一、选择题(本大题共14小题,每小题3分,共42分)
1.A 2.D 3.C 4.B 5.A 6.C 7.B 8.C 9.D 10.B 11.D 12.A 13.D 14.B
二、填空题(本大题共4小题,共58分)
注:1.除标注外其余空均为2分。
2.反应方程式缺条件、气体符号,未配平统一扣1分,全对给2分,化学式错误不给分。
3.双选答案漏选给1分,错选不给分,全对给2分。
15.(共15分)
(1);煤油或石蜡油(1分)
(2);或
(3)
(4)④(1分);①③
(5)-1(1分);还原剂
16.(共14分)
(1)14.3
(2)100mL容量瓶(1分,未写100mL不给分);胶头滴管(1分)
(3)1.0;1.06;0.1
(4)D
(5)AD
17.(共13分)
(1)①cd
②bc
(2)①、
②过滤(1分);漏斗、玻璃棒;
③0.1
18.(共16分)
(1);4.48
(2)dcab;除去氯气中混有的HCl气体
(3)A;分液漏斗
(4)①低
选项
描述
相关说法
A
单线桥法标注电子转移的方向和数目:
单线桥标注规范正确
B
还原性:
C
水溶液中电离方程式:
是一种酸
D
泡沫灭火器能喷射出大量泡沫
金属钠起火可以用它来灭火
相关试卷
这是一份福建省龙岩一级校联盟2024~2025学年高三(上)期中化学试卷(含答案),共10页。
这是一份福建省龙岩一级校联盟2024-2025学年高三上学期期中考试 化学试卷,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。
这是一份福建省龙岩一级校联盟2024-2025学年高三上学期期中考试 化学试卷,共9页。试卷主要包含了选择题,非选择题等内容,欢迎下载使用。








