

吉林省四平市2023_2024学年高一化学上学期期中试题含解析
展开
这是一份吉林省四平市2023_2024学年高一化学上学期期中试题含解析,共20页。试卷主要包含了本卷主要考查内容等内容,欢迎下载使用。
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将条形码粘贴在答题卡上的指定位置。
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作答;字体工整,笔迹清楚。
4.考试结束后,请将试卷和答题卡一并上交。
5.本卷主要考查内容:人教版必修第一册第一章~第二章第二节。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 S32 Cl35.5 Fe56 Cu64 Zn65
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3nm)恢复了磁性,下列关于“钴酞菁”分子的说法正确的是
A. 其在水中形成的分散系属于溶液B. “钴酞菁”分子直径比的直径小
C. 其在水中形成的分散系能产生丁达尔效应D. “钴酞菁”分子不能透过滤纸
2. 农业上首先将石灰石煅烧,然后将煅烧后的产物(生石灰)加水制成悬浊液,最后向其中加入硫酸铜溶液,便可制得波尔多液,上述过程中没有涉及的化学反应类型是
A化合反应B. 分解反应
C. 复分解反应D. 置换反应
3. 分类是学习和研究化学一种重要方法,下列物质的分类正确的是
A. 和都属于碱性氧化物B. 硝酸和硝酸钠都属于酸
C. 和都属于碱D. 和都属于金属单质
4. 下列物质在给定条件下的转化均能一步实现的是
A.
B.
C.
D.
5. 室温下,下列各组离子在指定溶液中能大量共存的是
A. 的溶液中:、、、
B. 含的溶液中:,,、
C. 使酚酞变红色的溶液中:、、、
D. NaOH溶液中:、、、
6. 氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影部分的是
A. B.
C. D.
7. 关于钠的单质及其化合物的叙述正确的是
A. 金属钠长期露置于空气中,最终变为碳酸钠
B. 与水反应是水做还原剂氧化还原反应
C. 、都能与二氧化碳反应并生成
D. 、都能与水反应,且都是碱性氧化物
8. 下列物质的性质与用途具有对应关系的是
A. 盐酸有挥发性,可用于除铁锈B. 能溶于水,可用于工业制盐酸
C. NaClO具有强氧化性,可用作漂白剂D. NaOH显碱性,可用作干燥剂
9. 下列化学反应的离子方程式书写正确的是
A. 用小苏打治疗胃酸过多:
B. 石灰乳与盐酸反应:
C. 氧化镁跟稀硫酸反应:
D. 溶液与KOH溶液反应:
10. 下列关于氯气和氯水的说法中不正确的是
A. 氯气是一种黄绿色、密度比空气大有毒气体
B. 使用氯气对自来水消毒、杀菌,一定不会对人体有害
C. 新制氯水能杀菌消毒主要是因为氯水中含有次氯酸
D. 氯水放置数天后酸性增强
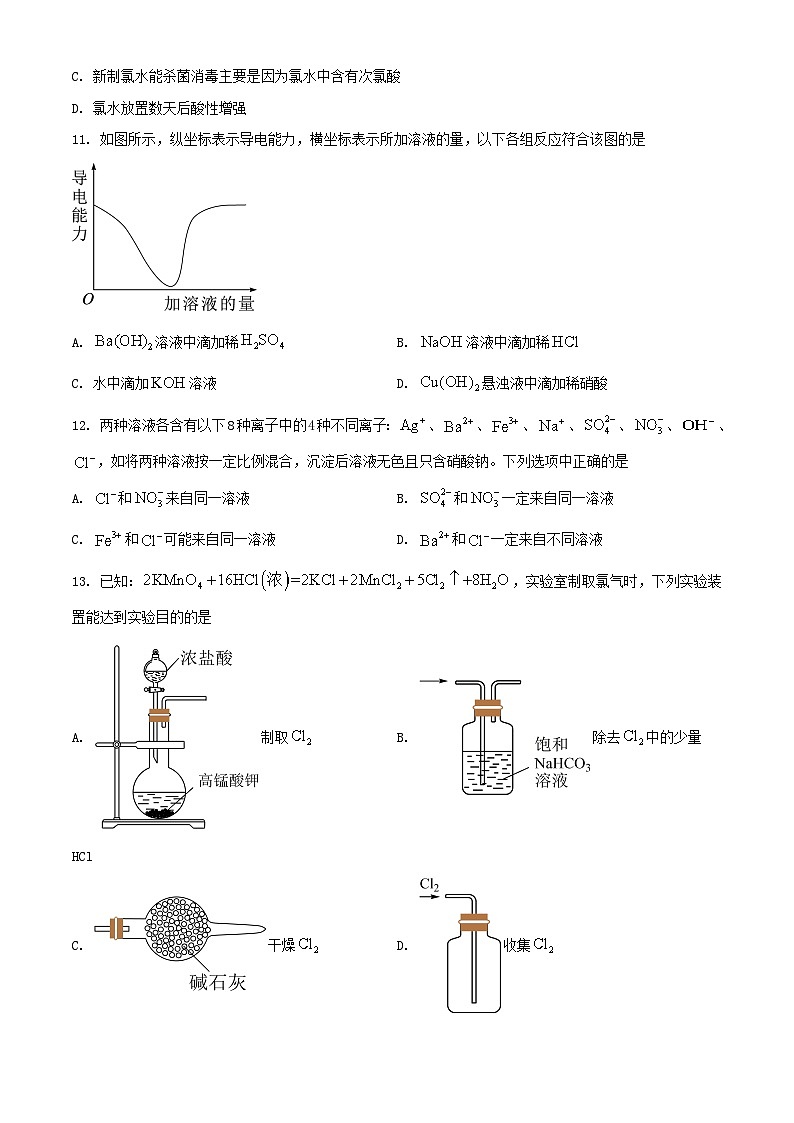
11. 如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应符合该图的是
A. 溶液中滴加稀B. 溶液中滴加稀
C. 水中滴加溶液D. 悬浊液中滴加稀硝酸
12. 两种溶液各含有以下8种离子中的4种不同离子:、、、、、、、,如将两种溶液按一定比例混合,沉淀后溶液无色且只含硝酸钠。下列选项中正确的是
A. 和来自同一溶液B. 和一定来自同一溶液
C. 和可能来自同一溶液D. 和一定来自不同溶液
13. 已知:,实验室制取氯气时,下列实验装置能达到实验目的的是
A. 制取B. 除去中的少量HCl
C. 干燥D. 收集
14. 根据下列实验操作和现象所得到的结论不正确的是
A. AB. BC. CD. D
15. 溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变成棕色(产生)。向反应后的溶液中通入过量,溶液变成无色(生成SOF)。下列说法正确的是
A. 滴加KI溶液时,被还原,是氧化反应的产物
B. 通入后,溶液变成无色,体现氧化性
C. 整个过程发生了复分解反应和氧化还原反应
D. 上述实验条件下,物质的氧化性:
二、非选择题:本题共4小题,共55分。
16. “分类研究”是重要的学习与科研方法。现有下列9种物质:①HCl气体;②NaCl固体;③;④蔗糖;⑤固体;⑥熔融;⑦氢氧化铁胶体;⑧硫酸溶液;⑨铜。回答下列问题:
(1)上述物质中属于电解质的有__________,能导电的纯净物有__________。(填序号)
(2)NaCl溶于水的电离方程式为__________。
(3)上述9种物质中有两种物质在水溶液中发生反应的离子方程式为,则该反应的化学方程式为__________。
(4)溶液与足量的溶液反应的离子方程式为__________。
(5)实验室制备⑦,需要在沸水中滴加__________(填化学式)饱和溶液,反应的化学方程式为__________。
17. 下图是一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
回答下列问题:
(1)物质A、I的化学式为__________、__________。
(2)单质C的实验室保存方法是__________。
(3)反应③的化学方程式为__________。
(4)写出反应①的化学方程式并用双线桥法表示电子转移的方向和数目:__________,该反应中氧化剂与还原剂质量之比为__________。
(5)反应④的化学方程式为__________。
18. 有一瓶澄清的无色溶液,其中可能含有、、、、、、、。取该溶液进行以下实验:
(1)由题干可知溶液中一定不存在___________(填离子符号,下同);用pH试纸检验,溶液呈强酸性,可以排除___________的存在。
(2)取出部分溶液滴加过量的NaOH溶液,只产生白色沉淀,则可证明___________(填离子符号)的存在,生成白色沉淀的离子方程式为___________。
(3)取出部分上述碱性溶液滴加Na2SO4溶液,有白色沉淀生成,证明___________(填离子符号,下同)的存在,同时可排除原溶液中___________的存在,产生白色沉淀的离子方程式为___________。
(4)根据上述实验事实可知原溶液中一定存在的离子有___________,不确定是否存在的离子有___________。
19. 作为一种广泛的消毒剂,它密度比空气大,易溶于水而难溶于有机溶剂,实验室用与干燥的反应制得和NaCl。下图是实验室用于制备和收集一定量纯净的的装置(某些夹持装置和垫持用品省略)。其中E中盛有液体(用于除去中的未反应的,氧气几乎不溶于饱和食盐水)。
(1)仪器P的名称是__________。
(2)请写出装置A中烧瓶内发生反应的化学方程式:__________,每转移4个电子时,产生分子的个数为__________。
(3)B、C装置中所盛试剂分别是__________、__________。
(4)F为收集装置,应选用装置是__________(填序号),其中与装置E导管相连的导管口是__________(填接口字母)。
(5)装置D中发生反应的化学方程式为__________。
(6)与NaOH反应可以得到以NaClO为有效成分的漂白液,漂白液与洁厕灵(主要成分为HCl)同时使用会产生,请用离子方程式表示该反应__________。
四平市普通高中2023—2024学年度第一学期期中教学质量检测
高一化学试题
全卷满分100分,考试时间75分钟。
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将条形码粘贴在答题卡上的指定位置。
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作答;字体工整,笔迹清楚。
4.考试结束后,请将试卷和答题卡一并上交。
5.本卷主要考查内容:人教版必修第一册第一章~第二章第二节。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 Mg24 S32 Cl35.5 Fe56 Cu64 Zn65
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1. 我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3nm)恢复了磁性,下列关于“钴酞菁”分子的说法正确的是
A. 其在水中形成的分散系属于溶液B. “钴酞菁”分子直径比的直径小
C. 其在水中形成的分散系能产生丁达尔效应D. “钴酞菁”分子不能透过滤纸
【答案】C
【解析】
【分析】胶体是分散质粒子大小在 1nm~100nm 的分散系;
【详解】A.“钴酞菁”分子(直径为1.3nm)在水中形成的分散系属于胶体,A错误;
B.“钴酞菁”分子的直径为1.3nm,半径小于1nm,B错误;
C.束通过胶体时,光线能够发生散射作用而产生丁达尔效应,而通入其它分散系时不能产生丁达尔效应,C正确;
D.胶体粒子能透过滤纸,故“钴酞菁”分子(直径为1.3nm)能透过滤纸,D错误;
故选C。
2. 农业上首先将石灰石煅烧,然后将煅烧后的产物(生石灰)加水制成悬浊液,最后向其中加入硫酸铜溶液,便可制得波尔多液,上述过程中没有涉及的化学反应类型是
A. 化合反应B. 分解反应
C. 复分解反应D. 置换反应
【答案】D
【解析】
【详解】煅烧石灰石为分解反应,生石灰与水反应生成熟石灰为化合反应,悬浊液与溶液反应为复分解反应,未涉及置换反应,故选D。
3. 分类是学习和研究化学的一种重要方法,下列物质的分类正确的是
A. 和都属于碱性氧化物B. 硝酸和硝酸钠都属于酸
C和都属于碱D. 和都属于金属单质
【答案】A
【解析】
【详解】A.和都属于碱性氧化物,故A正确;
B.硝酸钠属于盐,故B错误;
C.碳酸钠属于盐,故C错误;
D.属于非金属单质,故D错误。
综上所述,答案为A。
4. 下列物质在给定条件下的转化均能一步实现的是
A.
B.
C.
D.
【答案】B
【解析】
【详解】A.氧化铜和一氧化碳生成铜和二氧化碳,Cu与HCl不反应,,A不符合题意;
B.碳酸氢钠不稳定受热分解为碳酸钠,碳酸钠和氢氧化钙生成碳酸钙沉淀和氢氧化钠溶液,B符合题意;
C.由于盐酸的酸性大于碳酸,所以氯化钡溶液中通入二氧化碳,不能生成碳酸钡沉淀,C不符合题意;
D.HClO在光照条件下分解生成HCl和,D不符合题意;
故选B。
5. 室温下,下列各组离子在指定溶液中能大量共存的是
A. 的溶液中:、、、
B. 含的溶液中:,,、
C. 使酚酞变红色的溶液中:、、、
DNaOH溶液中:、、、
【答案】C
【解析】
【详解】A.的溶液中与不能大量共存,A错误;
B.含的溶液具有氧化性,能氧化、,B错误;
C.使酚酞变红色的溶液中:、、、互不反应,可以共存,C正确;
D.NaOH溶液中:与不能大量共存,D错误;
选C。
6. 氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影部分的是
A. B.
C. D.
【答案】B
【解析】
【分析】阴影部分所表示的反应类型为氧化还原反应,且不属于四种基本反应类型。
【详解】A.该反应是一种单质和化合物生成另外一种单质和化合物的反应,属于置换反应,A不符合题意;
B.该反应不属于四种基本反应类型,但存在元素化合价改变属于氧化还原反应,B符合题意;
C.该反应符合一变多特点,属于分解反应,C不符合题意;
D.该反应符合多变一特点,属于化合反应,D不符合题意;
故选B。
7. 关于钠的单质及其化合物的叙述正确的是
A. 金属钠长期露置于空气中,最终变为碳酸钠
B. 与水反应是水做还原剂的氧化还原反应
C. 、都能与二氧化碳反应并生成
D. 、都能与水反应,且都是碱性氧化物
【答案】A
【解析】
【详解】A.金属钠长期露置于空气中,先与氧气反应生成氧化钠,氧化钠与水反应生成氢氧化钠,氢氧化钠与二氧化碳反应生成含结晶水的碳酸钠,风化得到碳酸钠,A正确;
B.过氧化钠与水反应是氧化还原反应,水既不是氧化剂又不是还原剂,B错误;
C.氧化钠与水反应生成氢氧化钠,无氧气生成,C错误;
D.氧化钠是碱性氧化物,过氧化钠不是碱性氧化物,D错误;
故选A。
8. 下列物质的性质与用途具有对应关系的是
A. 盐酸有挥发性,可用于除铁锈B. 能溶于水,可用于工业制盐酸
C. NaClO具有强氧化性,可用作漂白剂D. NaOH显碱性,可用作干燥剂
【答案】C
【解析】
【详解】A.盐酸具有酸性,能和金属氧化物反应,可用于除铁锈,故A不符合题意;
B.Cl2用于工业制盐酸,是因为氯气与氢气反应生成氯化氢,与其溶解性无关,故B不符合题意;
C.NaClO具有强氧化性,能漂白,可用作漂白剂,故C符合题意;
D.NaOH固体具有潮解性,能吸收水分,可用作干燥剂,故D不符合题意;
故选C。
9. 下列化学反应的离子方程式书写正确的是
A. 用小苏打治疗胃酸过多:
B. 石灰乳与盐酸反应:
C. 氧化镁跟稀硫酸反应:
D. 溶液与KOH溶液反应:
【答案】D
【解析】
【详解】A.小苏打为,碳酸氢根离子为弱酸根离子,不能拆,反应的离子方程式为,A错误;
B.石灰乳的主要成分为,不能拆写,反应的离子方程式为,B错误;
C.氧化镁与稀硫酸反应的离子方程式为:,C错误;
D.溶液与KOH溶液反应实质为氢离子和氢氧根离子生成水:,D正确;
故选D。
10. 下列关于氯气和氯水的说法中不正确的是
A. 氯气是一种黄绿色、密度比空气大的有毒气体
B. 使用氯气对自来水消毒、杀菌,一定不会对人体有害
C. 新制氯水能杀菌消毒主要是因为氯水中含有次氯酸
D. 氯水放置数天后酸性增强
【答案】B
【解析】
【详解】A.氯气是一种黄绿色、密度比空气大的有毒气体,A正确;
B.使用Cl2对自来水消毒时,氯气会与水中的有机物发生反应,生成的有机氯化物可能对人体有害,B错误;
C.新制氯水能杀菌消毒是因为Cl2溶于水生成了次氯酸,次氯酸能杀菌消毒,C正确;
D.氯水放置数天后,其中次氯酸见光易分解生成盐酸,导致溶液的酸性增强,D正确;
故合理选项是B。
11. 如图所示,纵坐标表示导电能力,横坐标表示所加溶液的量,以下各组反应符合该图的是
A. 溶液中滴加稀B. 溶液中滴加稀
C. 水中滴加溶液D. 悬浊液中滴加稀硝酸
【答案】A
【解析】
【详解】A.溶液中滴加稀,会发生反应生成硫酸钡和水,离子浓度逐渐减小,直至导电能力接近为0,再加硫酸,过量的硫酸电离,导电能力逐渐增强,符合图示内容,A正确;
B.溶液中滴加稀盐酸,溶液的导电能力不会出现接近为0的状态,不符合图示内容,B错误;
C.水中滴加溶液,导电能力逐渐增强,不符合图示内容,C错误;
D.氢氧化铜与稀硝酸反应生成的硝酸铜电离出和,导电能力亦不会出现接近为0的状态,不符合图示内容,故D错误;
答案选A。
12. 两种溶液各含有以下8种离子中的4种不同离子:、、、、、、、,如将两种溶液按一定比例混合,沉淀后溶液无色且只含硝酸钠。下列选项中正确的是
A. 和来自同一溶液B. 和一定来自同一溶液
C. 和可能来自同一溶液D. 和一定来自不同溶液
【答案】D
【解析】
【分析】、均会与结合生成沉淀,和结合生成沉淀,和、结合均会生或沉淀,不能共存,则一种溶液中含有、、、,另一种溶液中含有、、、,这两种溶液按一定比例混合,沉淀后溶液无色且只含硝酸钠,据此分析解答,
【详解】A.根据上述分析可知,和来自不同的溶液、A错误;
B.和来自不同的溶液,B错误;
C.和来自不同的溶液,C错误;
D.和一定来自不同溶液,D正确;
答案选D。
13. 已知:,实验室制取氯气时,下列实验装置能达到实验目的的是
A. 制取B. 除去中的少量HCl
C. 干燥D. 收集
【答案】A
【解析】
【详解】A.由已知方程式可知浓盐酸和高锰酸钾反应不需要加热可制得,A正确;
B.由于溶于水后生成HCl和HClO,而HCl能与反应,故不能用饱和NaHCO,溶液除去中少量的HCl,B错误;
C.不能用碱石灰干燥,碱石灰会与发生反应,C错误;
D.收集的集气瓶不能塞上塞子,D错误;
故选A。
14. 根据下列实验操作和现象所得到的结论不正确的是
A. AB. BC. CD. D
【答案】C
【解析】
【详解】A.用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色,说明含有钠元素,A正确;
B.空气中加热生成淡黄色,B正确;
C.取久置的粉末,向其中滴加过量的盐酸,过氧化钠与盐酸反应生成氯化钠、水和氧气,碳酸钠与盐酸反应也能产生无色气体,可知无论是否变质,均有无色气体产生,则该方法无法证明过氧化钠是否变质,C错误;
D.将金属钠在燃烧匙中燃烧,迅速伸入集满的集气瓶,瓶中产生大量白烟和黑色颗粒,说明发生了置换反应生成和C,黑色颗粒是炭,D正确;
故选C。
15. 溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变成棕色(产生)。向反应后的溶液中通入过量,溶液变成无色(生成SOF)。下列说法正确的是
A. 滴加KI溶液时,被还原,是氧化反应的产物
B. 通入后,溶液变成无色,体现氧化性
C. 整个过程发生了复分解反应和氧化还原反应
D. 上述实验条件下,物质的氧化性:
【答案】A
【解析】
【详解】A.根据题给信息知溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变成棕色,发生反应:;Cu元素的化合价由+2价降低到+1价,被还原,I元素的化合价由-1价升高到0价,KI被氧化,生成,则是氧化反应的产物,氧化性:,A正确;
B.通入后溶液逐渐变成无色,发生反应:,S元素的化合价升高,做还原剂,体现其还原性,氧化性:,B错误;
C.整个过程发生的反应均为氧化还原反应,C错误;
D.由以上分析可知氧化性:,D错误;
选A。
二、非选择题:本题共4小题,共55分。
16. “分类研究”是重要的学习与科研方法。现有下列9种物质:①HCl气体;②NaCl固体;③;④蔗糖;⑤固体;⑥熔融;⑦氢氧化铁胶体;⑧硫酸溶液;⑨铜。回答下列问题:
(1)上述物质中属于电解质的有__________,能导电的纯净物有__________。(填序号)
(2)NaCl溶于水的电离方程式为__________。
(3)上述9种物质中有两种物质在水溶液中发生反应的离子方程式为,则该反应的化学方程式为__________。
(4)溶液与足量的溶液反应的离子方程式为__________。
(5)实验室制备⑦,需要在沸水中滴加__________(填化学式)饱和溶液,反应的化学方程式为__________。
【答案】(1) ①. ①②⑤⑥ ②. ⑥⑨
(2)
(3)
(4)
(5) ①. ②.
【解析】
【小问1详解】
电解质是在水溶液或熔融状态下能够导电的化合物,故属于电解质的是①②⑤⑥,金属单质、石墨、或电解质在水溶液或熔融状态下能导电,故能导电的纯净物有⑥⑨;
【小问2详解】
氯化钠是强电解质,在水中完全电离,故电离方程式为;
【小问3详解】
根据书写离子方程式时强酸、强碱、可溶性盐拆开,在上述9种物质中符合的是盐酸和氢氧化钡反应,故化学方程式为;
【小问4详解】
根据书写离子方程式时强酸、强碱、可溶性盐拆开的原则,可得到离子方程式为;
【小问5详解】
实验室制备氢氧化铁胶体需要在沸水中滴加饱和氯化铁溶液,反应方程式为。
17. 下图是一些单质及其化合物之间的转化关系图。常温常压下,D、F、K均为无色无刺激性气味的气体,B是最常见的无色液体,A是由单质C在D中燃烧生成的淡黄色固体。(反应中生成的部分物质已略去)
回答下列问题:
(1)物质A、I的化学式为__________、__________。
(2)单质C的实验室保存方法是__________。
(3)反应③的化学方程式为__________。
(4)写出反应①的化学方程式并用双线桥法表示电子转移的方向和数目:__________,该反应中氧化剂与还原剂质量之比为__________。
(5)反应④的化学方程式为__________。
【答案】(1) ①. ②.
(2)保存在煤油(或石蜡油)中
(3)
(4) ①. ②. 18:23
(5)
【解析】
【分析】常温常压下,D、F、K均为无色无刺激性气味的气体;A是由单质C在D中燃烧生成的淡黄色固体,A应为Na2O2,B是最常见的无色液体,B应为H2O,则D为O2,E为NaOH,过氧化钠和水生成氢氧化钠和氧气;C为Na,F为H2,钠和水生成氢氧化钠和氢气;氢氧化钠和二氧化碳生成碳酸氢钠和水,则K为CO2,H为Na2CO3;碳酸钠和二氧化碳生成碳酸氢钠,碳酸氢钠受热分解生成碳酸钠,则I为NaHCO3;
【小问1详解】
由分析可知,A、I分别为、;
【小问2详解】
钠会和空气中氧气和水反应,故保存在煤油(或石蜡油)中;
【小问3详解】
反应③为过氧化钠和水生成氢氧化钠和氧气,化学方程式为;
小问4详解】
反应①为钠和水生成氢氧化钠和氢气,反应中钠失去电子化合价由0变为+1,发生氧化反应、水中氢得到电子化合价由+1变为0,发生还原反应,双线桥表示为:,该反应中水为氧化剂,还原剂为钠,两者的质量之比为(2×18):(2×23)=18:23;
【小问5详解】
反应④为氢氧化钠和二氧化碳生成碳酸钠,化学方程式为。
18. 有一瓶澄清的无色溶液,其中可能含有、、、、、、、。取该溶液进行以下实验:
(1)由题干可知溶液中一定不存在___________(填离子符号,下同);用pH试纸检验,溶液呈强酸性,可以排除___________的存在。
(2)取出部分溶液滴加过量的NaOH溶液,只产生白色沉淀,则可证明___________(填离子符号)的存在,生成白色沉淀的离子方程式为___________。
(3)取出部分上述碱性溶液滴加Na2SO4溶液,有白色沉淀生成,证明___________(填离子符号,下同)的存在,同时可排除原溶液中___________的存在,产生白色沉淀的离子方程式为___________。
(4)根据上述实验事实可知原溶液中一定存在的离子有___________,不确定是否存在的离子有___________。
【答案】(1) ①. Fe3+ ②.
(2) ①. Mg2+ ②.
(3) ①. Ba2+ ②. ③.
(4) ①. H+、Mg2+、Ba2+ ②. Na+
【解析】
【小问1详解】
由于是澄清的无色溶液,可排除黄色的Fe3+的存在;用 pH 试纸检验,表明溶液呈强酸性,说明有氢离子,根据离子共存要求,则离子不能存在;
【小问2详解】
取出部分溶液逐滴加入NaOH溶液,使溶液从酸性逐渐变为碱性,继续滴加 NaOH 溶液,有白色沉淀氢氧化镁产生,可证明Mg2+的存在,产生白色沉淀的离子方程式为;
【小问3详解】
取部分上述碱性溶液加Na2SO4溶液,有白色沉淀生成,证明Ba2+的存在,因为原溶液为澄清溶液,又可以排除的存在,产生白色沉淀的离子方程式为;
【小问4详解】
根据上述分析,溶液还应存在有阴离子,所以Cl-一定存在,根据上述分析Cl-、H+、Mg2+和Ba2+一定存在,无法确定的是Na+,故答案为:Cl-、H+、Mg2+、Ba2+;Na+。
19. 作为一种广泛的消毒剂,它密度比空气大,易溶于水而难溶于有机溶剂,实验室用与干燥的反应制得和NaCl。下图是实验室用于制备和收集一定量纯净的的装置(某些夹持装置和垫持用品省略)。其中E中盛有液体(用于除去中的未反应的,氧气几乎不溶于饱和食盐水)。
(1)仪器P的名称是__________。
(2)请写出装置A中烧瓶内发生反应的化学方程式:__________,每转移4个电子时,产生分子的个数为__________。
(3)B、C装置中所盛试剂分别是__________、__________。
(4)F为收集装置,应选用的装置是__________(填序号),其中与装置E导管相连的导管口是__________(填接口字母)。
(5)装置D中发生反应的化学方程式为__________。
(6)与NaOH反应可以得到以NaClO为有效成分的漂白液,漂白液与洁厕灵(主要成分为HCl)同时使用会产生,请用离子方程式表示该反应__________。
【答案】(1)分液漏斗
(2) ①. ②. 2
(3) ①. 饱和食盐水 ②. 浓硫酸
(4) ①. ② ②. c
(5)
(6)
【解析】
【分析】装置A中浓盐酸和二氧化锰共热制备氯气,装置B中盛放饱和食盐水用于除去氯气中的氯化氢,装置C中盛放浓硫酸用于干燥氯气,装置D中干燥的氯气和反应,装置E中液体用于除去中的未反应的,易溶于水密度比空气大,装置F可用向上排空气法收集,装置G作为安全瓶,最后选用碱液处理尾气,防止污染空气。
【小问1详解】
仪器P的名称是分液漏斗;
【小问2详解】
二氧化锰和浓盐酸在加热条件下生成氯气、氯化锰、水:;电子转移情况为:,每转移4个电子时,产生分子的个数为2个;
【小问3详解】
由分析可知,B、C装置中所盛试剂分别是饱和食盐水、浓硫酸;
【小问4详解】
由分析可知,F为收集装置,应选用的装置是向下排空气法装置②,气体应该长进短出,故其中与装置E导管相连的导管口是c;
【小问5详解】
与干燥的反应制得和NaCl,中氯元素化合价由+3变为+4、氯气中氯元素化合价由0变为-1,结合电子守恒可知,反应为;
【小问6详解】
漂白液中次氯酸钠与洁厕灵中HCl发生归中反应生成氯气、水,反应。
选项
实验操作和现象
结论
A
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色
该溶液中一定含有钠元素
B
取少量氧化钠固体在空气中继续加热,固体变为淡黄色
氧化钠与氧气生成过氧化钠
C
取久置的粉末,向其中滴加过量的盐酸,产生无色气体
没有变质
D
将金属钠在燃烧匙中点燃,迅速伸入集满的集气瓶中,瓶中产生大量的烟和黑色颗粒
黑色颗粒是炭
选项
实验操作和现象
结论
A
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色
该溶液中一定含有钠元素
B
取少量氧化钠固体在空气中继续加热,固体变为淡黄色
氧化钠与氧气生成过氧化钠
C
取久置的粉末,向其中滴加过量的盐酸,产生无色气体
没有变质
D
将金属钠在燃烧匙中点燃,迅速伸入集满的集气瓶中,瓶中产生大量的烟和黑色颗粒
黑色颗粒是炭
相关试卷
这是一份吉林省长春市2023_2024学年高一化学上学期11月期中试题含解析,共13页。
这是一份吉林省四平市2023_2024学年高二化学上学期期中试题含解析,共24页。试卷主要包含了本卷主要考查内容等内容,欢迎下载使用。
这是一份吉林省十一校联考2023_2024学年高一化学上学期期中试题pdf,共7页。









