


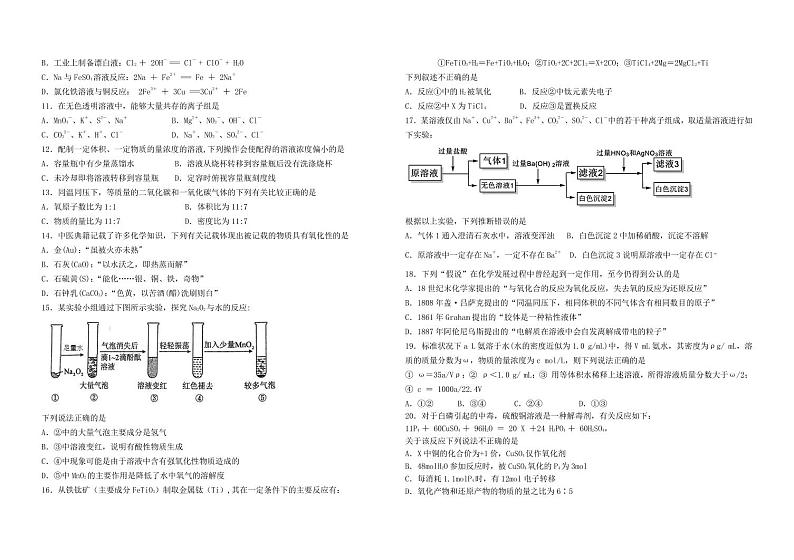

黑龙江省哈尔滨市师范大学附属中学2024-2025学年高一上学期期中考试化学试题
展开
这是一份黑龙江省哈尔滨市师范大学附属中学2024-2025学年高一上学期期中考试化学试题,文件包含黑龙江省哈尔滨市师范大学附属中学2024-2025学年高一上学期期中考试化学试题docx、高一pdf、答案docx等3份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
考试时间:90分钟试卷满分:100分
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟。
注意事项:
1.答题前,务必将自己的条形码粘贴在答题卡规定的位置上。
2.答选择题时,必须使用2B铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦擦干净后,再选涂其它答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定的位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
5.考试结束后,只将答题卡交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cl-35.5 Ag-108 I-127
第Ⅰ卷(选择题,共45分)
一、选择题(本题包括20小题,其中1-15小题,每小题2分;16-20小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.下列说法中,不正确的是
A.燃烧一定伴有发光现象 B.燃烧一定是氧化还原反应
C.燃烧一定要有氧气参加 D.燃烧一定会放出热量
2.在相同体积、相同物质的量浓度的酸中,一定相等的是
A.溶质的质量 B.溶质的质量分数
C.溶质的物质的量 D.氢离子的物质的量
3.下列转化中,需要加入氧化剂才能实现的是
A.MnO4―→Mn2+ B.Cl2→ClO―
C.Cr2O72―→CrO42― D.S2―→HSO3―
4.催雨剂的主要成分可以是干冰、液氮、碘化银(AgI)等,它们分别属于氧化物、单质和盐。下列物质与上述三种物质类别完全不同的是
A. O3 B. K2SO4 C. NO2 D. HNO3
5.下列实验操作规范的是
A.过滤 B.排空气法收集CO2 C.稀释浓硫酸 D.溶液的转移
6.下列有关氯及其化合物的说法正确的是
A.氯气能使鲜花褪色是因为有次氯酸生成
B.铁丝在氯气中燃烧,产生棕褐色的烟,加水溶解后,溶液呈浅绿色
C.工业上将Cl2通入澄清石灰水制取漂白粉
D.Cl2具有很强的氧化性,在化学反应中只能作氧化剂
7.下列关于钠及其化合物的说法不正确的是
A.室温下,Na在空气中反应生成Na2O2
B.可以用焰色试验检验NaCl溶液中的阳离子,其焰色为黄色
C.NaHCO3可用于治疗胃酸过多
D.水与钠反应时,水表现出氧化性
8.下列叙述中正确的是
A.是否能产生丁达尔效应是胶体和溶液最本质的区别
B.固体硫酸钠不导电,所以固体硫酸钠是非电解质
C.二氧化碳水溶液能导电,所以二氧化碳是电解质
D.分散质粒子大小介于1~100 nm之间的分散系称为胶体
9.2018年11月16日,第26届国际计量大会重新定义了阿伏加德罗常数(NA)的准确值为6.02214076×1023。下列说法正确的是
A.用23.5 g AgI与水制成的胶体中,AgI胶体粒子数目为0.1 NA
B.1 ml氧的质量是32 g
C.1.06 g Na2CO3含有的Na+数目为0.02 NA
D.通常状况下,NA个CO2分子占有的体积为22.4 L
10.下列化学方程式或离子方程式中,正确的是
A.氨水与醋酸溶液反应:H+ + NH3·H2O === NH4+ + H2O
B.工业上制备漂白液:Cl2 + 2OH- === Cl- + ClO- + H2O
C.Na与FeSO4溶液反应:2Na + Fe2+ === Fe + 2Na+
D.氯化铁溶液与铜反应: 2Fe3+ + 3Cu ===3Cu2+ + 2Fe
11.在无色透明溶液中,能够大量共存的离子组是
A.MnO4―、K+、S2―、Na+ B.Mg2+、NO3―、OH―、Cl―
C.CO32―、K+、H+、Cl― D.Na+、NO3―、SO42―、Cl―
12.配制一定体积、一定物质的量浓度的溶液,下列操作会使配得的溶液浓度偏小的是
A.容量瓶中有少量蒸馏水 B.溶液从烧杯转移到容量瓶后没有洗涤烧杯
C.未冷却即将溶液转移到容量瓶 D.定容时俯视容量瓶刻度线
13.同温同压下,等质量的二氧化碳和一氧化碳气体的下列有关比较正确的是
A.氧原子数比为1:1 B.体积比为11:7
C.物质的量比为11:7 D.密度比为11:7
14.中医典籍记载了许多化学知识,下列有关记载体现出被记载的物质具有氧化性的是
A.金(Au):“虽被火亦未熟"
B.石灰(CaO):“以水沃之,即热蒸而解”
C.石硫黄(S):“能化……银、铜、铁,奇物”
D.石钟乳(CaCO3):“色黄,以苦酒(醋)洗刷则白”
15.某实验小组通过下图所示实验,探究Na2O2与水的反应:
下列说法正确的是
A.②中的大量气泡主要成分是氢气
B.③中溶液变红,说明有酸性物质生成
C.④中现象可能是由于溶液中含有强氧化性物质造成的
D.⑤中MnO2的主要作用是降低了水中氧气的溶解度
16.从铁钛矿(主要成分FeTiO3)制取金属钛(Ti),其在一定条件下的主要反应有:
①FeTiO3+H2=Fe+TiO2+H2O;②TiO2+2C+2Cl2=X+2CO;③TiCl4+2Mg=2MgCl2+Ti
下列叙述不正确的是
A.反应①中的H2被氧化 B.反应②中钛元素失电子
C.反应②中X为TiCl4 D.反应③是置换反应
17.某溶液仅由Na+、Cu2+、Ba2+、Fe3+、CO32-、SO42-、Cl-中的若干种离子组成,取适量溶液进行如下实验:
根据以上实验,下列推断错误的是
A.气体1通入澄清石灰水中,溶液变浑浊 B.白色沉淀2中加稀硝酸,沉淀不溶解
C.原溶液中一定存在Na+,一定不存在Ba2+ D.白色沉淀3说明原溶液中一定存在Cl−
18.下列“假说”在化学发展过程中曾经起到一定作用,至今仍得到公认的是
A.18世纪末化学家提出的“与氧化合的反应为氧化反应,失去氧的反应为还原反应”
B.1808年盖·吕萨克提出的“同温同压下,相同体积的不同气体含有相同数目的原子”
C.1861年Graham提出的“胶体是一种粘性液体”
D.1887年阿伦尼乌斯提出的“电解质在溶液中会自发离解成带电的粒子”
19.标准状况下a L氨溶于水(水的密度近似为1.0 g/mL)中,得V mL氨水,其密度为ρg/ mL,溶质的质量分数为ω,物质的量浓度为c ml/L,则下列说法正确的是
① ω=35a/Vρ;② ρ<1.0 g/ mL;③ 用等体积水稀释上述溶液,所得溶液质量分数大于ω/2;④ c = 1000a/22.4V
A.①② B.③④ C.②④ D.①③
20.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:
11P4 + 60CuSO4 + 96H2O = 20 X +24 H3PO4 + 60H2SO4,
关于该反应下列说法不正确的是
A.X中铜的化合价为+1价,CuSO4仅作氧化剂
B.48mlH2O参加反应时,被CuSO4氧化的P4为3ml
C.每消耗1.1mlP4时,有12ml电子转移
D.氧化产物和还原产物的物质的量之比为6∶5
第Ⅱ卷(选择题,共55分)
21. (14分)已知下列物质:
①金刚石 ②石墨 ③冰水混合物 ④纯净无污染的空气 ⑤红磷 ⑥白磷 ⑦食盐水 ⑧氧化钠 ⑨胆矾 ⑩CuSO4溶液 ⑪氧化钙
(1)属于混合物的是___________(填序号,下同),属于单质的是___________,属于化合物的是___________,属于电解质的是___________。
(2)上述物质中能导电的是___________。
(3)属于由同种元素组成的不同单质的是___________。
(4)下列变化不属于化学变化的是___________(填字母)。
A.石墨转化成金刚石 B.冰融化成冰水混合物
C.氧化钙溶于水 D.无水硫酸铜遇水变蓝
E.泥水中加入Fe(OH)3胶体
22. (12分)海洋是一个巨大的化学资源宝库,其中钠元素和氯元素是海洋中含量较高的元素。生活中也有很多含钠、含氯的化合物。请结合所学化学知识,回答下列问题。
(1)过氧化钠可以在潜水艇和消防员的呼吸面具中作为氧气来源。若只考虑过氧化钠与二氧化碳反应,每消耗1ml过氧化钠固体、反应转移电子数为 。
(2)漂白粉广泛用于环境的消毒、杀菌。漂白粉溶于水后,与空气中的二氧化碳反应,能生成具有强漂白性的物质。请用离子方程式表示该过程: 。
(3)“84消毒液”能有效杀灭病毒,某同学购买了瓶“84消毒液”,其说明中有如下信息:NaClO质量分数为25%、密度为1.19g·cm-3、1000mL、请稀释后使用。
①该“84消毒液”中NaClO的物质的量浓度为 ml·L-1。(保留至小数点后一位)
②现实验室需要480mL0.2 ml·L-1的NaClO溶液,某同学用NaClO固体配制该物质的量浓度的溶液。应用托盘天平称取NaCl0固体 g。配制NaClO溶液时需用的主要仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、 、 。
③实验时遇到下列情况,会导致溶液物质的量浓度偏高的是 (填标号)。
A.容量瓶内壁附有水珠而未干燥处理 B.称量使用的砝码已生锈
C.溶解时使用的烧杯及玻璃棒未洗涤 D.溶解后没有冷却便进行定容
E.定容时俯视刻度线 F.摇匀后发现液面低于刻度线后未做处理
23.(14分) A、B、C、D为四种可溶性的盐,它们包含的阳离子和阴离子分别为Ba2+、Fe2+、Na+、Cu2+和NO3-、SO42-、Cl-、CO32- (离子在物质中不能重复出现)。
①若把四种盐分别溶于盛有蒸馏水的四支试管中,观察到C盐的溶液呈蓝色,且C盐固体中阴阳离子个数之比为1:1;
②若向①的四支试管中分别加入足量稀盐酸,只有D的盐溶液有无色无味的气体逸出;
③向B盐溶液中加入硝酸酸化的AgNO3溶液,有白色沉淀产生;
④A盐溶液与C盐溶液混合后有白色沉淀产生。
(1)根据以上实验事实可推断它们的化学式为:C___________;D___________。
(2)写出足量稀盐酸与D盐溶液反应放出气体的离子方程式: 。
(3)写出④中发生反应的离子方程式: 。
(4)向B盐与C盐的混合溶液中加入一定量的Zn粉,可能发生的反应有 (按照反应的先后顺序写出相应的离子方程式)。若加入Zn粉后,有金属析出,过滤、洗涤后向滤渣中加入稀盐酸,无气体产生,则滤液中一定含有的金属阳离子为 。
24.(15分)某小组探究酸化条件对0.1ml/L KI溶液氧化反应的影响。
(1)溶液变蓝,说明溶液中含有 。结合实验1和实验2,该小组同学认为酸化能够加快I-氧化反应的速率。
(2)同学甲对滴加稀硫酸后溶液变蓝速率不同的原因提出猜想:放置一段时间后的0.1ml/L KI溶液成分与新制0.1ml/L KI溶液可能存在差异,并继续进行实验3。取新制的0.1ml/L KI溶液在空气中放置,测得pH如下:
资料:
ⅰ. pH是描述溶液酸碱性的常用方法。常温下,pH=7的溶液呈中性,pH>7的溶液呈碱性,且c(OH-)越大、pH越大、溶液的碱性越强。
ⅱ. pH<11.7时,I-能被O2氧化为I2。
ⅲ.一定碱性条件下,I2容易发生歧化反应,产物中氧化产物与还原产物的物质的量之比为1∶5。
①用离子方程式表达资料ⅲ中I2所发生反应的方程式: 。
②依据实验3,用离子方程式解释0.1ml/L KI溶液放置初期pH升高的原因: 。
③对比实验1和实验2,用离子方程式解释实验1中加稀硫酸后“溶液立即变蓝”的主要原因可能是______。
④同学甲进一步设计实验验证分析的合理性。
(3)该组同学想进一步探究pH对I2发生歧化反应的影响,进行了如下实验。
实验5:用20mL4种不同浓度的KOH溶液与2mL淀粉溶液进行混合,测量混合液的pH后,向其中加入2滴饱和碘水,观察现象。记录如下:
①从实验5可以看出pH越大,歧化反应速率越_________(填“快”或“慢”)。
②从反应速率的角度解释pH=8.4时,“产生蓝色,30s后蓝色消失”的原因: 。序号
操作及现象
实验1
取放置一段时间的0.1ml/L KI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6 ml/L的稀硫酸,溶液立即变蓝
实验2
取新制的0.1ml/L KI溶液,加入淀粉溶液,溶液不变蓝;向溶液中继续加入2滴6 ml/L的稀硫酸,溶液10s后微弱变蓝
实验3
时间
5分钟
1天
3天
10天
pH
7.2
7.4
7.8
8.7
序号
操作
现象
实验4
重复实验2操作后,继续向溶液中加入 。
溶液立即变蓝
实验5
A
B
C
D
pH
11.4
10.6
9.5
8.4
现象
无颜色变化
产生蓝色后瞬间消失
产生蓝色,30s后蓝色消失
相关试卷
这是一份黑龙江省哈尔滨市师范大学附属中学2024-2025学年高一上学期期中考试化学试题,文件包含黑龙江省哈尔滨市师范大学附属中学2024-2025学年高一上学期期中考试化学试题docx、高一pdf、答案docx等3份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。
这是一份黑龙江省哈尔滨师范大学附属中学2024-2025学年高三上学期期中考试 化学试题,文件包含试卷初稿docx、试卷答案docx等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。
这是一份北京师范大学附属中学2024-2025学年高一上学期期中考试 化学试题,共13页。









