

所属成套资源:备战2025年高考化学(广东版)二轮复习专题练习(Word版附解析)
备战2025年高考二轮复习化学(广东版)大单元主观题突破练5(Word版附解析)
展开
这是一份备战2025年高考二轮复习化学(广东版)大单元主观题突破练5(Word版附解析),共9页。试卷主要包含了60 g,色谱检测纯度为98,2 mL密度为1,20% ③AB等内容,欢迎下载使用。
学生用书P247
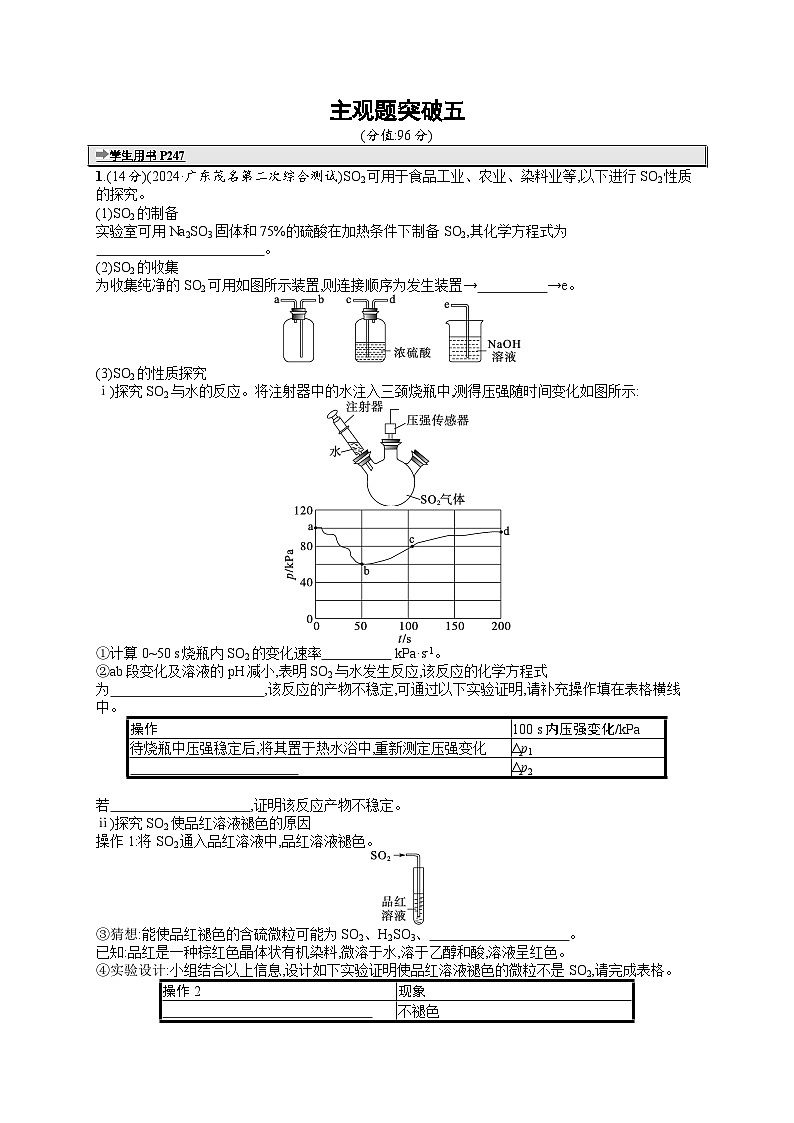
1.(14分)(2024·广东茂名第二次综合测试)SO2可用于食品工业、农业、染料业等,以下进行SO2性质的探究。
(1)SO2的制备
实验室可用Na2SO3固体和75%的硫酸在加热条件下制备SO2,其化学方程式为 。
(2)SO2的收集
为收集纯净的SO2可用如图所示装置,则连接顺序为发生装置→ →e。
(3)SO2的性质探究
ⅰ)探究SO2与水的反应。将注射器中的水注入三颈烧瓶中,测得压强随时间变化如图所示:
①计算0~50 s烧瓶内SO2的变化速率 kPa·s-1。
②ab段变化及溶液的pH减小,表明SO2与水发生反应,该反应的化学方程式为 ,该反应的产物不稳定,可通过以下实验证明,请补充操作填在表格横线中。
若 ,证明该反应产物不稳定。
ⅱ)探究SO2使品红溶液褪色的原因
操作1:将SO2通入品红溶液中,品红溶液褪色。
③猜想:能使品红褪色的含硫微粒可能为SO2、H2SO3、 。
已知:品红是一种棕红色晶体状有机染料,微溶于水,溶于乙醇和酸,溶液呈红色。
④实验设计:小组结合以上信息,设计如下实验证明使品红溶液褪色的微粒不是SO2,请完成表格。
答案:(1)Na2SO3+H2SO4Na2SO4+H2O+SO2↑
(2)c→d→b→a
(3)①0.8 ②SO2+H2OH2SO3 将装有等量未溶解SO2的蒸馏水的烧瓶置于热水浴中加热100 s,测定压强变化 Δp1>Δp2 ③HSO3-、SO32- ④将SO2通入品红的乙醇溶液
解析:Na2SO3固体和75%的硫酸在加热条件下反应可生成SO2,用浓硫酸干燥二氧化硫,用向上排空气法收集,最后用氢氧化钠溶液吸收尾气,防止污染。
(1)Na2SO3固体与75%硫酸反应生成SO2、硫酸钠和水,该反应的化学方程式为Na2SO3+H2SO4Na2SO4+H2O+SO2↑。
(2)为收集纯净的SO2,先用浓硫酸干燥,再用向上排空气法收集,最后用氢氧化钠溶液吸收尾气,则连接顺序为发生装置→c→d→b→a→e。
(3)①0~50 s烧瓶内SO2的变化速率为(100-60) kPa50 s=0.8 kPa·s-1。②ab段变化及溶液的pH减小,表明SO2与水发生反应SO2+H2OH2SO3,待烧瓶中压强稳定后,将其置于热水浴中加热100 s,测定压强变化为Δp1;将装有等量未溶解SO2的蒸馏水的烧瓶置于热水浴中加热100 s,测定压强变化Δp2,若Δp1>Δp2,证明该反应产物不稳定。③能使品红溶液褪色的含硫微粒可能为SO2、H2SO3、HSO3-、SO32-。④将二氧化硫通入无水的体系中,若品红不褪色,能证明使品红褪色的微粒不是SO2,具体实验操作为:将SO2通入品红的乙醇溶液,溶液不褪色,证明使品红褪色的微粒不是SO2。
2.(14分)(2024·广东广州三模)某小组研究Cu与浓硝酸反应时发现如下现象:
(1)Cu与浓硝酸反应的离子方程式为 。
(2)甲同学猜测溶液A不是蓝色而呈绿色与溶解了NO2有关,于是向溶液B中通入NO2,然后持续通入一段时间N2,观察到现象: ,证实猜测合理。
甲同学为深入研究溶液A呈绿色的原因,查得如下资料并提出了新的假设:
假设一:A中形成了[Cu(NO2)4]2-使溶液呈绿色。
为了验证假设一的合理性,甲同学进行了如下实验:
【实验一】
(3)操作②的目的是 。
(4)乙同学向①所得溶液中滴加浓硫酸,使溶液中c(H+)≈8 ml·L-1,观察到有无色气体放出(遇空气变为红棕色),溶液很快变回蓝色。利用平衡移动原理解释溶液变蓝的原因: 。
(5)综合甲、乙两位同学的实验,假设一不成立。请说明理由: 。
乙同学查得如下资料并提出来另一种假设:
假设二:A中浓硝酸溶解了NO2所得黄色溶液与Cu2+的蓝色复合形成的绿色。
为验证假设二的合理性,乙同学进行了如下实验:
【实验二】
(6)操作②中加入的试剂为 ,操作③进一步证明了假设二的合理性,写出该操作: 。溶液变回蓝色可能的原因是 (用化学方程式表示)。
答案:(1)Cu+4H++2NO3-Cu2++2H2O+2NO2↑
(2)通入NO2后溶液呈绿色,通入一段N2后变蓝
(3)证明NO2溶于水时没有颜色变化,排除这一因素在①中的干扰
(4)加入浓硫酸后,温度升高且c(H+)增大,HNO2分解导致c(HNO2)下降,均引起平衡HNO2NO2-+H+逆向移动,c(NO2-)下降,Cu2+(蓝色)+4NO2-[Cu(NO2)4]2-(绿色)平衡逆向移动,溶液颜色由绿色变为蓝色
(5)加酸且升温后,溶液变为蓝色,说明酸性较强的热溶液A中NO2-能大量存在,因此[Cu(NO2)4]2-也不能大量存在,[Cu(NO2)4]2-不是溶液A呈绿色的主要原因
(6)0.5 ml Cu(NO3)2 加水稀释 3NO2+H2O2HNO3+NO
解析:(1)Cu与浓硝酸反应生成硫酸铜、NO2和H2O,该反应的离子方程式为Cu+4H++2NO3-Cu2++2H2O+2NO2↑。
(2)甲同学猜测溶液A不是蓝色而呈绿色与溶解了NO2有关,于是向溶液B中通入NO2,溶液变成绿色,然后持续通入一段时间N2,目的是将NO2吹出,进一步确认NO2的影响,因此通入一段时间N2后溶液又变成蓝色。
(3)操作②是对比实验,可证明NO2溶于水时没有颜色变化,排除这一因素在①中的干扰。
(4)结合资料可知,由于加入浓硫酸后,温度升高且c(H+)增大,HNO2分解导致c(HNO2)下降,引起平衡HNO2NO2-+H+逆向移动,同时产生无色气体,c(NO2-)下降,Cu2+(蓝色)+4NO2-[Cu(NO2)4]2-(绿色)平衡逆向移动,所以溶液颜色由绿色变为蓝色。
(5)根据题干信息,所用Cu和HNO3的量中HNO3过量,根据方程式可知,A中存有大量HNO3,酸性很强,而加酸后溶液变为蓝色,说明酸性较强的溶液中NO2-不能大量存在,因此[Cu(NO2)4]2-也不能大量存在,[Cu(NO2)4]2-不是溶液A呈绿色的主要原因,故假设一不成立。
(6)根据控制变量法,操作②中加入的试剂应与实验一相同,即为20.0 mL 0.5 ml·L-1 Cu(NO3)2溶液;根据资料ⅳ,稀硝酸中溶有少量NO2时呈无色,因此可采用加水稀释的方法,发生反应的化学方程式为3NO2+H2O2HNO3+NO。
3.(14分)(2024·全国甲卷)CO(NH2)2·H2O2(俗称过氧化脲)是一种消毒剂,实验室中可用尿素与过氧化氢制取,反应方程式如下:CO(NH2)2+H2O2CO(NH2)2·H2O2。
(一)过氧化脲的合成
烧杯中分别加入25 mL 30% H2O2(ρ=1.11 g·cm-3)、40 mL蒸馏水和12.0 g尿素,搅拌溶解。30 ℃下反应40 min,冷却结晶、过滤、干燥,得白色针状晶体9.4 g。
(二)过氧化脲性质检测
Ⅰ.过氧化脲溶液用稀硫酸酸化后,滴加KMnO4溶液,紫红色消失。
Ⅱ.过氧化脲溶液用稀硫酸酸化后,加入KI溶液和四氯化碳,振荡,静置。
(三)产品纯度测定
溶液配制:称取一定量产品,用蒸馏水溶解后配制成100 mL溶液。
滴定分析:量取25.00 mL过氧化脲溶液至锥形瓶中,加入一定量稀硫酸,用准确浓度的KMnO4溶液滴定至微红色,记录滴定体积,计算纯度。
回答下列问题:
(1)过滤中使用到的玻璃仪器有 (写出两种即可)。
(2)过氧化脲的产率为 。
(3)性质检测Ⅱ中的现象为 。性质检测Ⅰ和Ⅱ分别说明过氧化脲具有的性质是 。
(4)下图为“溶液配制”的部分过程,操作a应重复3次,目的是 ,定容后还需要的操作为 。
(5)“滴定分析”步骤中,下列操作错误的是 (填字母)。
A.KMnO4溶液置于酸式滴定管中
B.用量筒量取25.00 mL过氧化脲溶液
C.滴定接近终点时,用洗瓶冲洗锥形瓶内壁
D.锥形瓶内溶液变色后,立即记录滴定管液面刻度
(6)以下操作导致过氧化脲纯度测定结果偏低的是 (填字母)。
A.容量瓶中液面超过刻度线
B.滴定管水洗后未用KMnO4溶液润洗
C.摇动锥形瓶时KMnO4溶液滴到锥形瓶外
D.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
答案:(1)烧杯、漏斗、玻璃棒(任选两种作答)
(2)50%
(3)液体分层,上层为无色,下层为紫红色 还原性、氧化性
(4)避免溶质损失 盖好瓶塞,反复上下颠倒、摇匀
(5)BD (6)A
解析:(1)过滤操作需要的玻璃仪器有烧杯、漏斗、玻璃棒,可任选两种作答。
(2)实验中加入尿素的质量为12.0 g,物质的量为0.2 ml,过氧化氢的质量为25 mL×1.11 g·cm-3×30%=8.325 g,物质的量约为0.245 ml,过氧化氢过量,产率应按照尿素的质量计算,理论上可得到过氧化脲0.2 ml,质量为0.2 ml×94 g·ml-1=18.8 g,实验中实际得到过氧化脲为9.4 g,故过氧化脲的产率为9.4 g18.8 g×100%=50%。
(3)在过氧化脲的性质检测中,检测Ⅰ用稀硫酸酸化,加入高锰酸钾溶液,紫红色消失,说明过氧化脲被酸性高锰酸钾溶液氧化,体现了过氧化脲的还原性;检测Ⅱ用稀硫酸酸化,加入KI溶液和四氯化碳,过氧化脲会将KI氧化为I2单质,体现了过氧化脲的氧化性,生成的I2在四氯化碳中溶解度大,会溶于四氯化碳中,且四氯化碳密度大于水的,振荡,静置后出现的现象为液体分层,上层为无色,下层为紫红色。
(4)操作a为洗涤烧杯和玻璃棒,并将洗涤液转移到容量瓶中,目的是避免溶质损失;定容后应盖好瓶塞,反复上下颠倒、摇匀。
(5)KMnO4溶液具有强氧化性,应置于酸式滴定管中,A项正确;量筒的精确度不能达到0.01 mL,量取25.00 mL的溶液应选用滴定管或移液管,B项错误;滴定过程中,待测液有可能会溅到锥形瓶内壁,滴定接近终点时,为了使结果更精确,可用洗瓶冲洗锥形瓶内壁,C项正确;锥形瓶内溶液变色后,且半分钟内溶液不再恢复原来的颜色,才能说明反应达到滴定终点,记录滴定管液面刻度,D项错误。
(6)在配制过氧化脲溶液时,容量瓶中液面超过刻度线,使溶液体积偏大,配制溶液的浓度偏低,则滴定过程中消耗的KMnO4溶液体积偏低,导致测定结果偏低,A项符合题意;滴定管水洗后未用KMnO4溶液润洗,导致KMnO4溶液浓度偏低,使滴定过程中消耗的KMnO4溶液体积偏高,导致测定结果偏高,B项不符合题意;摇动锥形瓶时KMnO4溶液滴到锥形瓶外,使滴定过程中消耗的KMnO4溶液体积偏高,导致测定结果偏高,C项不符合题意;滴定前滴定管尖嘴处有气泡,滴定后气泡消失,使滴定过程中消耗的KMnO4溶液体积偏高,导致测定结果偏高,D项不符合题意。
4.(14分)(2024·黑吉辽卷)某实验小组为实现乙酸乙酯的绿色制备及反应过程可视化,设计实验方案如下:
Ⅰ.向50 mL烧瓶中分别加入5.7 mL乙酸(100 mml)、8.8 mL乙醇(150 mml)、1.4 g NaHSO4固体及4~6滴1‰甲基紫的乙醇溶液。向小孔冷凝柱中装入变色硅胶。
Ⅱ.加热回流50 min后,反应液由蓝色变为紫色,变色硅胶由蓝色变为粉红色,停止加热。
Ⅲ.冷却后,向烧瓶中缓慢加入饱和Na2CO3溶液至无CO2逸出,分离出有机相。
Ⅳ.洗涤有机相后,加入无水MgSO4,过滤。
Ⅴ.蒸馏滤液,收集73~78 ℃馏分,得无色液体6.60 g,色谱检测纯度为98.0%。
回答下列问题:
(1)NaHSO4在反应中起 作用,用其代替浓硫酸的优点是 (答出一条即可)。
(2)甲基紫和变色硅胶的颜色变化均可指示反应进程。变色硅胶吸水,除指示反应进程外,还可 。
(3)使用小孔冷凝柱承载,而不向反应液中直接加入变色硅胶的优点是 (填字母)。
A.无需分离
B.增大该反应平衡常数
C.起到沸石作用,防止暴沸
D.不影响甲基紫指示反应进程
(4)下列仪器中,分离有机相和洗涤有机相时均需使用的是 (填名称)。
(5)该实验乙酸乙酯的产率为 (精确至0.1%)。
(6)若改用C2H518OH作为反应物进行反应,质谱检测目标产物分子离子峰的质荷比数值应为 (精确至1)。
答案:(1)催化剂 浓硫酸具有脱水性,使原料炭化,NaHSO4无脱水性,使产品产率更高(或其他合理答案:)
(2)吸收生成的H2O,使平衡正向移动,提高乙酸乙酯的产率
(3)AD (4)分液漏斗 (5)73.5% (6)90
解析:乙酸乙酯的制备原理为
其中浓硫酸的作用为催化剂和吸水剂,既能催化反应,加快反应速率,又能吸收反应生成的水,使平衡正向移动,增大产率。本题所给实验中用NaHSO4代替浓硫酸起催化作用,用能吸水的变色硅胶吸水,使平衡正向移动,冷却后用Na2CO3溶液将剩余的酸性物质反应掉,用无水MgSO4干燥产品,最后蒸馏收集73~78 ℃馏分获得产品乙酸乙酯。
(1)用NaHSO4代替浓硫酸起催化作用,因为浓硫酸有脱水性,能够将反应原料炭化,而NaHSO4无脱水性,可提高产品产率。同时还有减少有毒气体(SO2)的产生等其他优点。
(2)变色硅胶有吸水性,可吸收反应生成的水,使酯化反应平衡右移,提高产率。
(3)不向溶液中直接加入变色硅胶的优点是后续过程中不用再分离出去,且与甲基紫指示剂分开,不会影响其指示过程。平衡常数只与温度有关。故选A、D。
(4)分离有机相和洗涤有机相均需用分液漏斗进行分液。容量瓶在配制一定物质的量浓度的溶液时使用,普通漏斗在过滤时使用,洗气瓶在除气体中的杂质时使用。
(5)产率=实际产量理论产量×100%。原料中乙酸和乙醇按1∶1反应,显然乙酸比乙醇的量少,利用乙酸的物质的量计算产率:6.60 g×98.0%100×10-3ml×88 g·ml-1×100%=73.5%。
(6)酯化反应中,酸脱羟基醇脱氢,得到的产品应为CH3CO18OCH2CH3,其分子离子峰的质荷比数值为90。
5.(14分)(2024·广东佛山质检二)某合作学习小组将铜片放入氯化铁溶液中,观察到溶液呈无色,产生红褐色固体,铜片表面有白色物质。
Ⅰ.探究红褐色固体的成分
(1)过滤得到红褐色固体,过滤时下列仪器用到的有 (填字母)。
(2)①取少量红褐色固体加盐酸溶解,滴加 溶液,溶液变红色,证明是氢氧化铁。
②产生氢氧化铁的原因可能是 (用化学方程式表示)。
Ⅱ.查阅资料:CuCl是白色难溶物
(3)探究产生白色物质的原因。设计实验方案如下:
①由以上实验可知,产生白色物质的条件是 。
②实验2生成白色物质的化学方程式为 。
③请你从氧化还原反应规律角度分析实验1中未产生白色物质的原因: 。
(4)以石墨为电极电解CuCl2溶液,发现在石墨上析出的铜在切断电源后消失。从电化学角度进行分析,铜消失的原因为 。
(5)基于上述分析,用CuCl2溶液腐蚀覆铜板效果不理想。查阅资料:工业上常用CuCl2、KCl、盐酸混合物腐蚀覆铜板,原理为Cu2++Cu+4Cl-2[CuCl2]-。
①基态Cu+的价层电子轨道表示式为 。
②KCl的作用是 。
(6)氧化还原反应的应用十分广泛。写出一种氧化剂在生活中的应用: 。
答案:(1)BC
(2)①KSCN ②FeCl3+3H2OFe(OH)3+3HCl或4Fe(OH)2+O2+2H2O4Fe(OH)3
(3)①铜粉过量 ②CuCl2+Cu2CuCl ③Fe3+的氧化性强于Cu2+,Fe3+过量时,Cu不与Cu2+反应
(4)析出的铜单质、石墨和氯化铜溶液形成原电池,铜作负极被氧化溶解
(5)① ②提供配体,促使平衡Cu2++Cu+4Cl-2[CuCl2]-正向移动
(6)过氧化氢或次氯酸钠用于杀菌消毒(合理即可)
解析:铜与氯化铁溶液反应生成氢氧化铁,可用酸溶解后加入硫氰化钾溶液进行检验,氯化铜与过量的铜反应可生成白色固体氯化亚铜,通过对比实验中铜的用量的控制可进行验证。
(1)将固体与液体分离需进行过滤,过滤需要的仪器有玻璃棒、漏斗和烧杯,故选BC。
(2)①若红褐色固体为氢氧化铁,加盐酸溶解,溶液中含Fe3+,可用KSCN溶液进行检验,若溶液变红,即可证明。②产生氢氧化铁的原因可能是Fe3+在溶液中水解形成氢氧化铁,化学方程式:FeCl3+3H2OFe(OH)3+3HCl,也可能是氢氧化亚铁被空气氧化为氢氧化铁,化学方程式为4Fe(OH)2+O2+2H2O4Fe(OH)3。
(3)①对比实验中铜的用量可知,产生氯化亚铜的条件是铜粉过量。②生成白色物质氯化亚铜的化学方程式为CuCl2+Cu2CuCl。③Fe3+的氧化性较强,Fe3+过量时将Cu全部氧化为Cu2+,而Cu2+氧化性弱于Fe3+,Fe3+过量时,Cu不与Cu2+反应生成Cu+,则实验1中未产生白色物质。
(4)以石墨为电极电解CuCl2溶液,阴极有铜单质析出,断电后析出的铜单质、石墨和氯化铜溶液又形成原电池,铜作负极发生失电子的氧化反应被溶解。
(5)①Cu的原子序数为29,基态Cu+的价层电子轨道表示式为;②KCl的作用是提供配体,促使平衡Cu2++Cu+4Cl-2[CuCl2]-正向移动。
(6)过氧化氢或次氯酸钠可用于杀菌消毒。
6.(13分)(2024·福建泉州一模)某研究小组利用下图所示装置模拟高炉煤气(主要成分为CO、N2、H2、H2S和少量COS)和金属冶炼厂尾气(含SO2)联合制备Na2S2O3·5H2O。回答下列问题:
Ⅰ.模拟Na2S2O3的制备
步骤一:打开K3,关闭K1、K2,通入高炉煤气。
发生的反应有:丁中COS+H2CO+H2S;乙中H2S+Na2CO3NaHCO3+NaHS。
(1)丙装置的主要作用为 。
(2)当润湿的(CH3COO)2Pb试纸 (填现象),关闭K3,停止通入高炉煤气。
(3)导管b接盛有醋酸亚铜氨溶液的洗气瓶用于吸收CO气体,反应的方程式为CH3COOCu(NH3)2(aq)+CO(g)CH3COOCu(NH3)2·CO(aq) ΔH
相关试卷
这是一份备战2025年高考二轮复习化学(通用版)大单元 选择题突破练5(Word版附解析),共4页。试卷主要包含了下列说法正确的是,化学与社会生活密切相关,9%的NaCl溶液等内容,欢迎下载使用。
这是一份备战2025年高考二轮复习化学(通用版)大单元 选择题突破练8(Word版附解析),共5页。试卷主要包含了006 kPa·min-1,9 kPa-13,氮氧化物的排放是导致酸雨的原因,三甲胺N3是重要的化工原料等内容,欢迎下载使用。
这是一份备战2025年高考二轮复习化学(通用版)大单元 主观题突破练1(Word版附解析),共9页。试卷主要包含了Ga与B、Al处于同一主族等内容,欢迎下载使用。










