

2025年高考化学一轮复习 课时检测七十二:性质探究型综合实验价(含解析)
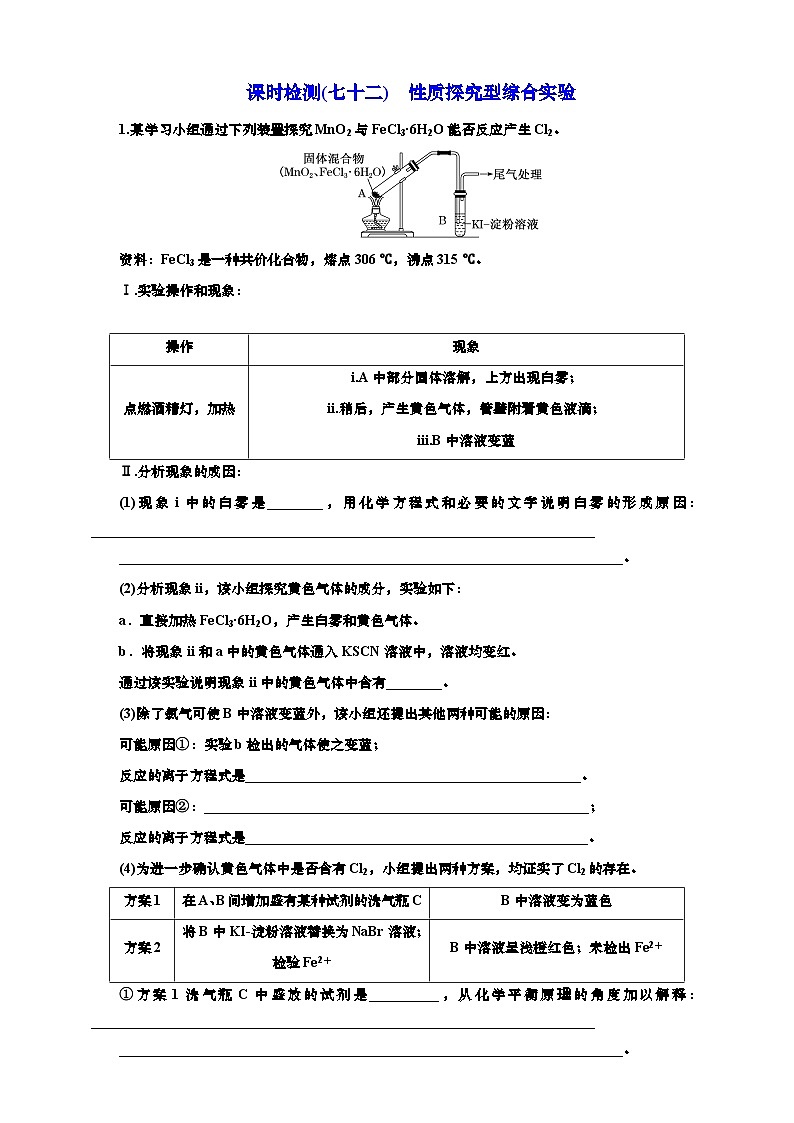
展开资料:FeCl3是一种共价化合物,熔点306 ℃,沸点315 ℃。
Ⅰ.实验操作和现象:
Ⅱ.分析现象的成因:
(1)现象i中的白雾是________,用化学方程式和必要的文字说明白雾的形成原因:________________________________________________________________________
________________________________________________________________________。
(2)分析现象ii,该小组探究黄色气体的成分,实验如下:
a.直接加热FeCl3·6H2O,产生白雾和黄色气体。
b.将现象ii和a中的黄色气体通入KSCN溶液中,溶液均变红。
通过该实验说明现象ii中的黄色气体中含有________。
(3)除了氯气可使B中溶液变蓝外,该小组还提出其他两种可能的原因:
可能原因①:实验b检出的气体使之变蓝;
反应的离子方程式是________________________________________________。
可能原因②:_______________________________________________________;
反应的离子方程式是_________________________________________________。
(4)为进一步确认黄色气体中是否含有Cl2,小组提出两种方案,均证实了Cl2的存在。
①方案1洗气瓶C中盛放的试剂是__________,从化学平衡原理的角度加以解释:________________________________________________________________________
________________________________________________________________________。
②方案2中检验Fe2+的最佳试剂是__________,若存在Fe2+,则现象是________________________________________________________________________。
③综合方案1、2的现象,说明方案2中选择NaBr溶液的依据:________________________________________________________________________。
(5)将A中产物分离得到Fe2O3和MnCl2,则A中产生Cl2的化学方程式是________________________________________________________________________
________________________________________________________________________。
2.过二硫酸钾(K2S2O8)易潮解,易分解,是一种重要的氧化剂。某学习小组设计实验探究过二硫酸钾的性质。
实验(一) 探究过二硫酸钾的强氧化性。
(1)用K2S2O8溶液与KI溶液反应,实验操作与现象如表所示:
①根据碰撞理论分析,实验Ⅰ中K2S2O8和KI反应很慢的主要原因:________________________________________________________________________。
②实验Ⅱ中Fe2+起催化作用,总反应分两步进行:
(ⅰ)2Fe2+ +S2Oeq \\al(2-,8)===2Fe3++2SOeq \\al(2-,4);
(ⅱ)__________________________________________________。
请你补充反应(ⅱ) ,并设计实验证明实验Ⅱ反应后的溶液中含有Fe3+:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(2)查阅文献知,氧化性:S2Oeq \\al(2-,8)>MnOeq \\al(-,4)。在稀硫酸酸化的MnSO4溶液中滴加1滴催化剂AgNO3 溶液,再滴加K2S2O8溶液,实验现象是____________________________________,该反应的离子方程式为_____________________________________________________
________________________________________________________________________。
实验(二) 探究过二硫酸钾的不稳定性。
已知几种物质的熔、沸点如表所示:
取适量的K2S2O8装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(3)加热前,先通入一段时间N2,当观察到D装置中__________________________(填实验现象)时,点燃酒精灯。
(4)B装置的U形管中收集到的物质是__________(填化学式)。
(5)当A装置的硬质玻璃管中固体完全分解时,停止加热。冷却至室温,然后取少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中K2S2O8发生分解的化学方程式:__________________________________________。
3.FeCl3为中学化学中经常使用的物质,某化学实验小组为探究FeCl3的性质,进行了如下实验。
(1)学习小组A向FeCl3溶液中分别加入Na2CO3溶液和Na2SO3溶液,发现有如图所示实验现象:
对于②中的实验现象,学习小组A的同学们有诸多猜测,继续进行实验:小明取少许②中的红棕色溶液于试管中,滴入盐酸酸化的BaCl2溶液,产生白色沉淀。
小明得出结论:FeCl3与Na2SO3发生了氧化还原反应,反应的离子方程式是__________________________________。
小红认为小明的实验不严谨,重新设计实验方案并进行实验,证实了小明的结论是正确的。实验方案及现象:_______________________________________________
________________________________________________________________________。
(2)学习小组B进一步探究FeCl3溶液与足量锌粉的反应。实验操作及实验现象如表所示:
已知:Zn的化学性质与Al相似,能发生反应Zn+2H2O+2NaOH===Na2[Zn(OH)4]+H2↑。
①结合实验现象和平衡移动原理解释出现红褐色沉淀的原因:_______________
________________________________________________________________________
________________________________________________________________________。
②分离出黑色固体,经下列实验证实了其中含有的主要物质成分。
ⅰ.黑色固体可以被磁铁吸引;
ⅱ.向黑色固体中加入足量的NaOH溶液,产生气泡;
ⅲ.将ⅱ中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡;
ⅳ.向ⅲ反应后的溶液中滴加KSCN溶液,无变化。
a.黑色固体中一定含有的物质是_______________________________________。
b.学习小组B的同学认为上述实验无法确定黑色固体中是否含有Fe3O4,理由是________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)为进一步探究1.0 ml·L-1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,学习小组B补充实验并观察到反应开始时的实验现象如表所示:
学习小组B得出结论:在1.0 ml·L-1 FeCl3溶液中,Fe3+的氧化性比H+的强。则表格中横线处应填___________________________________________________________
________________________________________________________________________。
4.以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:________________________________________________________________________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SOeq \\al(2-,4),含有Cu+、Cu2+和SOeq \\al(2-,3)。
已知:Cu+eq \(――→,\s\up7(稀硫酸))Cu+Cu2+,Cu2+eq \(――→,\s\up7(I-),\s\d5())CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是
________________________________________________________________________。
②通过下列实验证实沉淀中含有Cu2+和SOeq \\al(2-,3)。
a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu2+和SOeq \\al(2-,3)的理由是_____________________________________
________________________________________________________________________。
(3)已知:Al2(SO4)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SOeq \\al(2-,4),该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有SOeq \\al(2-,3)和________。
②对于沉淀中SOeq \\al(2-,3)的存在形式提出两种假设:
ⅰ.被Al(OH)3所吸附;ⅱ.存在于铝的碱式盐中。
对假设ⅱ设计了对比实验,证实了假设ⅱ成立。
a.将对比实验方案补充完整。
步骤一:
步骤二(按上图形式呈现):
(4)根据实验,亚硫酸盐的性质有_______________________________________。
盐溶液间反应的多样性与_____________________________________________
________________________________________________________________________有关。
5.某兴趣小组欲探究反应2Fe2++I2⥫⥬ 2Fe3++2I-,设计如图实验:
(1)Ⅰ、Ⅱ均未检验出Fe3+,检验有无Fe3+的试剂是__________。
(2)经检验,Ⅱ→Ⅲ的过程中产生了Fe3+,对Fe3+产生的原因作出如下假设:
假设a:Fe2+被空气氧化,离子方程式为____________________________________
________________________________________________________________________。
假设b:Fe2+被酸性溶液中的NOeq \\al(-,3)氧化;
假设c:Fe2+被I2氧化。
小组同学通过进一步实验证实了a、b不是产生Fe3+的主要原因,又查阅资料得知I2+2Fe2+⥫⥬ 2Fe3++2I-的反应限度小、产生的c(Fe3+)低,故推测c(Fe3+)增大是因为向Ⅱ的浅黄色溶液中加入AgNO3溶液后,_________________________________________________,
促使该平衡正向移动。
(3)上述推测虽然合理,但Ⅳ中灰黑色浑浊中只检验出少量AgI,主要成分是Ag。小组同学查阅资料得知新制的AgI见光分解速率较慢,故又对Ⅱ→Ⅲ过程中产生Fe3+的原因提出了假设d:___________________,该反应的离子方程式为_________________________,
并设计实验证明该假设合理,实验方案为__________________________________
________________________________________________________________________。
(4)经测定,Ⅲ→Ⅳ的过程中温度几乎无变化,c(Ag+)随反应时间的变化如图所示。若在实验开始时,先向Ⅲ的溶液中加入几滴Fe2(SO4)3溶液,c(Ag+)随反应时间的变化与图示相同,则Ⅳ中迅速出现灰黑色浑浊的原因可能是_____________________________________
________________________________________________________________________。
课时检测(七十二)
1.解析:(1)FeCl3·6H2O受热失去结晶水:FeCl3·6H2Oeq \(=====,\s\up7(△))FeCl3+6H2O,同时水解:FeCl3+3H2OFe(OH)3+3HCl,生成HCl气体,HCl和H2O结合形成盐酸小液滴,而形成白雾。(2)FeCl3 溶液中滴入KSCN溶液发生络合反应:Fe3++3SCN-Fe(SCN)3,生成血红色的硫氰化铁,用KSCN 溶液检验现象ii和A 中的黄色气体,溶液均变红,说明黄色气体中含有FeCl3。(3)除了氯气可使B中溶液变蓝外,还有其他两种可能的原因,可能原因①:实验b检出的气体使之变蓝,碘离子具有还原性,氯化铁具有强氧化性,二者反应的离子方程式是2Fe3++2I-===I2+2Fe2+;可能原因②:在酸性条件下,装置中的空气使之变蓝,氧气将碘离子氧化成碘单质,反应的离子方程式是4H++4I-+O2===2I2+2H2O。(4)①氯化铁能氧化碘离子,氧气在酸性条件下,也能氧化碘离子,所以需除去Cl2中的FeCl3 和O2(H+),若仍能观察到B中溶液变蓝色,则证明原气体中确实存在Cl2,所以方案1为在A、B间增加盛有饱和食盐水的洗气瓶C。②方案2 B中观察到的浅橙红色为溴水的颜色,则证明有物质能够将Br-氧化成Br2,若未检出Fe2+,则证明是Cl2氧化的Br-,而不是Fe3+,另外,因为还原剂用的不是I-,可不用考虑O2(H+)的影响;方案2中检验Fe2+的最佳试剂是K3[Fe(CN)6](或铁氰化钾),若存在Fe2+,则现象是出现蓝色沉淀。③综合方案1、2的现象,Br-可以被Cl2氧化成Br2,但不会被Fe3+氧化为Br2,方案2中选择NaBr溶液的依据是氧化性强弱顺序:Cl2>Br2>Fe3+。(5)将A中产物分离得到Fe2O3和MnCl2,则A中MnO2将氯离子氧化产生Cl2的化学方程式是2(FeCl3·6H2O)+MnO2eq \(=====,\s\up7(△))Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O。
答案:(1)盐酸小液滴(或盐酸酸雾) FeCl3+3H2O⥫⥬ Fe(OH)3+3HCl,加热时,FeCl3水解生成HCl,HCl挥发出来遇水蒸气形成白雾
(2)FeCl3 (3)2Fe3++2I-===I2+2Fe2+ 在酸性条件下,装置中的空气使之变蓝 4H++4I-+O2===2I2+2H2O (4)①饱和食盐水 饱和食盐水可以吸收HCl和FeCl3,且c(Cl-)较大,抑制反应Cl2+H2O⥫⥬ HCl+HClO正向进行 ②K3[Fe(CN)6](或铁氰化钾) 出现蓝色沉淀 ③氧化性强弱顺序:Cl2>Br2>Fe3+
(5)2(FeCl3·6H2O)+MnO2eq \(=====,\s\up7(△))Fe2O3+MnCl2+Cl2↑+2HCl↑+11H2O
2.解析:(1)①根据碰撞理论分析,实验Ⅰ中K2S2O8和KI反应很慢的主要原因是单位时间内有效碰撞的次数较少。②S2Oeq \\al(2-,8)中含有过氧键,作氧化剂时,-1价的两个氧原子变为-2价,1 ml S2Oeq \\al(2-,8)得到2 ml电子,所以总反应为S2Oeq \\al(2-,8)+2I-===I2+ 2SOeq \\al(2-,4),由盖斯定律可知,反应(ⅱ)=总反应-反应(ⅰ),则反应(ⅱ)为2Fe3++2I-===I2+2Fe2+。(2)因为氧化性:S2Oeq \\al(2-,8)>MnOeq \\al(-,4),所以在稀硫酸酸化的MnSO4溶液中滴加1滴催化剂AgNO3溶液,再滴加K2S2O8溶液后,K2S2O8溶液会与MnSO4溶液反应生成KMnO4,则实验现象是无色溶液变为紫红色。(3)加热前,先通入一段时间N2,当观察到D装置中出现连续气泡时,说明装置中空气排尽,则开始点燃酒精灯。(4)实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,根据物质的熔、沸点信息可知产物为SO3。(5)残留固体溶解后滴加BaCl2溶液和盐酸,产生白色沉淀,说明含有硫酸根离子,根据分析知分解产物为硫酸钾、三氧化硫和氧气,其分解的化学方程式为2K2S2O8△,2K2SO4+2SO3↑+O2↑。
答案:(1)①单位时间内有效碰撞的次数较少 ②2Fe3++2I-===I2+2Fe2+ 取实验Ⅱ反应后的溶液于试管中,向其中滴入KSCN溶液,溶液变为血红色 (2)无色溶液变为紫红色 5S2Oeq \\al(2-,8)+2Mn2++8H2O===2MnOeq \\al(-,4)+10SOeq \\al(2-,4)+16H+ (3)出现连续气泡
(4)SO3 (5)2K2S2O8eq \(=====,\s\up7(△))2K2SO4+2SO3↑+O2↑
3.解析:(1)取少许②中的红棕色溶液于试管中,滴入盐酸酸化的BaCl2溶液,产生白色沉淀。FeCl3与Na2SO3发生了氧化还原反应,离子方程式是2Fe3++SOeq \\al(2-,3)+H2O===2Fe2++SOeq \\al(2-,4)+2H+;为体现实验的严谨性,还应检验Fe2+的存在。(2)①溶液温度升高,反应过程中生成H2使溶液中的c(H+)减小 ,Fe3++3H2O⥫⥬ Fe(OH)3+3H+平衡正向移动,使溶液中出现红褐色的氢氧化铁沉淀。②因为Zn的化学性质与Al相似,能与NaOH溶液发生反应放出氢气,根据向黑色固体中加入足量的NaOH溶液,产生气泡,说明有Zn存在,且ⅱ中剩余固体用蒸馏水洗涤后,加入稀盐酸,产生大量气泡,说明含有金属Fe;向ⅲ反应后的溶液中滴加KSCN溶液无变化,说明溶液不含Fe3+,故无法确定是否有Fe3O4,因为Fe3+可与铁继续反应生成Fe2+,导致ⅳ中检测不到Fe3+。所以黑色固体中一定含有的物质是Fe和Zn。(3)本实验的目的是探究1.0 ml·L-1 FeCl3溶液中Fe3+和H+氧化性的相对强弱,应保证盐酸和FeCl3溶液中c(H+)相同,且两溶液的体积也相等,所以应该选择5 mL 0.2 ml·L-1盐酸。
答案:(1)2Fe3++SOeq \\al(2-,3)+H2O===2Fe2++SOeq \\al(2-,4)+2H+ 取少许②中红棕色溶液于试管中,滴加铁氰化钾溶液,出现蓝色沉淀(其他合理答案也可) (2)①溶液温度升高,反应过程中生成H2使溶液中的c(H+)减小,Fe3++3H2O⥫⥬ Fe(OH)3+3H+平衡正向移动,使溶液中出现红褐色的氢氧化铁沉淀 ②a.Fe和Zn b.若存在Fe3O4,稀盐酸和Fe3O4反应,产生的Fe3+可与铁继续反应生成Fe2+,导致ⅳ中检测不到Fe3+,与不含有Fe3O4得到的ⅳ中现象相同 (3)5 mL 0.2 ml·L-1盐酸
4.解析:(1)0.2 ml·L-1Na2SO3溶液滴入饱和Ag2SO4溶液中,Ag2SO4饱和溶液被稀释,因此不可能是Ag2SO4沉淀,溶液中SOeq \\al(2-,3)浓度较大,因此推断白色沉淀为Ag2SO3,反应的离子方程式为2Ag++SOeq \\al(2-,3)===Ag2SO3↓。(2)①已知:Cu+eq \(――→,\s\up7(稀硫酸))Cu+Cu2+,若沉淀中含有Cu+,加入稀硫酸会发生歧化反应生成铜单质,实验现象是有红色固体生成。②a.分析实验流程可知实验原理为2Cu2++4I-===2CuI+I2、I2+SOeq \\al(2-,3)+H2O===SOeq \\al(2-,4)+2I-+2H+、SOeq \\al(2-,4)+Ba2+===BaSO4↓,根据白色沉淀A是BaSO4可知,加入的试剂为含Ba2+的化合物,可以选用盐酸酸化的BaCl2溶液。b.由白色沉淀A为BaSO4可知,原沉淀中的SOeq \\al(2-,3)被氧化为SOeq \\al(2-,4),则加入KI时反应生成了I2,说明原沉淀中有Cu2+,即加入KI时Cu2+与I-反应生成白色沉淀CuI和I2,I2又与SOeq \\al(2-,3)反应生成SOeq \\al(2-,4)与I-,所以加入淀粉无明显现象。(3)①根据题意知,现象Ⅲ的白色沉淀中无SOeq \\al(2-,4),该白色沉淀既能溶于强酸,又能溶于强碱,结合元素守恒可知沉淀中应含有Al3+和OH-,可使酸性KMnO4溶液褪色是因为存在有还原性的SOeq \\al(2-,3)。②根据假设可知实验的目的是证明产生的沉淀是Al(OH)3还是铝的碱式盐,给定实验首先制备出现象Ⅲ中的沉淀,然后滴加NaOH溶液,因此对比实验也要首先制备出Al(OH)3沉淀,然后滴加NaOH溶液,若二者消耗的NaOH体积相同,则现象Ⅲ中的沉淀就是Al(OH)3沉淀,若二者消耗的NaOH体积不同,则现象Ⅲ中的沉淀为铝的碱式盐,步骤二见答案中图片。(4)I2被还原,酸性KMnO4溶液褪色,均显示了亚硫酸盐的还原性,亚硫酸盐与Al3+发生相互促进的水解反应生成氢氧化铝,证明了亚硫酸盐在水溶液中水解而体现了碱性,根据实验流程及现象可知,盐溶液间反应的多样性和盐的性质及反应条件有关。
答案:(1)2Ag++SOeq \\al(2-,3)===Ag2SO3↓ (2)①加入稀硫酸后有红色固体生成 ②HCl和BaCl2溶液 在I-的作用下,Cu2+转化为白色沉淀CuI,SOeq \\al(2-,3)转化为SOeq \\al(2-,4)
(3)①Al3+、OH-
②
(4)还原性、水解溶液显碱性 两种盐溶液中阴阳离子的性质和反应条件
5.解析:(1)检验Fe3+的试剂可以为KSCN溶液。(2)Ⅱ→Ⅲ的过程中产生了Fe3+,若是亚铁离子被空气中的氧气氧化,则对应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O;Ⅱ中存在反应I2+2Fe2+⥫⥬ 2Fe3++2I-,加入AgNO3溶液后,Ag+与I-反应产生黄色沉淀,I-浓度降低,使上述平衡正向移动。(3)Ⅳ中灰黑色浑浊中只检验出少量AgI,主要成分是Ag,说明银离子被还原,则一定有微粒被氧化,故产生Fe3+的原因可能是银离子将亚铁离子氧化,反应的离子方程式为Fe2++Ag+===Fe3++Ag↓。(4)Ⅲ→Ⅳ的过程中,温度几乎不变,发生反应Fe2++Ag+===Fe3++Ag↓,实验开始时,向Ⅲ中加入几滴Fe2(SO4)3溶液,仍能迅速出现灰黑色沉淀,且c(Ag+)变化图像与未加Fe2(SO4)3溶液相 同,说明Fe3+不能催化该反应,则单质银为该反应的催化剂,反应一段时间后,催化剂是影响反应速率的主要因素。
答案:(1)KSCN溶液 (2)4Fe2++O2+4H+===4Fe3++2H2O Ag+与I-结合生成了AgI沉淀,溶液中I-浓度降低 (3)Fe2+被Ag+氧化 Fe2++Ag+===Fe3++Ag↓ 向1 mL 0.1 ml·L-1FeSO4溶液中滴加1 mL 0.1 ml·L-1AgNO3溶液,出现灰黑色固体后,取上层清液于试管中,再向上层清液中滴加KSCN溶液,若溶液立即变红,则证明假设成立 (4)反应生成的Ag作催化剂,加快了Fe2++Ag+===Fe3++Ag↓的反应速率
操作
现象
点燃酒精灯,加热
i.A中部分固体溶解,上方出现白雾;
ii.稍后,产生黄色气体,管壁附着黄色液滴;
iii.B中溶液变蓝
方案1
在A、B间增加盛有某种试剂的洗气瓶C
B中溶液变为蓝色
方案2
将B中KI淀粉溶液替换为NaBr溶液;检验Fe2+
B中溶液呈浅橙红色;未检出Fe2+
实验
操作
现象
Ⅰ
在10 mL 0.1 ml·L-1含淀粉的KI溶液中滴加4 mL 0.1 ml·L-1 K2S2O8溶液
一段时间后,溶液缓慢变蓝色
Ⅱ
在10 mL 0.1 ml·L-1含淀粉的KI溶液中先滴几滴0.1 ml·L-1 FeSO4溶液,再滴加4 mL 0.1 ml·L-1 K2S2O8溶液
溶液迅速变蓝色
物质
SO3
SO2
O2
熔点/℃
16.8
-72.7
-218.4
沸点/℃
44.8
10
-182.9
实验操作
实验现象
配制100 mL 1.0 ml·L-1 FeCl3溶液,测其pH约为0.7[即c(H+)≈0.2 ml·L-1]
—
向反应瓶中加入6.5 g锌粉,然后加入50 mL 1.0 ml·L-1 FeCl3溶液,搅拌
溶液温度迅速上升,稍后出现红褐色沉淀,同时出现少量气泡;反应一段时间后静置,上层溶液为浅绿色,反应瓶底部有黑色固体
收集并检验反应过程中产生的气体
集气管口靠近火焰,有爆鸣声
实验操作
实验现象
将5 mL 1.0 ml·L-1 FeCl3溶液与0.65 g锌粉混合
溶液温度迅速上升,开始时几乎没有气泡产生
将________与0.65 g锌粉混合
立即产生大量气泡
实验
试剂
现象
2 mL
滴管
试管
0.2 ml·L-1
Na2SO3溶液
饱和
Ag2SO4溶液
Ⅰ.产生白色沉淀
0.2 ml·L-1
CuSO4溶液
Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀
0.1 ml·L-1
Al2(SO4)3溶液
Ⅲ.开始无明显变化,继续滴加产生白色沉淀
2025年高考化学一轮复习 课时检测七十三:定量分析型综合实验(含解析): 这是一份2025年高考化学一轮复习 课时检测七十三:定量分析型综合实验(含解析),共8页。试卷主要包含了18 J·g-1·℃-1和1等内容,欢迎下载使用。
2025年高考化学一轮复习 课时检测七十一:物质制备型综合实验(含解析): 这是一份2025年高考化学一轮复习 课时检测七十一:物质制备型综合实验(含解析),共7页。试卷主要包含了800 g TiO2样品;等内容,欢迎下载使用。
高考化学热点试题热点21性质探究型实验综合题含解析答案: 这是一份高考化学热点试题热点21性质探究型实验综合题含解析答案,共14页。试卷主要包含了铜盐是五颜六色的等内容,欢迎下载使用。












