2025年高考化学一轮复习 课时检测四十二:反应热的相关计算(含解析)
展开COeq \\al(2-,3)(aq)+H+(aq)===HCOeq \\al(-,3)(aq) ΔH1
COeq \\al(2-,3)(aq)+H2O(l)⥫⥬ HCOeq \\al(-,3)(aq)+OH-(aq) ΔH2
OH-(aq)+H+(aq)===H2O(l) ΔH3
OH-(aq)+CH3COOH(aq)===CH3COO-(aq)+H2O(l) ΔH4
A.ΔH1<0,ΔH2<0 B.ΔH1<ΔH2
C.ΔH3<0,ΔH4>0 D.ΔH3>ΔH4
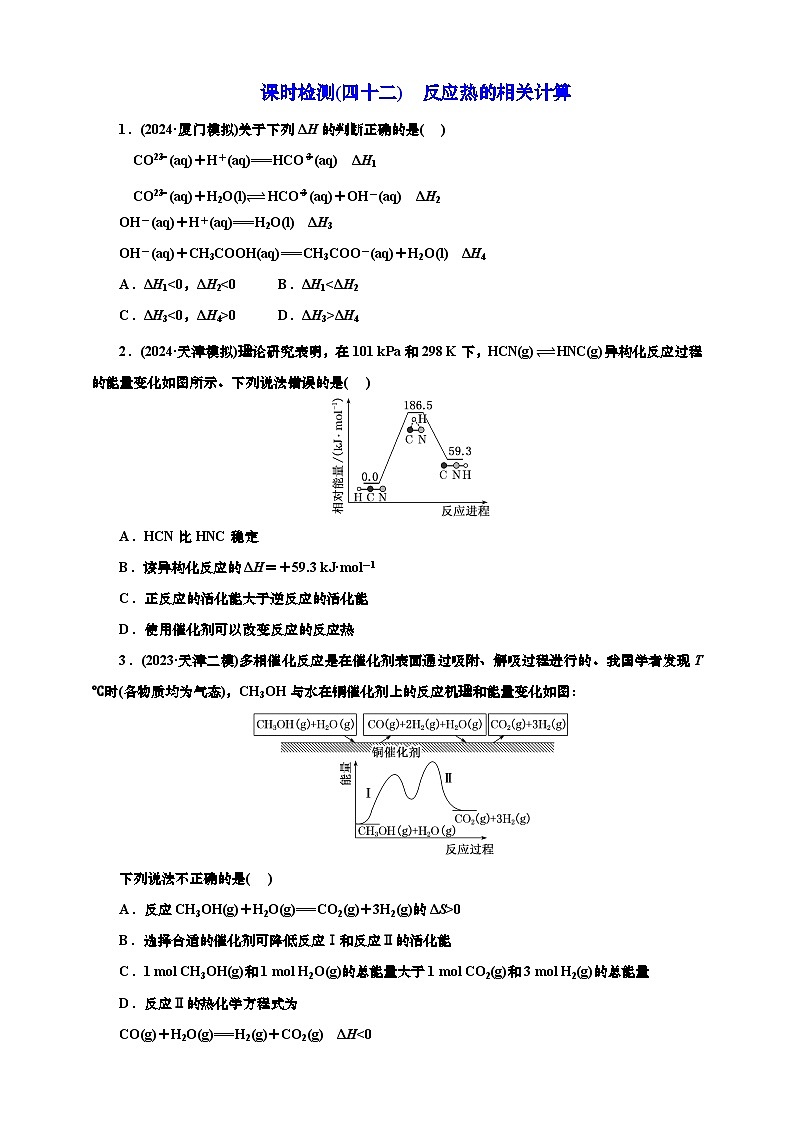
2.(2024·天津模拟)理论研究表明,在101 kPa和298 K下,HCN(g)⥫⥬ HNC(g)异构化反应过程的能量变化如图所示。下列说法错误的是( )
A.HCN比HNC稳定
B.该异构化反应的ΔH=+59.3 kJ·ml-1
C.正反应的活化能大于逆反应的活化能
D.使用催化剂可以改变反应的反应热
3.(2023·天津二模)多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T ℃时(各物质均为气态),CH3OH与水在铜催化剂上的反应机理和能量变化如图:
下列说法不正确的是( )
A.反应CH3OH(g)+H2O(g)===CO2(g)+3H2(g)的ΔS>0
B.选择合适的催化剂可降低反应Ⅰ和反应Ⅱ的活化能
C.1 ml CH3OH(g)和1 ml H2O(g)的总能量大于1 ml CO2(g)和3 ml H2(g)的总能量
D.反应Ⅱ的热化学方程式为
CO(g)+H2O(g)===H2(g)+CO2(g) ΔH<0
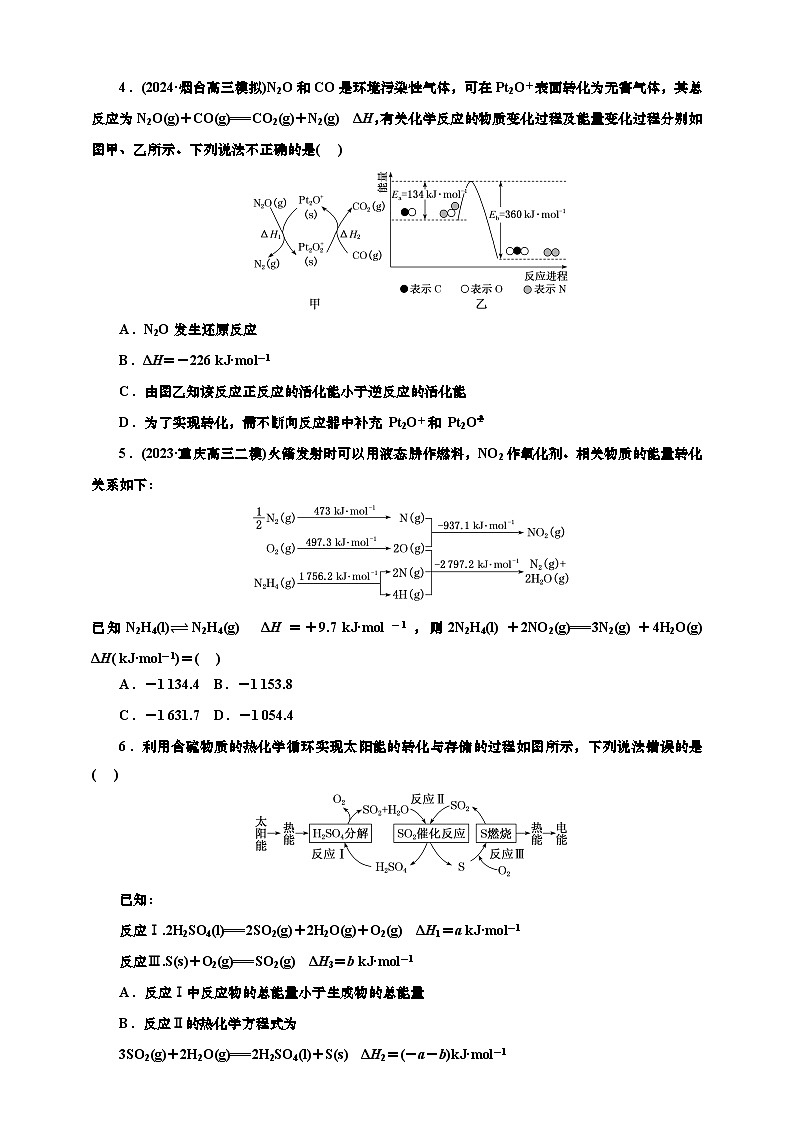
4.(2024·烟台高三模拟)N2O和CO是环境污染性气体,可在Pt2O+表面转化为无害气体,其总反应为N2O(g)+CO(g)===CO2(g)+N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程分别如图甲、乙所示。下列说法不正确的是( )
A.N2O发生还原反应
B.ΔH=-226 kJ·ml-1
C.由图乙知该反应正反应的活化能小于逆反应的活化能
D.为了实现转化,需不断向反应器中补充 Pt2O+和 Pt2Oeq \\al(+,2)
5.(2023·重庆高三二模)火箭发射时可以用液态肼作燃料,NO2作氧化剂。相关物质的能量转化关系如下:
已知N2H4(l)⥫⥬ N2H4(g) ΔH=+9.7 kJ·ml-1,则2N2H4(l)+2NO2(g)===3N2(g)+4H2O(g) ΔH( kJ·ml-1)=( )
A.-1 134.4 B.-1 153.8
C.-1 631.7 D.-1 054.4
6.利用含硫物质的热化学循环实现太阳能的转化与存储的过程如图所示,下列说法错误的是( )
已知:
反应Ⅰ.2H2SO4(l)===2SO2(g)+2H2O(g)+O2(g) ΔH1=a kJ·ml-1
反应Ⅲ.S(s)+O2(g)===SO2(g) ΔH3=b kJ·ml-1
A.反应Ⅰ中反应物的总能量小于生成物的总能量
B.反应Ⅱ的热化学方程式为
3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH2=(-a-b)kJ·ml-1
C.用S(g)替代反应Ⅲ中的S(s),反应焓变为ΔH4,则ΔH3<ΔH4
D.上述循环过程中至少涉及4种能量转化形式
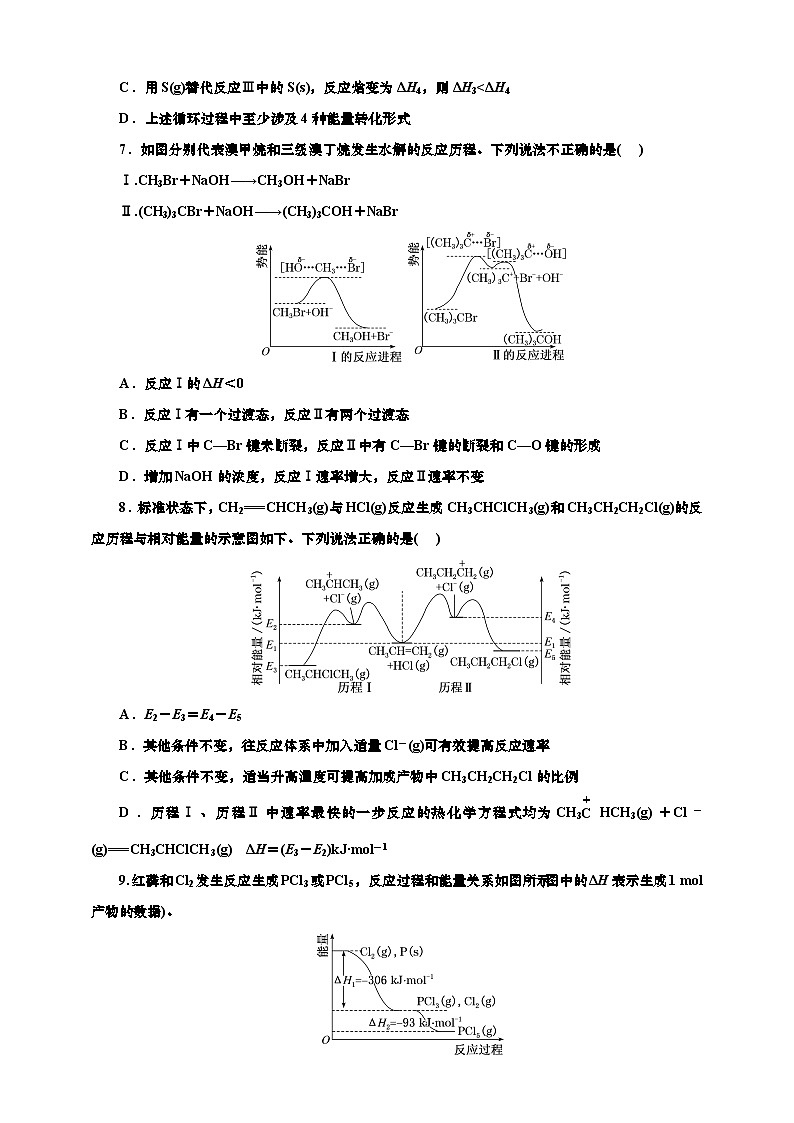
7.如图分别代表溴甲烷和三级溴丁烷发生水解的反应历程。下列说法不正确的是( )
Ⅰ.CH3Br+NaOH―→CH3OH+NaBr
Ⅱ.(CH3)3CBr+NaOH―→(CH3)3COH+NaBr
A.反应Ⅰ的ΔH<0
B.反应Ⅰ有一个过渡态,反应Ⅱ有两个过渡态
C.反应Ⅰ中C—Br键未断裂,反应Ⅱ中有C—Br键的断裂和C—O键的形成
D.增加NaOH的浓度,反应Ⅰ速率增大,反应Ⅱ速率不变
8.标准状态下,CH2===CHCH3(g)与HCl(g)反应生成CH3CHClCH3(g)和CH3CH2CH2Cl(g)的反应历程与相对能量的示意图如下。下列说法正确的是( )
A.E2-E3=E4-E5
B.其他条件不变,往反应体系中加入适量Cl-(g)可有效提高反应速率
C.其他条件不变,适当升高温度可提高加成产物中CH3CH2CH2Cl的比例
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式均为CH3eq \(C,\s\up6(+)) HCH3(g)+Cl-(g)===CH3CHClCH3(g) ΔH=(E3-E2)kJ·ml-1
9.红磷和Cl2发生反应生成PCl3或PCl5,反应过程和能量关系如图所示(图中的ΔH表示生成1 ml产物的数据)。
回答下列问题:
(1)1 ml PCl3所具有的总能量比1 ml P和1.5 ml Cl2 所具有的总能量________(填“高”或“低”)________kJ。
(2)PCl3和Cl2化合生成PCl5的热化学方程式为________________________________。
(3)P和Cl2反应生成1 ml PCl5的ΔH=__________________________________。
(4)PCl5与足量水充分反应最终生成两种酸,其化学方程式为________________________________________________________________________。
(5)红磷的同素异形体白磷在氧气中燃烧有如下转化关系:
其中ΔH2=____________(用含ΔH1和ΔH3的代数式表示)。
10.(2024·成都高三模拟)化学反应过程中,不仅有物质的变化,同时还伴随有能量的变化。
(1)已知常温下红磷比白磷稳定,在下列反应中:
①4P(红磷,s)+5O2(g)===P4O10(s) ΔH=-Q1 kJ·ml-1
②P4(白磷,s)+5O2(g)===P4O10(s) ΔH=-Q2 kJ·ml-1
若Q1、Q2均大于零,则Q1和Q2的关系为________(填字母)。
A.Q1<Q2 B.Q1=Q2
C.Q1>Q2 D.无法确定
(2)已知拆开1 ml HCl分子中的化学键需要消耗431 kJ能量,根据下面的能量图回答下列问题:
分别写出③④的数值:________、________。
(3)火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量的热。已知64 g液态肼和足量H2O2反应生成氮气和水蒸气放出Q3 kJ的热量,写出该反应的热化学方程式:________________________________
________________________________________________________________________。
(4)已知在常温常压下:
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·ml-1
H2O(l)===H2O(g) ΔH=+44.0 kJ·ml-1
写出表示甲醇燃烧热的热化学方程式:____________________________________
________________________________________________________________________。
(5)已知:N2(g)+O2(g)===2NO(g) ΔH1=+180.5 kJ·ml-1
C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·ml-1
2C(s)+O2(g)===2CO(g) ΔH3=-221.0 kJ·ml-1
若某反应的平衡常数表达式为K=eq \f(cN2·c2CO2,c2NO·c2CO),请写出此反应的热化学方程式:________________________________________________________________________。
11.(1)航天员呼吸产生的CO2利用Bsch反应:CO2(g)+2H2(g)⥫⥬ C(s)+2H2O(g) ΔH,再电解水可实现O2的循环利用。热力学中规定由最稳定单质生成1 ml某物质的焓变称为该物质的标准生成焓(符号:ΔfHeq \\al(θ,m)),最稳定单质的标准生成焓规定为0。已知上述反应式中:ΔfHeq \\al(θ,m)(CO2)=-394 kJ·ml-1,ΔfHeq \\al(θ,m)(H2)=0 kJ·ml-1,ΔfHeq \\al(θ,m)(C)=0 kJ·ml-1,ΔfHeq \\al(θ,m)(H2O)=-242 kJ·ml-1,则ΔH=________kJ·ml-1。
(2)目前HaberBsch法是工业合成氨的主要方式,其生产条件需要高温高压。为了有效降低能耗,过渡金属催化还原氮气合成氨被认为是具有巨大前景的替代方法。催化过程一般有吸附—解离—反应—脱附等过程,图示为N2和H2在固体催化剂表面合成氨反应路径的势能面图(部分数据略),其中“*”表示被催化剂吸附。
氨气的脱附是______(填“吸热”或“放热”)过程,合成氨的热化学方程式为________________________________________________________________________。
(3)已知:RlnKp=-eq \f(ΔH,T)+C(C为常数),根据实验数据得到如图,则ΔH≈________________________________________________________________________kJ·ml-1。
(4)CO2经过催化氢化合成低碳烯烃,其合成乙烯的反应为2CO2(g)+6H2(g)⥫⥬ CH2===CH2(g)+4H2O(g) ΔH。几种物质的能量(在标准状况下规定单质的能量为0,测得其他物质在生成时所放出或吸收的热量)如表所示:
则ΔH=________________。
课时检测(四十二)
1.B HCOeq \\al(-,3)电离吸热,所以COeq \\al(2-,3)(aq)+H+(aq)===HCOeq \\al(-,3)(aq)为放热反应,ΔH1<0;COeq \\al(2-,3)水解吸热,所以COeq \\al(2-,3)(aq)+H2O(l)HCOeq \\al(-,3)(aq)+OH-(aq) ΔH2>0,A错误,B正确。OH-(aq)+H+(aq)===H2O(l)表示强酸和强碱的中和反应,为放热反应,所以ΔH3<0,醋酸与强碱的中和反应为放热反应,所以ΔH4<0,C错误。但由于醋酸是弱酸,电离过程中会吸收部分热量,所以醋酸与强碱反应放出的热量小于强酸与强碱反应放出的热量,所以ΔH4>ΔH3,D错误。
2.D 根据图示,HCN的能量比HNC的能量低,因此HCN比HNC稳定,A项正确;该异构化反应中反应物总能量低于生成物总能量,为吸热反应,反应物和生成物能量相差59.3 kJ·ml-1,故ΔH=+59.3 kJ·ml-1,B项正确;根据图示,正反应的活化能为186.5 kJ·ml-1,逆反应的活化能为(186.5-59.3)kJ·ml-1=127.2 kJ·ml-1,C项正确;使用催化剂可以改变反应的活化能,但不能改变反应热,D项错误。
3.C 该反应为反应前后气体分子数增大的反应,ΔS>0,A正确;催化剂改变反应的历程从而降低反应的活化能,所以选择合适的催化剂可降低反应Ⅰ和反应Ⅱ的活化能,B正确;从能量图看,1 ml CH3OH(g) 和1 ml H2O(g)的总能量低于1 ml CO2(g)和3 ml H2(g)的总能量,C错误;从能量图看,1 ml CO(g)和1 ml H2O(g)的总能量高于1 ml H2(g)和1 ml CO2(g),所以反应Ⅱ为放热反应,ΔH<0,D正确。
4.D 反应N2O+CO===CO2+N2中,N元素化合价降低,N2O为氧化剂,发生还原反应,故A正确;反应物能量高于生成物,反应为放热反应,反应焓变ΔH=134 kJ·ml-1-360 kJ·ml-1=-226 kJ·ml-1,故B正确;由题图乙知该反应正反应的活化能Ea小于逆反应的活化能Eb,故C正确;Pt2O+和Pt2Oeq \\al(+,2)是催化剂,催化剂在化学反应的前后化学性质和质量是不变的,无需不断补充,故D错误。
5.A 根据图示信息和已知信息,可得反应:
①eq \f(1,2)N2(g)+O2(g)===NO2(g) ΔH=+33.2 kJ·ml-1;
②O2(g)+N2H4(g)===N2(g)+2H2O(g) ΔH=-543.7 kJ·ml-1;
③N2H4(l)N2H4(g) ΔH=+9.7 kJ·ml-1。
根据盖斯定律,②×2+③×2-①×2可得2N2H4(l)+2NO2(g)===3N2(g)+4H2O(g) ΔH=-543.7×2+9.7×2-33.2×2=-1 134.4 kJ·ml-1。
6.C 反应Ⅰ为在热能作用下H2SO4的分解反应,为吸热反应,则反应物的总能量小于生成物的总能量,A正确;由盖斯定律可知,-(反应Ⅰ+反应Ⅲ)得反应:3SO2(g)+2H2O(g)===2H2SO4(l)+S(s) ΔH2=(-a-b)kJ·ml-1,B正确;气态硫单质所具有的能量高于固态硫单质所具有的能量,故用S(g)替代反应Ⅲ中的S(s),反应放热更多,放热焓变为负值,则ΔH3>ΔH4,C错误;题述循环过程中涉及太阳能、热能、化学能、电能等至少4种能量转化形式,D正确。
7.AC 反应Ⅰ中反应物的总能量高于生成物的总能量,为放热反应,ΔH<0,A符合题意;由题图可知,反应Ⅰ有一个过渡态,反应Ⅱ有两个过渡态,B不符合题意;反应Ⅰ中CH3Br转化成CH3OH,有C—Br键的断裂,反应Ⅱ中(CH3)3CBr转化成(CH3)3COH,有C—Br键的断裂和C—O键的形成,C符合题意;反应Ⅱ卤代烃先自身转变为过渡态,然后氢氧根离子与过渡态的烃结合,氢氧化钠不直接与卤代烃一起转化到活化态,所以增加氢氧化钠的浓度不能使反应Ⅱ速率增大,D不符合题意。
8.C E2-E3、E4-E5对应二者的反应物、生成物均不同,反应的焓变不同,故E2-E3≠E4-E5,A错误;由图可知,历程Ⅰ、历程Ⅱ的决速步均为第一步,故其他条件不变,往反应体系中加入适量Cl-(g) 不会提高反应速率,B错误;由题图可知,历程Ⅱ的最大活化能更大,受温度的影响更大,故其他条件不变,适当升高温度可提高加成产物中CH3CH2CH2Cl的比例,C正确;由题图可知,历程Ⅰ中速率最快的一步反应的热化学方程式为 CH3eq \(C,\s\up6(+)) HCH3(g)+Cl-(g)===CH3CHClCH3(g) ΔH=(E3-E2)kJ·ml-1,历程Ⅱ中速率最快的一步反应的热化学方程式为CH3CH2eq \(C,\s\up6(+)) H2(g)+Cl-(g)===CH3CH2CH2Cl(g) ΔH=(E5-E4)kJ·ml-1,D错误。
9.解析:(1)根据图示可得热化学方程式P(s)+eq \f(3,2)Cl2(g)===PCl3(g) ΔH1=-306 kJ·ml-1,故 1 ml PCl3所具有的总能量比1 ml P和 1.5 ml Cl2所具有的总能量低306 kJ。(2)根据图示可得PCl3和Cl2化合生成PCl5的热化学方程式为PCl3(g)+Cl2(g)===PCl5(g) ΔH=-93 kJ·ml-1。(3)由题图可知,P和Cl2分两步反应生成PCl5,故ΔH=-306 kJ·ml-1+(-93 kJ·ml-1)=-399 kJ·ml-1。(4)PCl5与足量水充分反应最终生成H3PO4与HCl两种酸,所以其化学方程式为PCl5+4H2O===H3PO4+5HCl。(5)根据盖斯定律,有ΔH3=ΔH2+ΔH1,所以ΔH2=ΔH3-ΔH1。
答案:(1)低 306
(2)PCl3(g)+Cl2(g)===PCl5(g)ΔH=-93 kJ·ml-1
(3)-399 kJ·ml-1 (4)PCl5+4H2O===H3PO4+5HCl
(5)ΔH3-ΔH1
10.解析:(1)已知常温下红磷比白磷稳定,说明红磷具有的能量低,则4P(红磷,s)===P4(白磷,s) ΔH>0,根据盖斯定律,①-②得到4P(红磷,s)===P4(白磷,s) ΔH=Q2-Q1>0,所以Q2>Q1。(2)已知拆开1 ml HCl分子中的化学键需要消耗431 kJ能量,则合成2 ml HCl分子中的化学键放出能量为431 kJ×2=862 kJ,由题图可知反应:H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·ml-1,设反应物断裂需要吸收能量为x kJ,有-183 kJ=-862 kJ+x kJ,解得x=679。(3)64 g即2 ml液态肼和足量H2O2反应生成氮气和水蒸气放出Q3 kJ的热量,则1 ml液态肼与足量H2O2反应时放出的热量是0.5Q3 kJ,热化学方程式为N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-0.5Q3 kJ·ml-1。(4)将题给热化学方程式依次编号为①②,根据盖斯定律,eq \f(①,2)-②×2得到甲醇燃烧热的热化学方程式为CH3OH(l)+eq \f(3,2)O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ·ml-1。(5)由K=eq \f(cN2·c2NO2,c2NO·c2CO)可得该反应为2NO+2CO===N2+2NO2,将题给三个热化学方程式依次编号为①②③,根据盖斯定律,②×2-①-③得到2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5 kJ·ml-1。
答案:(1)A (2)679 862 (3)N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-0.5Q3 kJ·ml-1
(4)CH3OH(l)+eq \f(3,2)O2(g)===CO2(g)+2H2O(l)
ΔH=-725.8 kJ·ml-1
(5)2NO(g)+2CO(g)===N2(g)+2CO2(g)
ΔH=-746.5 kJ·ml-1
11.解析:(1)ΔH=ΔfHeq \\al(θ,m)(C)+2ΔfHeq \\al(θ,m)(H2O)-ΔfHeq \\al(θ,m)(CO2)-2ΔfHeq \\al(θ,m)(H2)=0+2×(-242 kJ·ml-1)-(-394 kJ·ml-1)-0=-90 kJ·ml-1。(2)由势能面图可知,氨气从催化剂上脱离时势能面在升高,为吸热过程;由题图可知,0.5 ml氮气和1.5 ml 氢气转变成1 ml氨气的反应热为-17 kJ·ml-1+21 kJ·ml-1-50 kJ·ml-1=-46 kJ·ml-1,则合成氨的热化学方程式为N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·ml-1。(3)将(3.19,69.50)、(3.30,53.64)代入RlnKp=-eq \f(ΔH,T)+C得 69.50=eq \f(-ΔH,kJ·ml-1)×3.19×10-3+C、53.64=eq \f(-ΔH,kJ·ml-1)×3.30×10-3+C,联立求解得ΔH≈144.2 kJ·ml-1。(4)反应焓变等于生成物总能量减去反应物总能量,则该反应的焓变ΔH=52 kJ·ml-1+(-242 kJ·ml-1)×4-(-394 kJ·ml-1)×2-0=-128 kJ·ml-1。
答案:(1)-90 (2)吸热
N2(g)+3H2(g)2NH3(g) ΔH=-92 kJ·ml-1
(3)144.2 kJ·ml-1 (4)-128 kJ·ml-1
物质
H2(g)
CO2(g)
CH2===CH2(g)
H2O(g)
能量/
(kJ·ml-1)
0
-394
52
-242
2025年高考化学一轮复习 课时检测五十一:速率常数与平衡常数的相关计算(含解析): 这是一份2025年高考化学一轮复习 课时检测五十一:速率常数与平衡常数的相关计算(含解析),共8页。试卷主要包含了解析等内容,欢迎下载使用。
2025年高考化学一轮复习 课时检测四十六:串联电池及电池的相关计算(含解析: 这是一份2025年高考化学一轮复习 课时检测四十六:串联电池及电池的相关计算(含解析,共7页。
2025年高考化学一轮复习 课时检测三十九:晶体结构的比较及晶胞相关计算(含解析): 这是一份2025年高考化学一轮复习 课时检测三十九:晶体结构的比较及晶胞相关计算(含解析),共7页。












