

江苏省海安高级中学2024-2025学年高二上学期10月月考化学试题(Word版附答案)
展开
这是一份江苏省海安高级中学2024-2025学年高二上学期10月月考化学试题(Word版附答案),共12页。试卷主要包含了下列说法正确的是,羰基硫,高温下,某反应达平衡,平衡常数,已知,燃煤电厂锅炉尾气等内容,欢迎下载使用。
相对原子质量:H-1 C-12 O-16 C-59
Ⅰ卷(选择题)
单项选择题(本题包13小题,每小题3分,共39分。每小题只有一个选项符合题意)
1.下列化学与生产生活相关的说法正确的是( )
A.海中校园中很多太阳能路灯,其感光板主要成分是二氧化硅
B.石油主要由各种烃组成的混合物,可以通过分馏的方法分离出
C.分离工业合成氨产品的方法是将氨气液化
D.氨的催化氧化的适宜条件为高温、高压、催化剂
2.下列实验装置能达到相应实验目的的是( )
3.下列说法正确的是( )
A.与同浓度的溶液反应时,稀硫酸中和热的绝对值是盐酸的两倍
B.甲烷的燃烧热,则甲烷燃烧的热化学方程式可表示为:
C.可能是吸热反应
D.中和热实验中,一次平行实验需测两次温度
4.羰基硫()能防止某些昆虫、线虫和真菌的危害。在容积不变的密闭容器中,将和混合后在催化剂作用下,加热发生反应并达到平衡。若反应前的物质的量为10,达到平衡时的物质的量为8,且化学平衡常数为0.1.下列说法正确的是( )
A.反应前的物质的量为7
B.增大压强,化学平衡正向移动
C.增大浓度,正反应速率增大,逆反应速率减小
D.增大的比值,可以减小的转化率
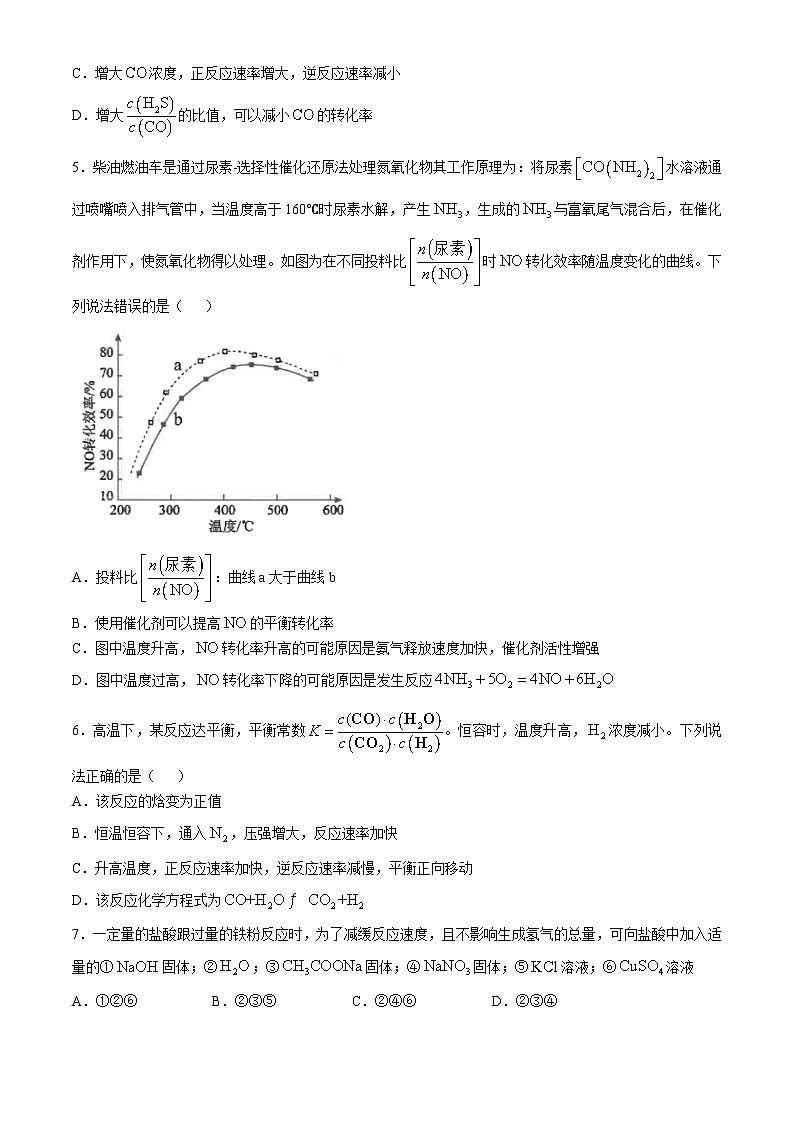
5.柴油燃油车是通过尿素-选择性催化还原法处理氮氧化物其工作原理为:将尿素水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生,生成的与富氧尾气混合后,在催化剂作用下,使氮氧化物得以处理。如图为在不同投料比时转化效率随温度变化的曲线。下列说法错误的是( )
A.投料比:曲线a大于曲线b
B.使用催化剂可以提高的平衡转化率
C.图中温度升高,转化率升高的可能原因是氨气释放速度加快,催化剂活性增强
D.图中温度过高,转化率下降的可能原因是发生反应
6.高温下,某反应达平衡,平衡常数。恒容时,温度升高,浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,通入,压强增大,反应速率加快
C.升高温度,正反应速率加快,逆反应速率减慢,平衡正向移动
D.该反应化学方程式为
7.一定量的盐酸跟过量的铁粉反应时,为了减缓反应速度,且不影响生成氢气的总量,可向盐酸中加入适量的①固体;②;③固体;④固体;⑤溶液;⑥溶液
A.①②⑥B.②③⑤C.②④⑥D.②③④
8.已知:
根据以上热化学方程式判断,下列说法正确的是( )
A.的燃烧热为
B.上图可表示由生成的反应过程和能量关系
C.
D.与反应放出热量时,转移电子数约为
9.在催化剂存在下,和能同时发生两个平行反应,反应的热化学方程式如下:
①
②
在恒压、反应物起始物质的量比条件下,相同反应时间测得的实验数据如下:
下列有关说法正确的是( )
A.其他条件不变,升高温度反应①中转化为平衡转化率增大
B.相同温度下,选择催化剂a有利于转化为
C.反应①正反应的活化能:无催化剂>有催化剂b>有催化剂a
D.其他条件不变,当时,测得不同压强下的平衡转化率几乎相等,说明620K时以反应②为主
10.燃煤电厂锅炉尾气(主要成分),可通过主反应 除去;温度高于300℃时会发生副反应: 。在恒压、反应物起始物质的量之比一定的条件下,反应相同时间,的转化率在不同催化剂作用下随温度变化的曲线如图所示,下列有关说法正确的是( )
A.升高温度、增大压强均可提高主反应中的平衡转化率
B.
C.图中X点所示条件下,反应时间足够长,的转化率能达到Y点的值
D.图中Z点到W点的转化率降低的原因是主反应的平衡逆向移动
11.下列实验操作或装置符合实验要求的是( )
A.检验离子B.定容
C.中和热的测定D.测定化学反应速率
12.已知: 。实验测得速率方程为,(、为速率常数,只与温度、催化剂有关,与浓度无关)。向2L恒容密闭容器中充入和发生上述反应,测得的体积分数与温度和时间的关系如图所示。下列说法正确的是( )
A.正逆反应活化能的大小关系为
B.a点的转化率为80%
C.温度下的温度下的
D.化学反应速率:c点的点的点的
13.一定温度下,将1A和1B气体充入2L恒容密闭容器,发生反应,时达到平衡,在、时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示,下列说法错误的是( )
A.若,则
B.若时刻升高了温度,则该反应的
C.若时刻后向体系中再充入A、B、C各1,则
D.保持温度不变,起始时向该容器中充入1A和1B,加入2D,则平衡时A的转化率小于50%
Ⅱ卷(非选择题)
14.(16分)(1)因下雨而推迟的海中运动会肯定没有火炬传递活动,但火炬一般采用丙烷()为燃料。丙烷热值较高,污染较小,是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成和1过程中的能量变化图。
写出表示丙烷燃烧热的热化学方程式:________。
②二甲醚()是一种新型燃料,应用前景广阔。1二甲醚完全燃烧生成和液态水放出1455热量。若1丙烷和二甲醚的混合气体完全燃烧生成和液态水共放出1645热量,则混合气体中,丙烷和二甲醚的物质的量之比为_______。
(2)试运用盖斯定律回答下列问题:
已知:
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中的反应热为________。
(3)已知:
则的________。
(4)用如图所示的装置测定中和热。
实验药品:1000.50盐酸、500.55 溶液、500.55氨水。
实验步骤:略。
已知:,。回答下列问题:
①从实验装置上看,还缺少________。
②将浓度为0.50的酸溶液和0.55的碱溶液各50混合(溶液密度均为1),生成溶液的比热容,搅动后,测得酸碱混合液的温度变化数据如下:
某同学利用上述装置做甲组实验,根据所给数据计算________,测得中和热的数值偏低可能的原因________。
A.测量完盐酸的温度再次测量溶液温度时,温度计上残留的酸液未用水冲洗干净
B.做本实验的当天室温较高C.在量取盐酸体积时俯视读数
D.溶液一次性迅速倒入E.实验装置保温隔热效果差
两组实验结果差异的原因是________。
15.(15分)钴的氧化物常用于制取催化剂和颜料等。以钴矿[主要成分是、、,还含及少量、、及MnO2等]为原料可制取钴的氧化物。
(1)一种钴的氧化物晶胞如图1所示,该氧化物中钴离子基态核外电子排布式为________。
(2)利用钴矿制取钻的氧化物的主要步骤如下:
①浸取:用盐酸和溶液浸取钴矿,浸取液中含有、、、、、、等离子。写出发生反应的离子方程式:________;写出的空间构型________
②除杂:向浸取液中先加入足量氧化,再加入调节除去、、。写出在酸性条件下被氧化的离子方程式:________
③萃取、反萃取:向除杂后的溶液中,加入某有机酸萃取剂,发生反应:。实验测得:当溶液处于4.5~6.5范围内萃取率随溶液的增大而增大(如图2所示),其原因是________。向萃取所得有机相中加入,反萃取得到水相。该工艺中设计萃取、反萃取的目的是________。
④沉钴、热分解:向反萃取后得到的水相中加入溶液,过滤、洗涤、干燥,得到晶体。称取7.32g该晶体,在空气中加热一段时间后,得到和的混合物。称量该混合物,质量为3.16g,通过计算确定该混合物中和的质量之比________。(写出计算过程)
16.(14分)
Ⅰ.已知:
反应的平衡常数为;
反应的平衡常数为。
在不同温度时、的值如下表:
(1)推导反应的平衡常数K与、的关系式:________,判断该反应是________反应(填“吸热”或“放热”)。
Ⅱ.温度下,体积为2L的恒容密闭容器,加入4.00,2.00,发生化学反应 。部分实验数据如表格所示。
(2)前500s反应速率________,该反应的平衡常数K=________。
(3)该反应达到平衡时某物理量随温度变化如下图所示。纵坐标可以表示的物理量有哪些_________。
a.Y的逆反应速率b.M的体积分数
c.混合气体的平均相对分子质量d.X的质量分数
(4)反应达到平衡后,若再加入3.00,3.00,下列说法正确的是________。
A.平衡不移动
B.重新达平衡后,M的体积分数小于50%
C.重新达平衡后,M的物质的量浓度是原平衡的1.5倍
D.重新达平衡后,Y的平均反应速率与原平衡相等
E.重新达平衡后,用X表示的v(正)比原平衡大
(5)若容器为绝热恒容容器,起始时加入4.00,2.00,则达平衡后M的物质的量浓度________1.5(填“>”、“=”或“
相关试卷
这是一份江苏省海安高级中学2024-2025学年高三上学期10月月考化学试题(Word版附答案),共11页。试卷主要包含了单项选择题,非选择题等内容,欢迎下载使用。
这是一份江苏省海安高级中学2024-2025学年高二上学期10月月考化学试题,共5页。
这是一份江苏省启东中学2024-2025学年高二上学期第一次月考化学试题(Word版附答案),共12页。试卷主要包含了 某密闭容器中进行如下反应, 可逆反应,06NAeV等内容,欢迎下载使用。









