




北京市第十一中学2024-2025学年高一上学期段考一化学试题(Word版附解析)
展开
这是一份北京市第十一中学2024-2025学年高一上学期段考一化学试题(Word版附解析),文件包含北京市第十一中学2024-2025学年高一上学期段考一化学试卷Word版含解析docx、北京市第十一中学2024-2025学年高一上学期段考一化学试卷Word版无答案docx等2份试卷配套教学资源,其中试卷共25页, 欢迎下载使用。
考试时间:90分钟 满分:100分
考生请注意:请将所有答案填写在答题纸相应的位置处,在试卷上作答一律无效。
可能用到的相对原子质量:H-1,C-12,N-14,O-16,Na-23,Mg-24,S-32,Cl-35.5,Cu-64
第I卷 选择题(共42分)
每题只有1个选项符合题意,请将答案填涂在机读卡上。
1. 化学与生活、社会发展息息相关,下列有关说法不正确的是
A. 石墨与“嫦娥五号”卫星所用的含碳量90%以上的碳纤维互为同素异形体
B. “青蒿一握,以水二升渍,绞取汁”,诗句中体现对青蒿素的萃取
C. 冬奥速滑馆“冰丝带”采用CO2跨临界直冷制冰技术,利用了相变中的能量变化
D. “朝坛雾卷,曙岭烟沉”,雾有丁达尔效应是因为胶体粒子对光有散射作用
2. 下列说法正确的是
A. 金属氧化物一定是碱性氧化物
B. 具有规则的几何外形的固体一定属于晶体
C. 酸性氧化物与盐溶液的反应一定不是氧化还原反应
D. 月壤中的“嫦娥石”,其属于复盐(Y是钇元素)
3. 下列关于各物质的所属类别及性质的描述正确的是
A. AB. BC. CD. D
4. 下列有关于阿伏伽德罗常数的说法正确的是
A. 22.4L(标准状况)CCl4含有的质子的数目为
B. 7.8gNa2O2与足量水反应,转移电子数目为
C. 0.01ml/L的NaCl溶液中,阴阳离子的数目为
D. 常温常压下,6g偏二甲肼(C2H8N2)含有个原子
5. 下列有关Fe(OH)3的叙述正确的是
A. Fe(OH)3胶体带电,可以发生电泳
B. 直径在1~100nm的Fe(OH)3固体属于胶体
C. 向Fe(OH)3胶体中滴加硫酸,先产生红褐色沉淀,继续滴加,沉淀溶解
D. 在制备Fe(OH)3胶体的实验中,加热煮沸时间越长,越有利于胶体的生成
6. SO2相图如图所示。下列说法不正确的是
A. 二氧化硫在160℃时不能液化
B. 25℃和78atm下二氧化硫是液体
C. 5atm下固态二氧化硫置于室温环境会先熔化再气化
D. 25℃贮存有半满液态二氧化硫的容器,达到平衡后容器内的压强为3.8atm
7. H2S是一种无色有臭鸡蛋气味的剧毒气体。将H2S通入KI与KIO3的混合溶液,发生如下反应:KI+5KIO3+3H2S=3I2+3K2SO4+3H2O。下列说法正确的是
A. KIO3是氧化剂,K2SO4是还原产物
B. 若有1mlKI被氧化,则被KI还原的KIO3为0.2ml
C. 每消耗3mlH2S,转移电子的物质的量为24ml
D. 被氧化的原子与被还原的原子的物质的量之比为5:4
8. 常温下,下列各组离子组在指定溶液中能大量存在的是
A. 碱性溶液中:Na+、K+、Cl-、B. 酸性溶液中:Na+、、Cu2+、
C. 中性溶液中:Ba2+、Ca2+、Cl-、D. 无色溶液中:K+、、、Cl-
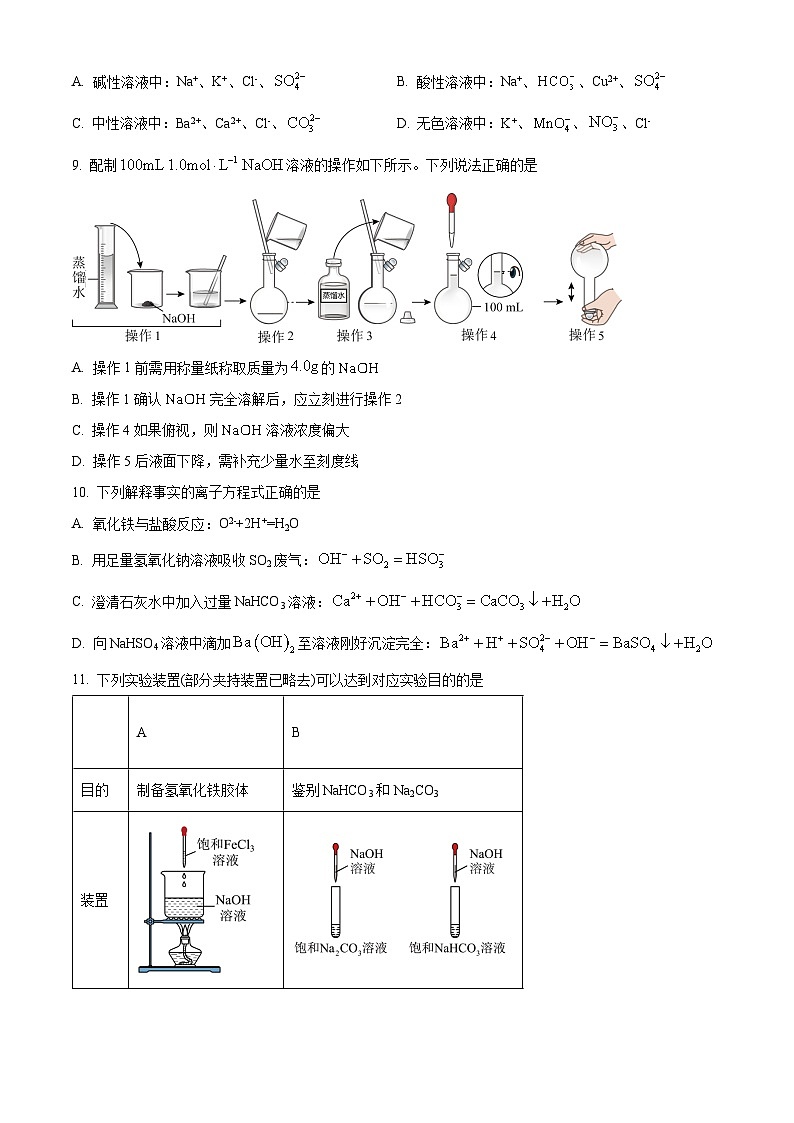
9. 配制溶液的操作如下所示。下列说法正确的是
A. 操作1前需用称量纸称取质量为的
B. 操作1确认完全溶解后,应立刻进行操作2
C. 操作4如果俯视,则溶液浓度偏大
D. 操作5后液面下降,需补充少量水至刻度线
10. 下列解释事实的离子方程式正确的是
A. 氧化铁与盐酸反应:O2-+2H+=H2O
B. 用足量氢氧化钠溶液吸收SO2废气:
C. 澄清石灰水中加入过量NaHCO3溶液:
D. 向NaHSO4溶液中滴加至溶液刚好沉淀完全:
11. 下列实验装置(部分夹持装置已略去)可以达到对应实验目的的是
A. AB. BC. CD. D
12. 下列说法正确的是
A. 常温下的气体摩尔体积一定大于22.4L·ml-1
B. 等温等压下,N2气体与CO2气体的密度之比等于7:11
C. 在一定温度和压强条件下,CH4的扩散速率是SO2的4倍
D. 某种气态碳氢化合物在标准状况下的密度约是1.875g·L-1,该化合物可能是C3H8
13. 实验室欲研究0.200ml/L CuSO4和1.00ml/L氨水的反应,先用容量瓶配制溶液,再进行下列一系列操作,下列叙述中正确的是
A. 配制220mL 0.200ml/L CuSO4溶液,需要称取胆矾(CuSO4·5H2O)固体12.5g
B. 稀释10.0ml/L氨水溶液至1.00ml/L,可取浓溶液10mL加90mL水
C. 向10mL上述CuSO4中滴加2mL稀释后的氨水即可使其完全沉淀
D. 向CuSO4溶液中滴加少量氨水的离子方程式为Cu2++2OH-=Cu(OH)2↓
14. 在不同条件下,当KMnO4与KI按照反应①②的化学计量比恰好反应,结果如下。
已知:i. 的氧化性随着酸性减弱而减弱;
ii.溶液的酸性越强,pH越小,溶液的碱性越强,pH越大
下列说法正确的是
A 对比反应①和②,x=1
B. 反应①,n(Mn2+):n(I2)=1:5
C. 对比反应①和②,I-的还原性随酸性减弱而减弱
D. 随着反应进行,体系①②的pH都增大
第Ⅱ卷 非选择题(共58分)
15. 浩瀚的海洋为我们带来丰富的资源,可以从海水中提取食盐、镁等化工产品。回答下列问题。
I.食盐精制
除去粗盐中的Ca2+、Mg2+、等杂质离子时,粗盐溶解后一共加入3种沉淀剂,分别是:①过量的Na2CO3溶液;②过量的______溶液;③过量的NaOH溶液。过滤除去沉淀,再加入适量的盐酸。
(1)补充上述过程中②的试剂___________,加入上述3种沉淀剂的正确顺序是___________(填字母标号)。
(2)加入过量Na2CO3溶液,一定发生反应的离子方程式___________。
Ⅱ.海水提镁
(3)镁离子的原子结构示意图为___________;
(4)将石灰乳加入沉淀池发生的离子反应方程式为___________;
(5)已知MgCl2的溶解度如下表,则操作B为加热浓缩→___________→洗涤→干燥;
(6)设某温度下,饱和MgCl2溶液的溶解度为sg,密度为ρg/mL,则该温度下饱和MgCl2溶液的物质的量浓度为___________(用含s和ρ的字母表示)。
16. 某实验小组为了测定已变质的过氧化钠样品中Na2O2的质量分数,称取ag样品,并设计了如图所示的装置进行实验。
(1)装置A中盛放盐酸的仪器名称是___________,装置B的作用是___________。
(2)写出装置C中发生主要反应的化学方程式:___________。
(3)装置D中盛装的试剂为___________。
(4)实验结束后,在读取生成气体的体积时,认为合理的是___________(填字母)。
a.直接读取体积,不需冷却到室温
b.移动量筒使E、F内液面高度相同
c.视线与凹液面的最低处相平
(5)读出量筒内水的体积后,折算成20℃,101kPa下气体的体积为VmL,已知该条件下氧气的密度为ρg/L,则该样品中过氧化钠的质量分数为___________(表达式要用a、V、ρ表示,结果要化简)
17. 含氯消毒剂在新冠肺炎疫情防控中发挥了巨大作用,其中最常用的就是84消毒液。回答下列问题:
已知:①84消毒液中的有效成分是NaClO,在水中生成少量的HClO,HClO酸性比碳酸弱,但比强,具有强氧化性;
②根据反应规律,溶液中较强酸可以制备较弱酸,如2CH3COOH+CO=CO2+H2O+2CH3COO-说明醋酸酸性比碳酸强;
(1)写出HClO的电离方程式___________;
(2)喷洒84消毒液后,溶液中的NaClO与空气中的CO2反应,生成更多HClO增强杀菌效果。结合较强酸制较弱酸的反应规律,写出该反应的离子方程式:___________。
(3)在使用84消毒液的过程中,严禁将其与洁厕灵(主要成分为浓盐酸)混合使用,否则将会产生Cl2而使人中毒。写出该反应的离子方程式:___________。
(4)利用NaClO溶液可以制备KI,过程如下:
已知:N2H4为非电解质,沸点113.5℃,氧化产物为N2
①NH3和NaClO反应生成N2H4的离子反应方程式为___________;
②N2H4和I2、KOH反应生成KI的离子反应方程式为___________。
(5)二氧化氯(ClO2)是一种环保型杀菌消毒剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。用ClO2消毒后的水可以直接饮用。常温下ClO2为黄绿色或橘黄色气体,性质非常不稳定。可以用氯酸钠(NaClO3)和硫酸酸化的H2O2反应制备ClO2。
①请写出上述制备ClO2反应的离子方程式:___________。
②将ClO2溶液与H2S溶液混合,充分反应后,往所得溶液中加入少量BaCl2溶液,有白色沉淀生成。请写出ClO2溶液与H2S溶液反应的离子方程式:___________。
③“有效氯”可用来衡量含氯消毒剂的消毒能力。其定义是:
有效氯=有效系数×含氯量
其中,有效系数=夺取电子数(也就是消毒剂分子式中Cl元素的总得电子数),
含氯量=氯元素相对原子量÷消毒剂相对分子量。
已知:消毒过程中ClO2和Cl2的还原产物相同,Cl2的“有效氯”为1,则ClO2的“有效氯”为___________。(结果保留三位有效数字)
18. 铜是人类最早使用的金属之一,人类使用铜及其合金已有数千年历史。铜在自然界存在于多种矿石中,如黄铜矿(CuFeS2),辉铜矿(Cu2S)等,其中,S均为-2价。目前,铜及其化合物在日常生活和工业生产中有着广泛用途。
(1)黄铜矿(CuFeS2)在硫酸溶液中被氧气氧化的反应如下,请完成该氧化还原反应方程式:___________
___________CuFeS2+___________O2+___________=___________Cu2++___________Fe3++___________SO+___________
(2)工业上以黄铜矿为原料,采用火法熔炼工艺生产铜。
①该工艺的中间过程会发生Cu2O与Cu2S反应,生成Cu和SO2,写出该反应的化学方程式___________。
②该反应中,氧化剂是___________,每生成1mlSO2,转移电子的物质的量为___________ml。
(3)已知Cu2S可与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O。当NO2和NO的物质的量之比为1:1时,该反应的离子方程式为___________。
19. 从矿石中提取金(Au)是获取贵金属的主要来源。
(1)俗话说“真金不怕火炼”,从氧化还原性角度解释其原因是___________。
(2)HNO3单独不能溶解Au,但HNO3-NaCl可以溶解金生成HAuCl4,
已知:HAuCl4=H++AuCl
①将溶金反应的化学方程式补充完整:___________。
Au+___________Cl-+H++___________NO=+___________NO+___________H2O
②关于溶金的下列说法正确的是___________。
A.用到了HNO3的氧化性
B.用到了NaCl的还原性
C.与王水[V(浓硝酸):V(浓盐酸)=1:3]溶金原理相同
D.用浓盐酸与NaNO3也可使Au溶解
(3)若用Zn粉将溶液中的1mlHAuCl4完全还原,则参加反应的Zn的物质的量是___________ml。
(4)为解释硝酸不能溶金,而王水能溶金的原因,小组同学提出假设:浓盐酸提高了浓硝酸的酸性,造成硝酸氧化性增强。
查阅资料:配制王水时,实验室常用的浓硝酸的质量分数为69%、密度为1.42g/cm3、浓度约为15.6ml/L;常用的浓盐酸的质量分数约为37%、密度为1.19g/cm3、浓度约为12.1ml/L。
①分析该假设是否合理,并说明理由___________
②若认为不合理,请你提出一条合理的假设___________。选项
A
B
C
D
物质
二氧化硅
蛋白质溶液
盐酸
氢氧化钙
类别
离子化合物
混合物
强电解质
强碱
性质
熔融态能导电
具有丁达尔效应
能用来除水垢
受热易分解
A
B
目的
制备氢氧化铁胶体
鉴别NaHCO3和Na2CO3
装置
C
D
目的
用CCl4萃取碘水中I2
提纯氢氧化铁胶体
装置
反应序号
起始酸碱性
KI
KMnO4
还原产物
氧化产物
物质的量/ml
物质的量/ml
①
酸性
0.1
a
Mn2+
I2
②
中性
0.02
20a
MnO2
温度/℃
0
10
20
40
60
80
100
溶解度/g
52
53
54
57
61
66
73
相关试卷
这是一份北京市第一六一中学2024-2025学年高一上学期10月月考化学试卷(Word版附解析),文件包含北京市第一一六中学2024-2025学年高一上学期10月份阶段练习化学试题Word版含解析docx、北京市第一一六中学2024-2025学年高一上学期10月份阶段练习化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
这是一份北京市第十一中学2024-2025学年高一上学期10月月考化学试卷(Word版附解析),文件包含北京市第十一中学2024-2025学年高一上学期10月月考化学试题Word版含解析docx、北京市第十一中学2024-2025学年高一上学期10月月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共32页, 欢迎下载使用。
这是一份北京市第十一中学2024-2025学年高二上学期9月月考化学试卷(Word版附解析),文件包含北京市第十一中学2024-2025学年高二上学期9月月考化学试题Word版含解析docx、北京市第十一中学2024-2025学年高二上学期9月月考化学试题Word版无答案docx等2份试卷配套教学资源,其中试卷共30页, 欢迎下载使用。









